
- •Аннотация
- •1. Введение
- •1.1 Общие правила выполнения лабораторных работ.
- •1.2. Лабораторное оборудование.
- •1.3 Вычисления.
- •1.4 Количество и концентрация вещества.
- •Общие указания по выполнению лабораторных работ.
- •Работа 1. Ознакомление с некоторыми операциями лабораторной практики и измерительными приборами.
- •Работа 2. Классы неорганических соединений.
- •Работа 3. Определение молярной массы диоксида углерода.
- •Работа 4. Электронная структура атомов и одноатомных ионов.
- •Работа 5. Кинетика химических реакций.
- •Работа 6. Химическое и адсорбционное равновесие.
- •Работа 7. Концентрация растворов.
- •Работа 8. Свойство водных растворов электролитов.
- •Работа 9.Гидролиз солей.
- •Работа 10. Окислительно-восстановительные реакции.
- •Работа 11. Основы электрохимии.
- •Работа 12. Электролиз.
- •Работа 13. Общие химические свойства металлов.
- •Работа 14. Свойства d-элементов 4-го периода.
- •Работа 15. Свойства элементов, применяемых в полупроводниковой технике.
- •Работа 16. Определение жесткости и умягчение воды.
- •Работ 17 Органические соединения.
- •Работа. 18. Свойства элементов подгруппыViв иViiв
- •Работа 19. Свойства элементов подгруппыViiib.
- •Работа 20. Свойства элементов подгруппыIva.
- •Работа 21, Свойства элементовVAиVia.
Работа 9.Гидролиз солей.
Цель работы - изучение некоторых реакций обмена между электролитами; изучение водных растворов солей, связанных с реакцией гидролиза.
Реакции обмена.
Обязательным условием течения реакций между электролитами является удаление из раствора тех или иных ионов - например, вследствие образования слабо диссоциирующих веществ, или веществ, выделяющихся из раствора в виде осадка или газа. Иначе говоря, реакции в растворах электролитов всегда идут в сторону образования наименее растворимых веществ.
Уравнения реакций в таких случаях рекомендуется записывать в молекулярно-ионной форме, которая позволяет лучше понять сущность протекающих процессов. В молекулярно-ионных уравнениях сильные электролит пишутся в виде ионов, а слабые электролиты, трудно растворимые вещества - в виде молекул.
Существует четыре случая обменных реакций в растворах электролитов, равновесие которых сильно смещено в сторону образования продуктов реакции:
Реакции, идущие с образованием осадка.

Реакции, сопровождающиеся образованием газообразных (летучих) веществ.
![]()
Реакции, протекающие с, образованием слабых электролитов.
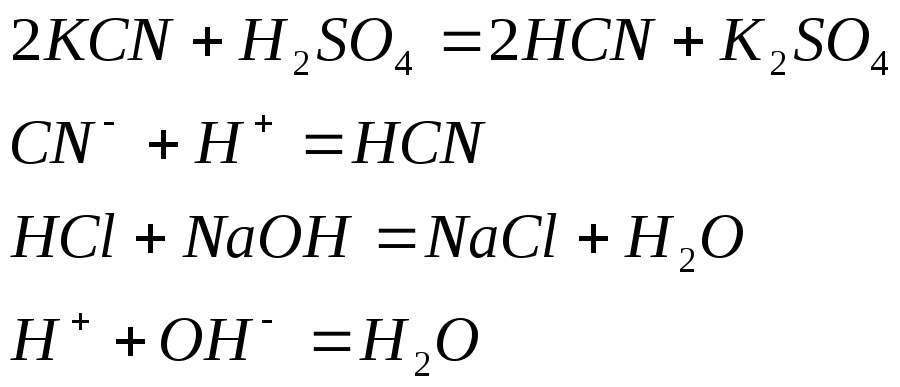
Реакции, идущие с образованием комплексных ионов.

Гидролиз солей.
Гидролизом
называются обменные химические реакции,
протекающие с участием воды. Гидролизом
соли называются, взаимодействие соли
с водой. Приводящее к образованию слабого
электролита (слабой кислоты, слабого
основания, кислого или основного иона).
В результате гидролиза в растворе
накапливаются
![]() или
или![]() ионы, поэтому растворы многих солей
имеют кислую или щелочную реакцию среды.
ионы, поэтому растворы многих солей
имеют кислую или щелочную реакцию среды.
Признаком
гидролиза соли является изменение
нейтральной реакции среды водного
раствора. Например, при растворении в
воде хлорида аммония
![]() образуется избыток ионов
образуется избыток ионов![]() и раствор подкисляется (
и раствор подкисляется (![]() < 7):
< 7):
![]()
или
![]()
Однако
не все соли вступают в реакцию гидролиза.
Если растворить в воде хлорид калия
![]() .
нейтральная реакция среды (
.
нейтральная реакция среды (![]() =7),
характерная для чистой воды, не изменяется,
т.е. в растворе сохранится равенство
=7),
характерная для чистой воды, не изменяется,
т.е. в растворе сохранится равенство![]() .
.
![]()
или
![]()
Можно
утверждать, что соли, образованные
сильным основанием и сильной кислотой
(![]() ,
,![]() ,
,![]() и т.п.), в реакцию гидролиза не вступают.
и т.п.), в реакцию гидролиза не вступают.
С водой взаимодействуют:
1)
соли, образованные слабыми основаниями
и сильными кислотами. (![]() ,
,![]() ,
,![]() ,
,![]() и т.п.).
и т.п.).
2)
соли, образованные слабыми кислотами
и сильными основаниями. (![]() ,
,
![]() ,
,
![]() ,
и т.п.).
,
и т.п.).
3)
соли, образованные слабыми основаниями
и слабыми кислотами. (![]() ,
,![]() и т.п.).
и т.п.).
Из
рассмотренных примеров следует, что в
реакции с водой вступают катионы слабых
оснований и анионы слабых кислот. Если
эти ионы многозарядные (Fe3+,
Cu2+,
![]() ,
,![]() и т.п.) их взаимодействие с водой обычно
идет до образования основного или
кислого иона (первая ступень гидролиза).
Первая ступень гидролиза выражена
наиболее сильно.
и т.п.) их взаимодействие с водой обычно
идет до образования основного или
кислого иона (первая ступень гидролиза).
Первая ступень гидролиза выражена
наиболее сильно.
Например:

Количественно
гидролиз характеризуется степенью
гидролиза (![]() )
и константой гидролиза (
)
и константой гидролиза (![]() ).
Степень гидролиза представляет собой
отношение числа молекул, подвергшихся
гидролизу (С), к общему числу молекул
данной соли (
).
Степень гидролиза представляет собой
отношение числа молекул, подвергшихся
гидролизу (С), к общему числу молекул
данной соли (![]() ).
).
![]()
Для
солей, образованных сильным основанием
и сильной кислотой
![]() =0.
Для солей, образованных слабым основанием
и слабой кислотой в разбавленных
растворах
=0.
Для солей, образованных слабым основанием
и слабой кислотой в разбавленных
растворах![]() =100%.
=100%.
В
общем виде реакцию гидролиза соли
![]() можно представить уравнением:
можно представить уравнением:![]()
Константа равновесия этого процесса:
![]()
Так
как [![]() ]
в разбавленных растворах можно считать
величиной постоянной то и произведениеK*[
]
в разбавленных растворах можно считать
величиной постоянной то и произведениеK*[![]() ]
также постоянно. Эту величину называют
константой гидролиза, т.е.
]
также постоянно. Эту величину называют
константой гидролиза, т.е.
![]()
В
случае гидролиза по аниону (например,
для
![]() )
уравнение принимает вид:
)
уравнение принимает вид:
![]() или
или
![]()
![]() -
ионное произведение воды.
-
ионное произведение воды.
Аналогично
для гидролиза по катиону (например, для
![]() )
)
![]()
Для гидролиза по катиону и аниону получаем:
![]()
К
реакциям гидролиза соли применимы все
положения и законы о химическом
равновесии. Равновесие процесса
гидролиза, отвечающее равенству скоростей
реакций гидролиза и нейтрализации (![]() )
подвижно и может быть смещено вправо
(
)
подвижно и может быть смещено вправо
(![]() )
или влево (
)
или влево (![]() )
в соответствии с принципом Ле Шателье.
Так, например, при повышении температуры
равновесия гидролиза смещается вправо,
так как прямая реакция эндотермическая
(
)
в соответствии с принципом Ле Шателье.
Так, например, при повышении температуры
равновесия гидролиза смещается вправо,
так как прямая реакция эндотермическая
(![]() > 0), а обратная (нейтрализация) -
экзотермическая (
> 0), а обратная (нейтрализация) -
экзотермическая (![]() <
0).
<
0).
Связь
между константой гидролиза соли (![]() )
и степенью гидролиза (
)
и степенью гидролиза (![]() )
в растворе заданной концентрации (
)
в растворе заданной концентрации (![]() )
выражается законом Оствальда:
)
выражается законом Оствальда:
![]()
Рассмотрим несколько примеров (все расчеты выполняются с допущением С = а - равенство концентраций ионов их активностям).
ПРИМЕР 1.
Рассчитайте
константу, и степень гидролиза соли
![]() в 0,001н растворе при 289К, учитывая только
первую ступень процесса.
в 0,001н растворе при 289К, учитывая только
первую ступень процесса.
Решение:
соль
![]() образована сильным основанием и слабой
кислотой, поэтому гидролизуются только
ионы
образована сильным основанием и слабой
кислотой, поэтому гидролизуются только
ионы![]() .
Уравнение реакции:
.
Уравнение реакции:
![]()
Константа равновесия процесса:
![]()
умноженная на концентрацию воды:
![]()
называется константой гидролиза соли. Ее вычисляют по формуле:
![]()
где
![]() - ионное произведение воды;
- ионное произведение воды;
![]() -
константа диссоциации продукта гидролиза.
Следовательно:
-
константа диссоциации продукта гидролиза.
Следовательно:
![]() =10-14/(4,8*10-11)
=10-14/(4,8*10-11)
Следует обратить внимание на то, что величина константы гидролиза, как и любой другой константы равновесия реакции, не зависит от концентрации растворенного вещества, а зависит лишь от температуры.
Степень
гидролиза
![]() может быть вычислена по формуле:
может быть вычислена по формуле:
![]()
![]()
откуда
![]() или
или![]()
ПРИМЕР 2.
Рассчитайте
![]() 0,1н раствора
0,1н раствора![]() .
.
Решение:
соль
![]() образована слабым основанием и сильной
кислотой, поэтому гидролизуются ионы
образована слабым основанием и сильной
кислотой, поэтому гидролизуются ионы![]() .
Уравнение реакции:
.
Уравнение реакции:
![]()
при гидролизе хлорида аммония в растворе образуется избыток ионов водорода. Водородный показатель среды вычисляют по формуле:
![]()
![]() в
растворе
в
растворе
![]() равно концентрации прореагировавших
ионов
равно концентрации прореагировавших
ионов![]()
Значение
![]() вычисляют по уравнению
вычисляют по уравнению![]() .
.
Итак:![]()
Определяем
степень гидролиза соли
![]() по уравнению:
по уравнению:

Зная
![]() ,
находим
,
находим![]() :
:
![]() =0,1*0,75*10-4=0,75*10-5
моль/л
=0,1*0,75*10-4=0,75*10-5
моль/л
![]() =-lg0,75*10-5=5,125
=-lg0,75*10-5=5,125
Экспериментальная часть.
ОПЫТ 1. Ионные реакции обмена с образованием слабого электролита.
а) положите, в пробирку несколько кристаллов хлорида аммония и прилейте раствор гидроксида натрия. Определите выделяющийся газ по запаху, слегка нагрев пробирку. Составьте уравнение реакции.
б) спустите в пробирку несколько кристаллов ацетата натрия и прилейте разбавленную серную кислоту. Напишите уравнение реакции.
ОПЫТ 2. Ионные реакции обмена с образованием осадков.
Налейте в три пробирки по 2-3 капли раствора хлорида бария и добавьте в одну из них несколько капель раствора сульфата натрия, а в другую - раствора серной кислоты, в третью - раствора сульфата алюминия. Наблюдайте появление одинакового осадка. Составьте уравнения реакций. Что можно сказать о сущности реакций в проделанном опыте?
ОПЫТ
3. Гидролиз солей. В четыре пробирки
налейте по 1мл воды и по 1-2 капли фиолетового
раствора лакмуса. В три пробирки введите
1-2 капли карбоната натрия
![]() ,
хлорида цинка
,
хлорида цинка![]() и нитрата натрия
и нитрата натрия![]() .
Четвертая пробирка служит для сравнения
полученных окрасок.
.
Четвертая пробирка служит для сравнения
полученных окрасок.
Какие из испытуемых солей подвергаются гидролизу? Составьте уравнения гидролиза.
ОПЫТ 4. Смещение равновесия реакции гидролиза соли при разбавлении раствора.
Убедитесь в том, что концентрированный раствор нитрата свинца прозрачен.
В
коническую колбу налейте 50мл
дистиллированной воды и добавьте 1-2
капли концентрированного раствора
![]() .
Наблюдайте образование осадка.
.
Наблюдайте образование осадка.
При оформлении опыта:
Назовите гидролизующийся ион, составьте уравнение реакции гидролиза и объясните, почему концентрированный раствор
 прозрачен.
прозрачен.Объясните, почему при разбавлении в колбе появляется осадок. Составьте уравнение образования осадка. Имеет ли отношение эта реакция к процессу гидролиза рассматриваемой соли?
Сделайте вывод о влиянии разбавления растворов, гидролизирующихся солей на гидролитическое равновесие.
ОПЫТ 5. Смещение равновесия реакции гидролиза при изменении температуры.
В
пробирку внесите 5-6 мл раствора ацетата
натрия
![]() и 1-2 капли индикатора (фенолфталеина).
Содержимое пробирки разделите на две
части, одну из них оставьте для сравнения,
другую нагрейте до кипения.
и 1-2 капли индикатора (фенолфталеина).
Содержимое пробирки разделите на две
части, одну из них оставьте для сравнения,
другую нагрейте до кипения.
Сравните окраску индикатора в обеих пробирках. Дайте пробирке охладиться и снова сравните окраску индикатора в обеих пробирках. Опишите и поясните свои наблюдения.
Составьте уравнение реакции гидролиза соли, назвав предварительно гидролизующийся ион. Сделайте вывод о среде раствора и о влиянии температуры на гидролитическое равновесие.
Контрольные вопросы.
Составьте ионно-молекулярные уравнения следующих реакций:
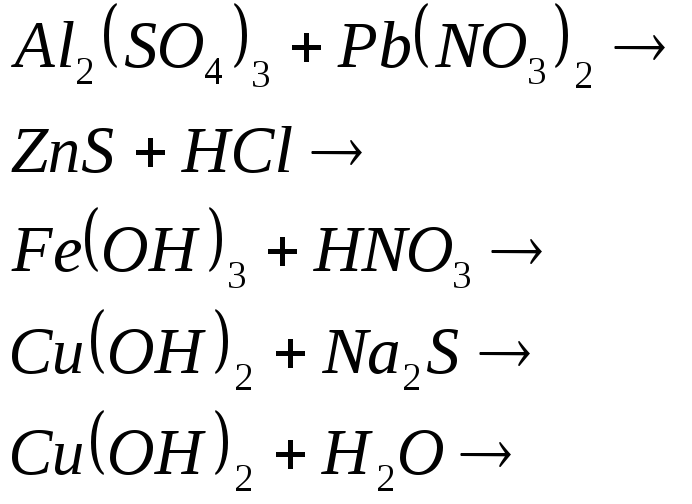
Что называется степенью и константой гидролиза соли?
Имеются растворы солей
 ,
, ,
,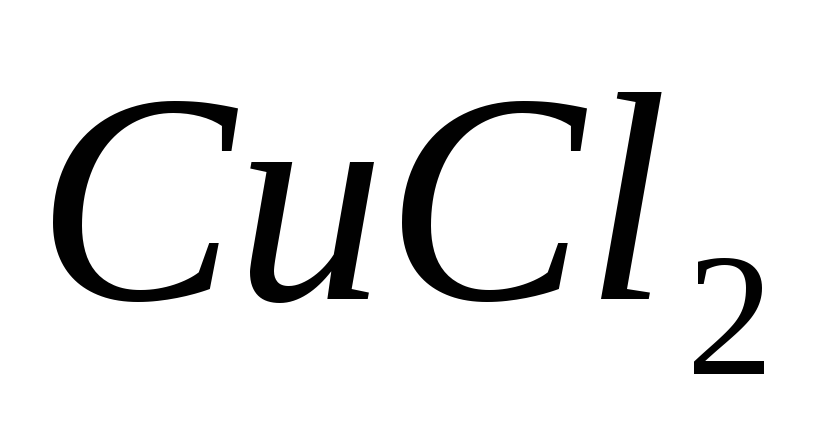 ,
, .
В каких растворах концентрация иона
.
В каких растворах концентрация иона равна концентрации иона
равна концентрации иона ?
Ответ объясните.
?
Ответ объясните.Можно ли пользуясь фенолфталеином, отличить водный раствор
 от
водного раствора
от
водного раствора ?
Ответ поясните.
?
Ответ поясните.Можно ли с помощью
 -
метра отличить водный раствор
-
метра отличить водный раствор от: водного раствора
от: водного раствора ?
Ответ поясните.
?
Ответ поясните.Справедливо ли утверждение о том что водные растворы
 и
и имеют одинаковое значение водородного
показателя среды? Ответ поясните.
имеют одинаковое значение водородного
показателя среды? Ответ поясните.Используя справочные данные, рассчитайте константу гидролиза соли
 .
Ответ: 0,57*10-9.
.
Ответ: 0,57*10-9.На примерах гидролиза солей
 и
и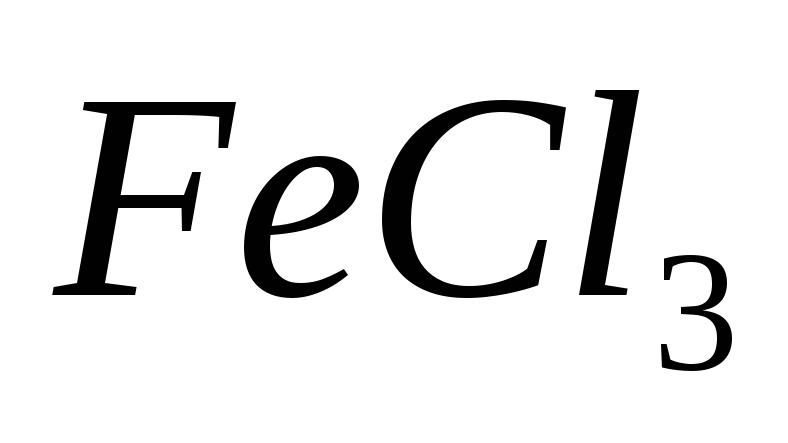 объясните ступенчатое протекание
процесса гидролиза при нагревании или
разбавлении растворов. Составьте
уравнения реакций.
объясните ступенчатое протекание
процесса гидролиза при нагревании или
разбавлении растворов. Составьте
уравнения реакций.Вычислите
 0,1М раствора
0,1М раствора (при расчете учитывайте только первую
ступень гидролиза). Ответ: 4,26.
(при расчете учитывайте только первую
ступень гидролиза). Ответ: 4,26. водного
раствора
водного
раствора
 равен 5. Составьте уравнение реакции
гидролиза и рассчитайте исходную
концентрацию раствора. Ответ: 0,179 моль/л.
равен 5. Составьте уравнение реакции
гидролиза и рассчитайте исходную
концентрацию раствора. Ответ: 0,179 моль/л.
