
- •1.1 Электронное строение твердых тел. Зонное строение твердых тел..........8
- •1 Электронное строение твердых тел. Зонное строение твердых тел. Энергия ферми
- •1.1 Электронное строение твердых тел. Зонное строение твердых тел
- •1.2 Энергия Ферми
- •Активные диэлектрики. Пьезоэлектирики. Их особенности
- •Активные диэлектрики
- •2.2 Пьезоэлектрики
- •3 ПОвЕдение твердых тел в магнитном поле. Магнитные свойства твердых тел
- •3.1 Магнитное поле в магнетиках
- •3.2 Магнитные свойства твердых тел
- •3.2.1 Диамагнитные и парамагнитные тела
- •3.2.2 Ферромагнитные тела
- •4 Рентгенофазовый и рентгеноструктурный анализ
- •4.1 Рентгеновские спектры
- •4.2 Рентгеноструктурный анализ
- •4.2.1 Методы рентгеновской съёмки кристаллов.
- •4.2.2 Применение рентгеноструктурного анализа
- •4.3 Рентгенофазовый анализ
- •Расшифровка дифрактограмм
- •5 Магнитные характеристики материалов
- •6 Задача
1.1 Электронное строение твердых тел. Зонное строение твердых тел
Электронную структуру металлов, полупроводников и многих других твердых тел можно описать в рамках зонной теории. В металлах, например в алюминии, внутренние электроны (1s, 2s и 2р) локализованы на дискретных атомных орбиталях отдельных атомов алюминия. В то же время образующие валентную оболочку 3s- и Зр- электроны занимают энергетические уровни, которые делока лизованы по всей кристаллической решетке металла. Эти уровни подобны гигантским молекулярным орбиталям, на каждой из которых находятся по два электрона. Практически в каждом твердом веществе должно существовать огромное количество таких уровней энергии, которые очень близки друг к другу. Так, в кристалле алюминия, содержащем N атомов, каждый из которых имеет одну Зs- орбиталь, образуется зона, включающая N энергетически эквивалентных уровней. Такая зона называется 3s- валентной зоной. Аналогично Зр- орбитали атомов алюминия образуют при делокализацин Зр- зону энергетических уровней [1].
Аналогичным способом можно представить образование зонной структуры других материалов. Тогда металлы, полупроводники и диэлектрики различаются:
по зонной структуре;
степенью заполнения валентных зон:
шириной энергетически запрещенной зоны, расположенной между полностью заполненной и пустой зонами.
Основные положения зонной теории построены на данных рентгеноспектральных исследований и двух независимых теоретических подходах. Согласно «химическому подходу», зонная теория сводится к распространению теории молекулярных орбиталей в том виде, в каком она обычно применяется для описания небольших молекул конечных размеров, на случай бесконечных трехмерных структур. В рамках теории молекулярных орбиталей двухатомных молекул рассматривается перекрывание электронных орбиталей двух атомов, приводящее к образованию двух молекулярных орбиталей, которые делокализованы в пространстве между обоими атомами. Одна из молекулярных орбиталей — связывающая — характеризуется более низким уровнем энергии, чем уровни атомных орбиталей. Энергия другой орбитали — антисвязывающей – выше энергии атомных орбиталей (рис. 1.1).
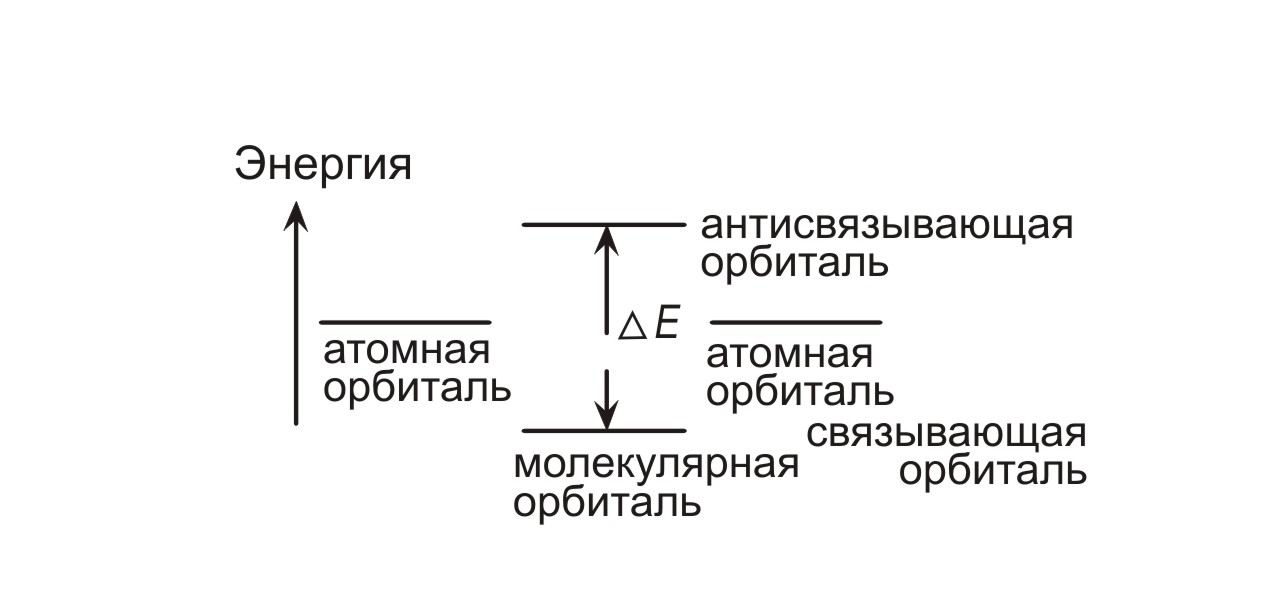
Рис. 1.1 Молекулярные орбитали в двухатомной молекуле.
Распространение такого подхода на молекулы, состоящие из большего числа атомов, ведет к увеличению количества молекулярных орбиталей. Из каждой атомной орбитали, входящей в систему, возникает одна молекулярная орбиталь. Поскольку число молекулярных орбиталей возрастает, энергетическое различие между соседними молекулярными орбиталями должно уменьшаться (рис. 1.2). Энергетический «зазор» между связывающей и антисвязывающей орбиталями также уменьшается до тех пор, пока не достигается состояние, когда образуется «континуум» энергетических уровней [1].
Металлы можно рассматривать как бесконечно большие «молекулы», в которых существует огромное число энергетических уровней или «молекулярных» орбиталей.
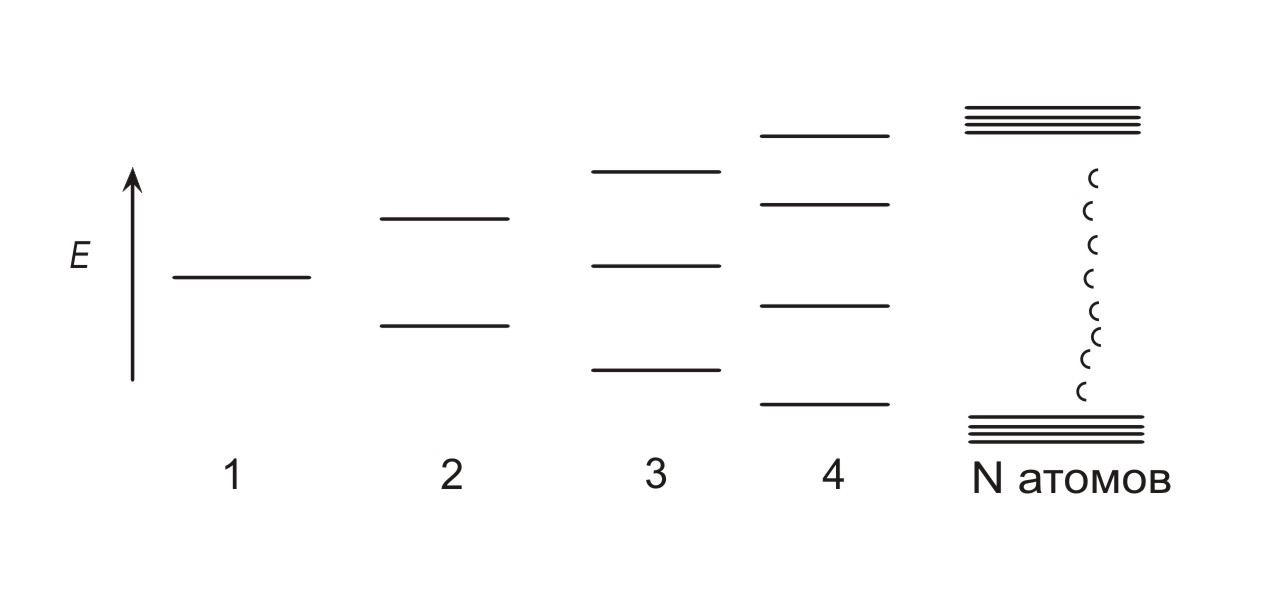
Рис. 1.2 Расщепление энергетических уровней согласно теории молекулярных орбиталей
В одном моле металла число таких уровней ~6* 1023. В этих условиях не имеет смысла рассматривать каждый из энергетических уровней, так как каждый из них делокализован в пространстве всех атомов кристаллической решетки металла. Поэтому обычно говорят об энергетических уровнях или энергетических состояниях.
На рис. 1.3 приведена схема зонной структуры металлического натрия, рассчитанная согласно теории «плотной химической связи». Видно, что ширина каждой отдельной энергетической зоны зависит от расстояния между атомами и, следовательно, от степени перекрывания орбиталей соседних атомов [1].
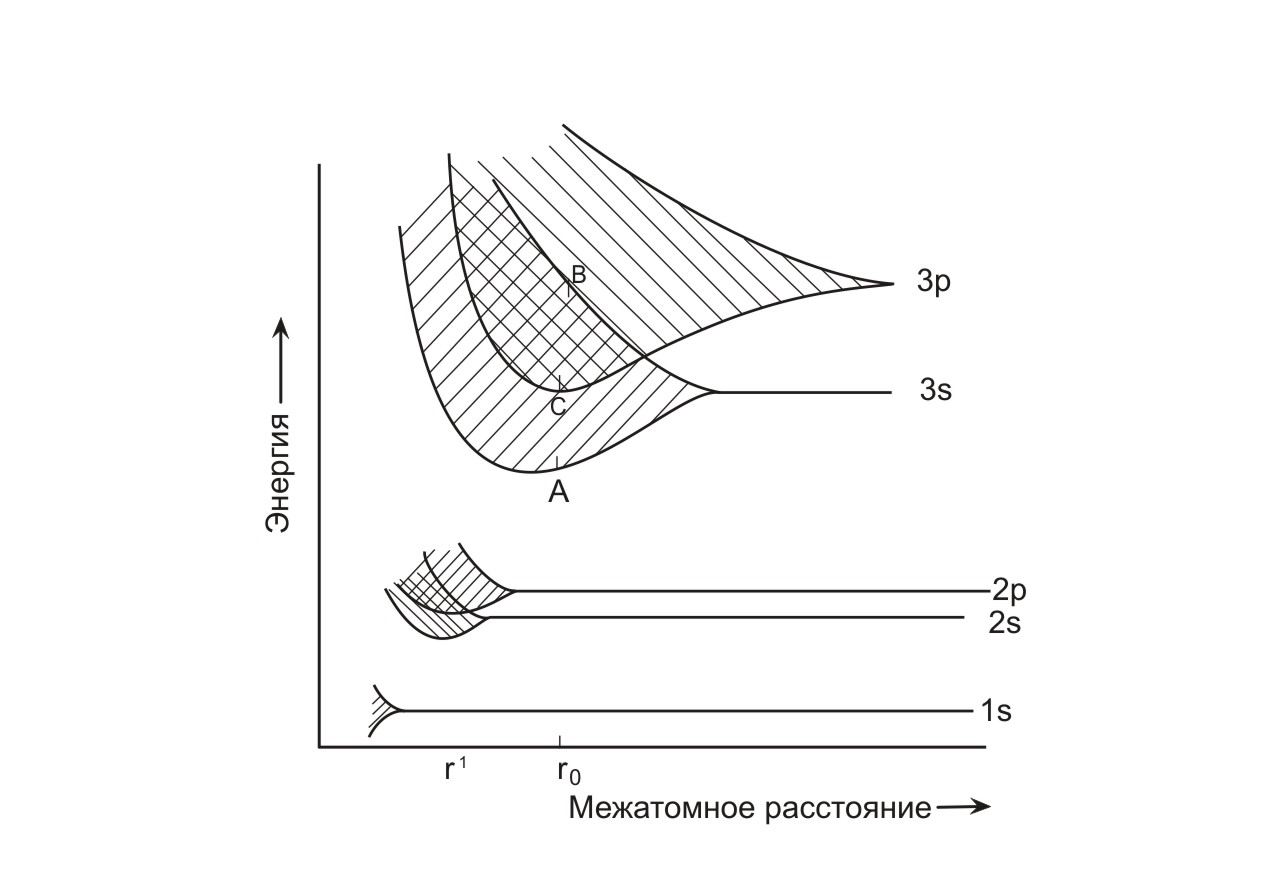
Рис. 1.3 Влияние величины межатомного расстояния на положение энергетических уровней и энергетических зон в натрии (рассчитано в рамках теории «плотной химической связи»).
Как показал расчет, при межатомном расстоянии r0 (экспериментально найденное значение расстояния между атомами Nа в кристаллической решетке металла) Зs- и Зр- орбитали соседних атомов существенно перекрываются, образуя широкие Зs- и Зр- зоны (заштрихованные области на рис. 1.3). Верхние уровни Зs- зоны характеризуются той же энергией, что и нижние уровни Зр-зоны. Следовательно, между Зs- и Зр- зонами не имеется энергетической щели. Перекрывание энергетических полос является важным моментом при объяснении металлических свойств некоторых других элементов, например таких, как щелочноземельные металлы [1].
При межатомном расстоянии r0 1s , 2s- и 2р- орбитали соседних атомов натрия не перекрываются друг с другом. Следовательно, в таких условиях не происходит образования зон, а сохраняются дискретные атомные орбитали, связанные с каждым отдельным атомом.
Запишем электронную конфигурацию атома натрия: 1s² 2s² 2p¹ 3s¹ на каждый атом приходится один валентный электрон. Поскольку 3s- и Зр- зоны перекрываются, валентные электроны не принадлежат Зs- зоне, а распределены на более низких уровнях обоих (Зs + Зр) зон [1].
Согласно «физическому подходу», зонная теория включает анализ энергии и длины волны электронов в твердых телах. В ранней теории свободного электронного газа Зоммерфельда кристаллическая решетка металла рассматривается как некоторая потенциальная яма, в которой наименее прочно связанные с остовом электроны могут двигаться свободно. Энергетические уровни, которые могут занимать электроны, квантованы (как и в квантовомехаиической задаче о движении частицы в потенциальном ящике). Энергетические уровни заполняются электронами попарно, начинам со дна потенциальной ямы. Наивысший заполненный при 0 К уровень называется уровнем Ферми, а отвечающая ему энергия — энергией Ферми Ег. Работа выхода φ— это энергия, необходимая для удаления валентных электронов с верхних уровней потенциальной ямы. Эта величина соответствует потенциалу ионизации изолированного атома [1].
Для наглядного представления плотности электронных состояний принято графически изображать число энергетических уровней N(Е) как функцию энергии Е (рис. 1.4). Согласно теории Зоммерфельда, число доступных энергетических уровней постоянно возрастает с ростом энергии. Хотя энергетические уровни квантованы, их столь много, а разность энергии между соседними уровнями так мала, что они расположены практически непрерывно. При температурах выше 0 К некоторые электроны, находящиеся на уровнях вблизи Ег, получают достаточный запас тепловой энергии, чтобы занять уровни выше уровня Ферми Еу. Следовательно, при некоторых конечных температурах отдельные состояния выше Еу заняты, а некоторые состояния ниже Еу вакантны. Среднее заполнение энергетических уровней при некоторой температуре Т>0 К показано на рис. 1.4 в виде заштрихованной области.
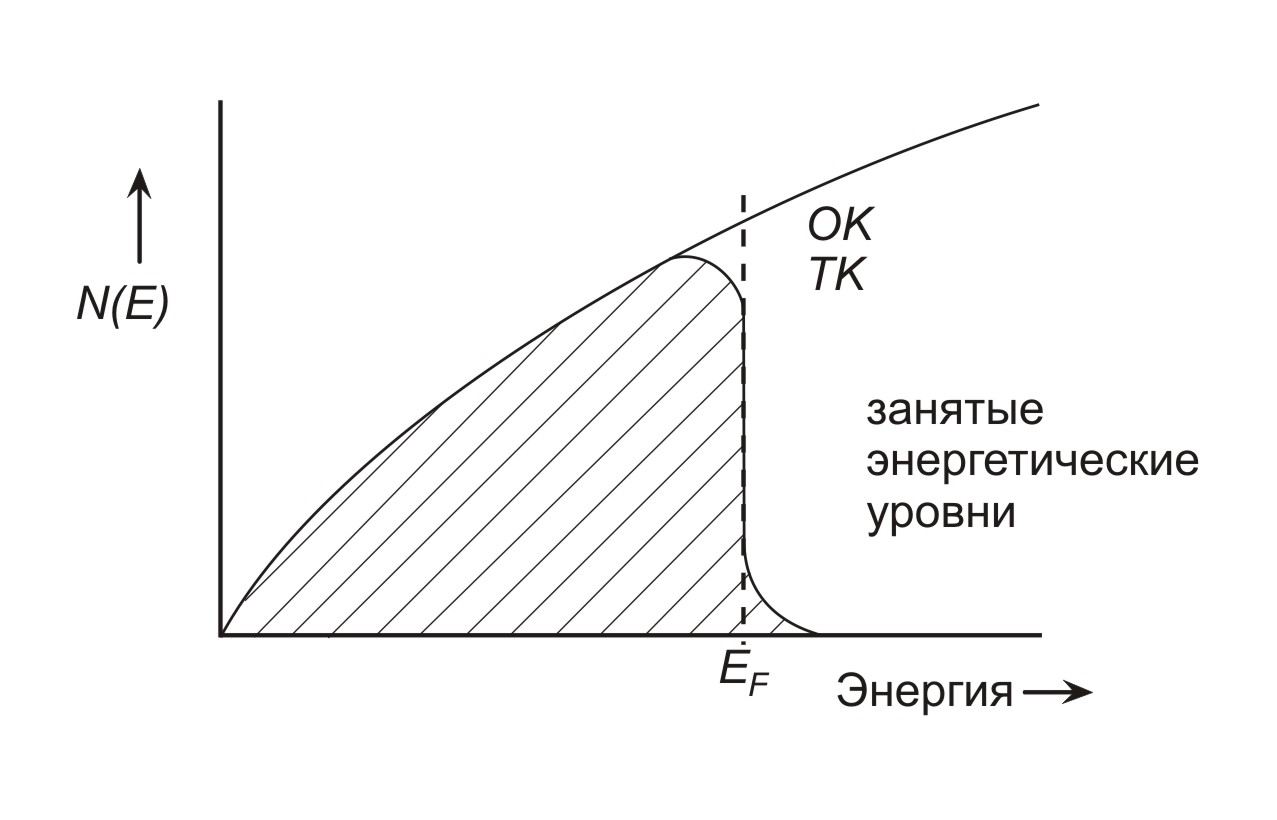
Рис. 1.4 Зависимость плотности электронных состояний ог энергии в теории свободного электронного газа
Высокая электропроводность металлов объясняется движением тех электронов, которые находятся на полузаполпепных уровнях вблизи Еу. Электроны, попарно занимающие состояния в нижней части валентной зоны, не могут передвигаться в каком-либо определенном направлении. Электроны же на однократно заполненных уровнях могут двигаться свободно. Таким образом, переход электронов с заполненного электронного уровня ниже Еу па пустой уровень выше Е приводит к возникновению двух подвижных электронов [1].
Теория свободного электронного газа в общем весьма упрощенно отражает реальную электронную структуру металлов, однако она может служить полезной начальной моделью. В более совершенных теориях потенциальная энергия внутри кристалла или потенциальной ямы не постоянна, как в теории Зоммерфельда, а меняется периодически.
Таким образом, как теория молекулярных орбиталей, так и приближение периодического потенциального поля приводят к выводу о существовании энергетических зон в твердых телах [1].
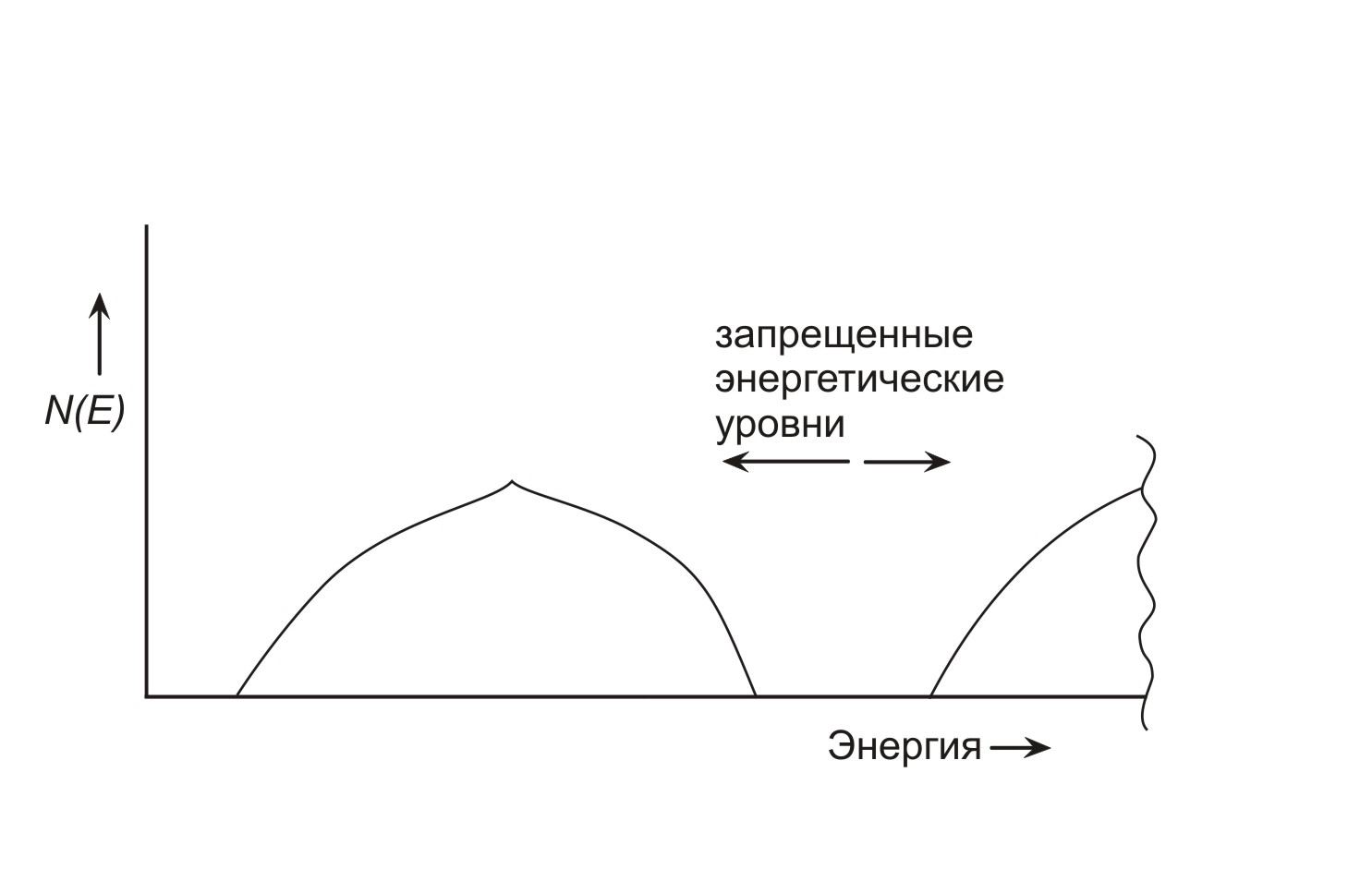
Рис. 1.5 Плотность состояний согласно зонной теории.
В некоторых материалах наблюдается перекрывание различных зон. В других материалах существует запрещенная зона между разрешенными энергетическими зонами.
Экспериментальные подтверждения зонной структуры твердых тел получают из спектроскопических исследований. Электронные переходы между различными энергетическими уровнями можно наблюдать, используя спектральные методы исследования твердых фаз. Наиболее эффективным методом получения информации о строении внутренней и внешней электронных оболочек атомов в твердых телах являются исследования спектров испускания и поглощения рентгеновских лучей. Определенную информацию о внешних валентных электронах атомов можно получить также из спектров в видимой и УФ-области [1].
