
Стандартные условия
Стандартные условия - вещества в стандартных состояниях
H0 - "дельта аш нулевое"
H0T - "дельта аш стандартное при T (К)"
Стандартные условия:
устойчивая модификация (ж.тв.) гипотетич. состояние ид. газа (газы) 1 атм. = 101325 Па
любая температура (обычно 298.15К)
Не путать с нормальными условиями:
1 атм. = 101325 Па
250С = 298.15К
Стандартная энтальпия образования
Энтальпия реакции образования 1 моль соединения из
простых веществ в стандартном состоянии называется стандартной энтальпией образования Hf0
S (тв) + 3F (газ) = SF |
6 |
(тв) |
H0 = H |
0 (SF ) |
2 |
|
f |
6 |
По определению: стандартная энтальпия состояния простого вещества в обычном состоянии равна нулю
Hf0 (Fe, тв) = 0, но
Hf0 (Fe, газ) = 416.3 кДж/моль
Стандартная энтальпия образования
С (графит) + О2 (газ) = СО2 (газ) |
Н(1) = −393.8 кДж/моль |
СО (газ) + 1/2О2 (газ) = СО2 (газ) |
Н(2) = −283.2 кДж/моль |
С (графит) + 1/2О2 (газ) = СО (газ) |
Н(3) = −110.6 кДж/моль |
Н(1) ≡ Hf0 (CO2, газ) = −393.8 кДж/моль
Н(3) ≡ Hf0 (CO, газ) = −110.6 кДж/моль
Н0(2) = H 0 |
(CO , газ) − |
H 0 |
(CO, газ) |
f |
2 |
f |
|
9 Тепловой эффект реакции равен разности между суммой теплот образования всех продуктов реакции и
суммой теплот образования всех реагентов, взятых со
стехиометрическими коэффициентами (следствие
закона Гесса)
Теплоемкость
U и H изменяются с температурой.
Свойство вещества, определяющее его способность
нагреваться, называется теплоемкостью
Теплоемкость – это количество теплоты, необходимое для нагревание одной части вещества на 1 К.
cp = H/ T (p = const) |
cV = U/ T (V = const) |
Дж/моль/К – мольная теплоемкость Дж/кг/К – удельная теплоемкость Дж/м3/К – объемная теплоемкость

ПЕРИОДИЧЕСКИЙ ЗАКОН (ПЗ)
И
ПЕРИОДИЧЕСКАЯ СИСТЕМА (ПС)
ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА

ПС элементов была предложена выдающимся
русским химиком Д.И. Менделеевым в 1869 году
ПЕРИОДИЧЕСКИЙ ЗАКОН
Свойства простых веществ и соединений,
которые они образуют, находятся в
периодической зависимости от величины атомного номера элемента.
В основу современной классификации
элементов положен главный признак – заряд
ядра и электронная конфигурация атомов.

ПЕРИОДИЧЕСКИЙ ЗАКОН
Периодический закон был сформулирован почти
за полстолетия до открытия электрона!
Сформулированный закон позволил:
•уточнить атомные массы многих известных Менделееву элементов;
•предсказать существование и свойства неизвестных в то время элементов (экасилиция (германия), экабора (галлия) и экаалюминия (скандия).
Графическим отображением ПЗ является ПС

ПС ЭЛЕМЕНТОВ ЧАСТО ИСПОЛЬЗУЕМАЯ В РОССИИ
(короткопериодный вариант)
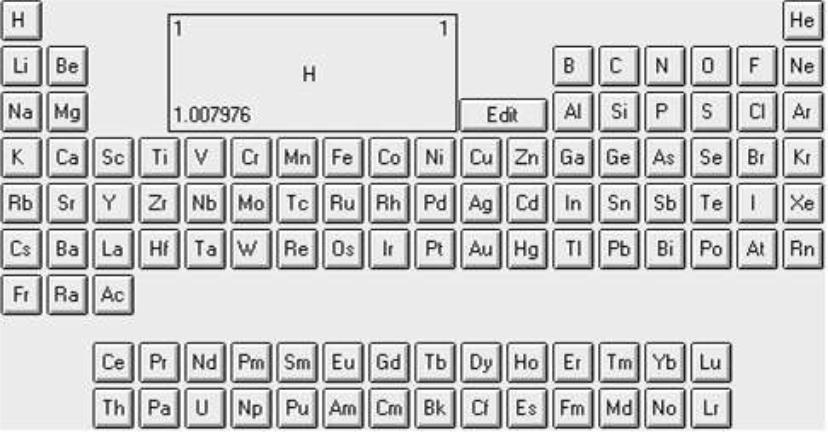
ОФИЦИАЛЬНАЯ ПС ЭЛЕМЕНТОВ ИЮПАК
(длиннопериодный вариант)
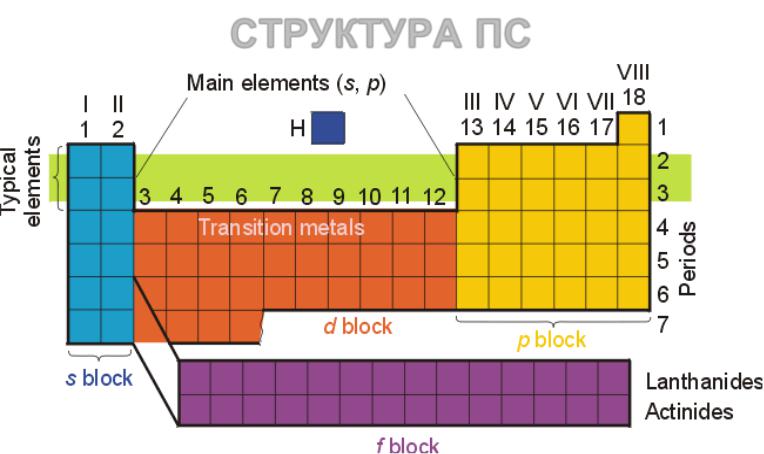
СТРУКТУРА ПС
Лантаниды (лантаноиды) – 4f элементы (ид – от греческого следующий за; оид – от греческого подобный).
Аналогично, актиниды (актиноиды) – 5f элементы
Галогены – элементы 17 группы Халькогены - элементы 16 группы Пниктогены - элементы 15 группы

Закономерности изменения свойств атомов и ионов
К числу важнейших свойств элементов, определяемых электронным строением, относятся:
•радиусы;
•потенциалы ионизации;
•сродство к электрону;
•электроотрицательность.
Все эти характеристики закономерно изменяются по периодам и группам

Закономерности изменения свойств атомов и ионов
Одна из основных характеристик атомов и ионов
– их размеры.
Строение соединений – расположение атомов в
пространстве (расстояния между атомами, углы).
Единица измерения расстояний - 1Å

Металлический радиус
Металлический радиус (для металлов) – половина расстояния между ядрами соседних атомов
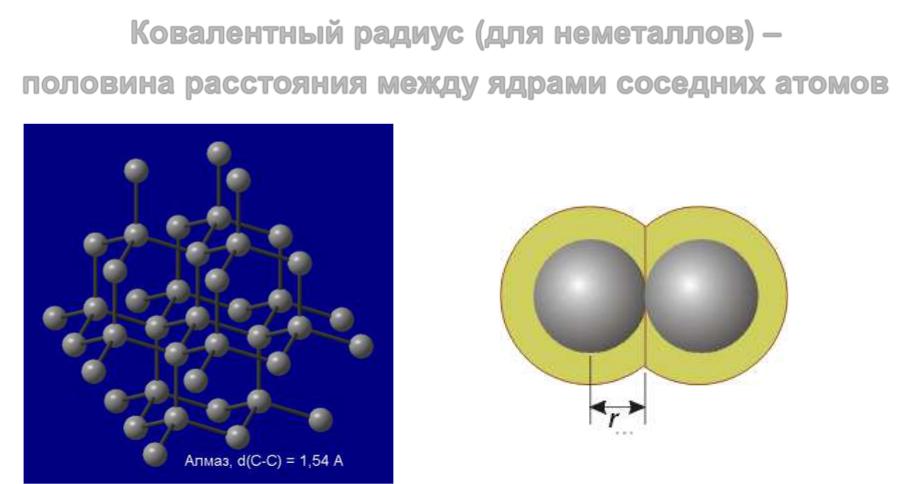
Ковалентный радиус
Ковалентный радиус (для неметаллов) – половина расстояния между ядрами соседних атомов
Металлический радиус и ковалентный радиус называют
атомными радиусами
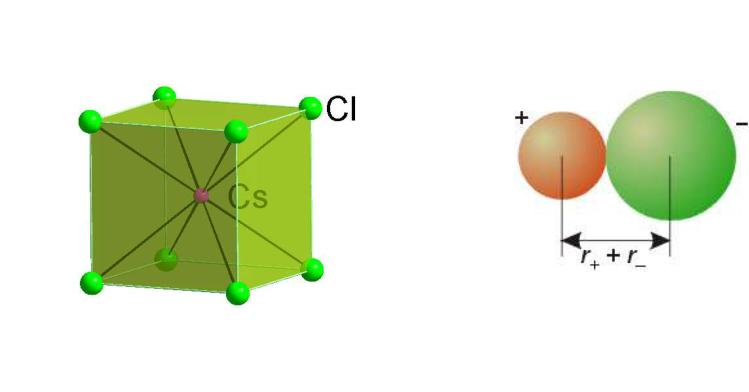
Ионный радиус
Ионный радиус (для ионных соединений) – пример CsCl: из данных РСА определяют карту электронной плотности и там где минимум электронной плотности на прямой Cs-Cl, проводят границу между Cs+ и Cl-

Закономерности изменения атомных радиусов
Атомный радиус уменьшается в периоде при увеличении атомного номера (Z): Li(1s22s1) → F(1s22s22p5) – валентные электроны занимают орбитали одной оболочки, но увеличивается заряд ядра.
Атомный радиус увеличивается в группе при увеличении атомного номера (Z): Li([He]2s1) → Cs([Xe]5s1) – валентные электроны занимают орбитали с большим главным квантовым числом.
Изменение атомных радиусов в группах меньше, чем в периодах. В группах изменение немонотонно (одна из причин – «лантанидное сжатие»)

Закономерности изменения ионных радиусов
|
|
|
|
|
|
O2- |
F- |
Li+ |
|
|
|
|
|
1.35(2) |
|
Be2+ |
B3+ |
|
|
N3- |
1.28(2) |
||
0.59(4) |
|
|
1.38(4) |
||||
0.27(4) |
0.12(4) |
|
|
1.71 |
1.31(4) |
||
0.76(6) |
|
|
1.40(6) |
||||
|
|
|
|
|
1.33(6) |
||
|
|
|
|
|
|
1.42(8) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Na+ |
Mg2+ |
Al3+ |
|
|
|
|
|
0.99(4) |
0.49(4) |
|
|
P3- |
S2- |
Cl- |
|
0.39(4) |
|
|
|||||
1.02(6) |
0.72(6) |
|
|
2.12 |
1.84(6) |
1.67(6) |
|
0.53(6) |
|
|
|||||
1.16(8) |
0.89(8) |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
K+ |
Ca2+ |
|
|
|
|
|
|
1.38(6) |
1.00(6) |
Ga3+ |
|
|
As3- |
Se2- |
Br- |
1.51(8) |
1.12(8) |
|
|
||||
0.62(6) |
|
|
2.22 |
1.98(6) |
1.96(6) |
||
1.59(10) |
1.28(10) |
|
|
||||
|
|
|
|
|
|
||
1.60(12) |
1.35(12) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Rb+ |
Sr2+ |
In3+ |
|
|
|
|
|
1.49(6) |
1.16(6) |
Sn2+ |
Sn4+ |
|
Te2- |
I- |
|
0.79(6) |
|
||||||
1.60(8) |
1.25(8) |
1.22(8) |
0.69(6) |
|
2.21(6) |
2.06(6) |
|
0.92(8) |
|
||||||
1.73(12) |
1.44(12) |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Cs+ |
Ba2+ |
|
|
|
|
|
|
1.67(6) |
1.49(6) |
Tl3+ |
|
|
|
|
|
1.74(8) |
1.56(8) |
0.88(6) |
|
|
|
|
|
1.88(12) |
1.75(12) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В таблице ионные радиусы приведены в Å, в скобках указано КЧ

Закономерности изменения ионных радиусов
Ионный радиус зависит от координационного окружения (КЧ) – чем больше КЧ, тем больше радиус.
В пределах периода размеры анионов больше размеров катионов (упрощенно: катионы – маленькие, анионы – большие).
Ионный радиус увеличивается в группе при увеличении атомного номера: Li+ ([He] → Cs+ ([Xe]).
Изоэлектронные катионы – Na+, Mg2+, Al3+ имеют одинаковую электронную конфигурацию [Ne], но отличаются зарядом, ионный радиус сильно уменьшается.
Изоэлектронные анионы – P3-, S2-, Cl- имеют одинаковую электронную конфигурацию [Ar], но отличаются зарядом, ионный радиус уменьшается

Закономерности изменения ионных радиусов
для переходных металлов
В периоде: Ti2+ (1,00 Å) → Ni2+ (0,83 Å) –
уменьшение радиуса катиона, но различия
небольшие.
Зависимость от заряда: Fe2+ (0,75 Å) → Fe3+
(0,69 Å). Больше положительный заряд,
меньше ионный радиус.
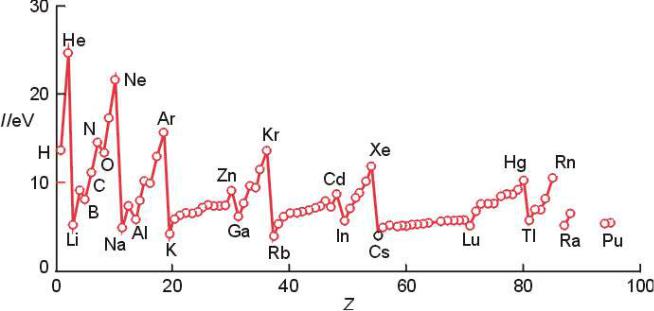
Энергия ионизации
Энергия ионизации атома (или иона) (I, эВ) – минимальная энергия для удаления электрона от атома (или иона), находящегося в газообразном состоянии:
А(г) → А+(г) + е(г); I = E(A+, г.) – E(A, г.)
Максимальное значение I имеют инертные газы,
минимальные – щелочные металлы.
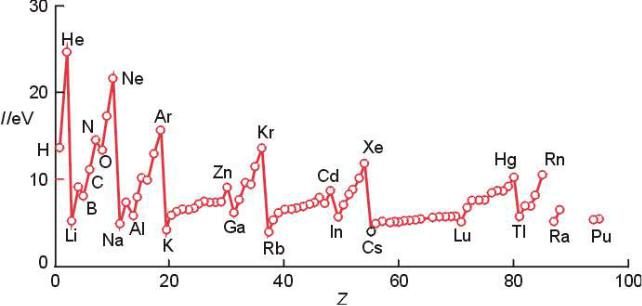
Энергия ионизации
Горизонтальная периодичность – в пределах одного периода значения I увеличиваются, т.к. увеличивается заряд ядра.
Вертикальная периодичность – в пределах одной группы значения I уменьшаются (не сильно): например, Li ([He]2s1) → Cs ([Xe]6s1)
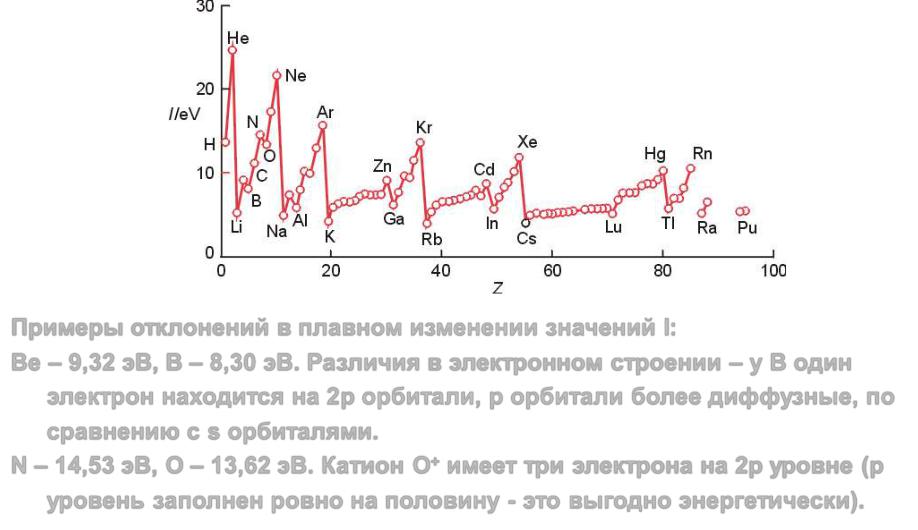
Энергия ионизации
Примеры отклонений в плавном изменении значений I:
Be – 9,32 эВ, В – 8,30 эВ. Различия в электронном строении – у В один электрон находится на 2p орбитали, р орбитали более диффузные, по сравнению с s орбиталями.
N – 14,53 эВ, O – 13,62 эВ. Катион O+ имеет три электрона на 2р уровне (p уровень заполнен ровно на половину - это выгодно энергетически).
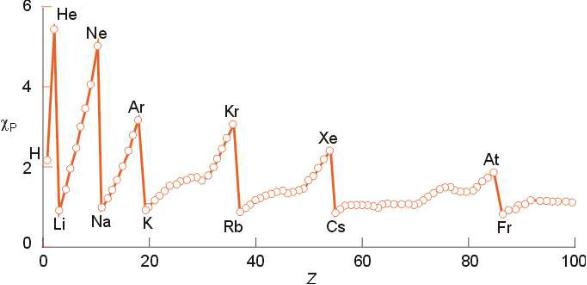
Электроотрицательность
Электроотрицательность ( ) – способность элемента притягивать электроны, когда элемент входит в состав химических соединений.
Определение электроотрицательности по Малликену:
М = ½(I+Ea)
Сродство к электрону (Ea, эВ) :
А(г) + е(г) → А-(г) Ea = E(A, г.) – E(A-, г.)

Электроотрицательность
Электроотрицательность увеличивается в периоде при увеличении атомного номера элемента.
Электроотрицательность уменьшается в группе при увеличении атомного номера элемента.

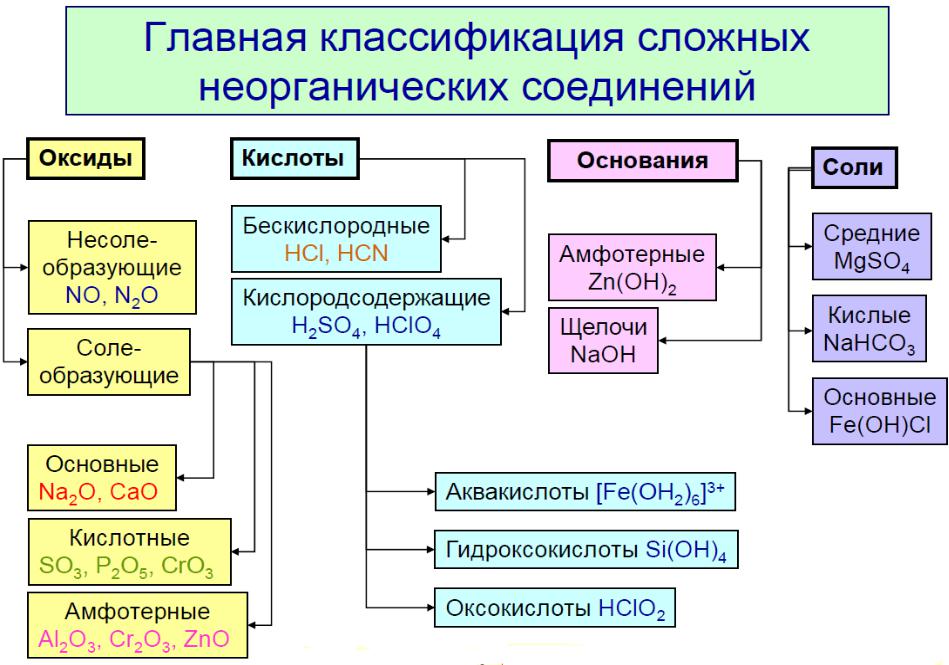
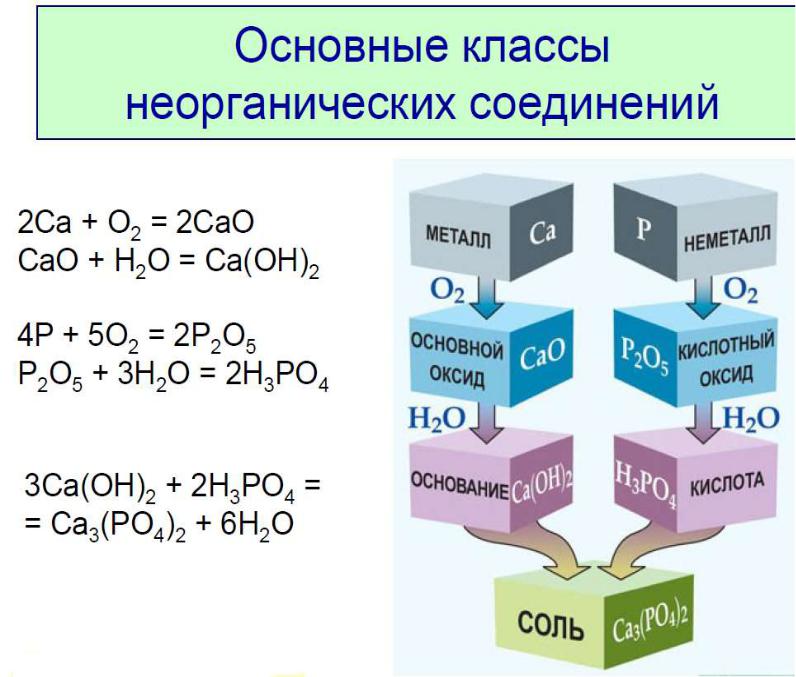
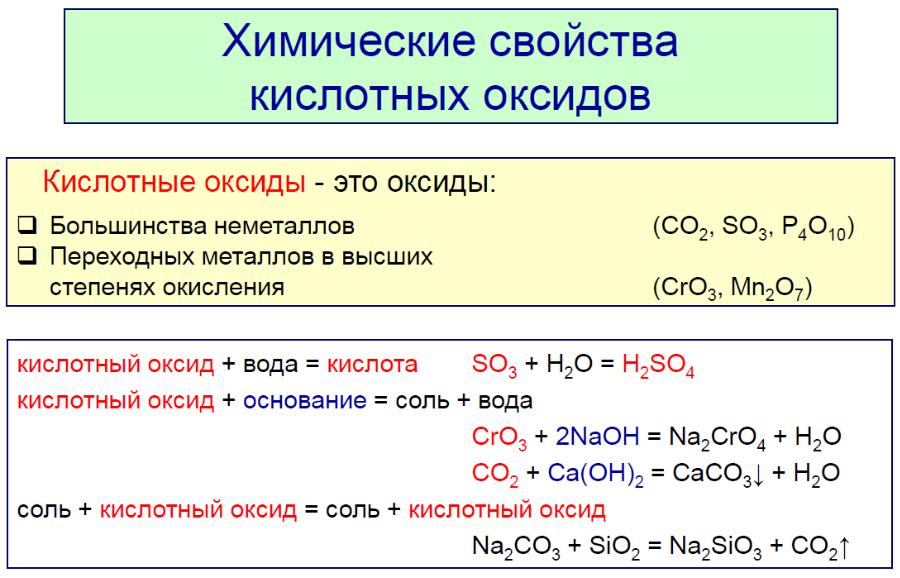
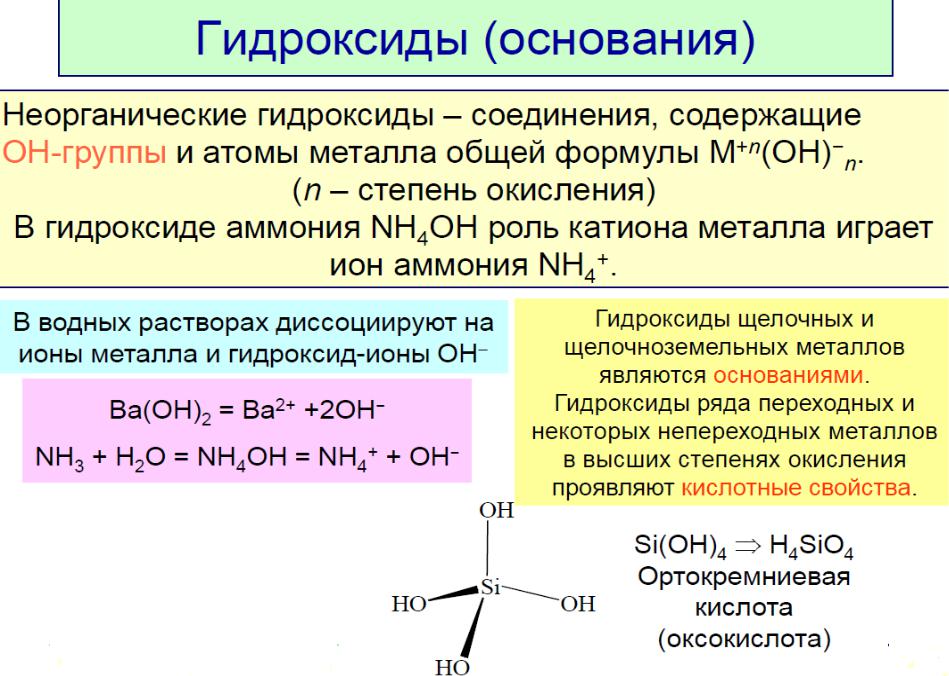
Закономерности изменения кислотноосновных свойств гидроксидов элементов
Основные свойства: ЭОН → Э+ + ОН-
Кислотные свойства: ЭОН → ЭО- + Н+
Гидроксид |
Ионный радиус Э2+ |
Свойства |
|
|
|
Be(OH)2 |
0,27 Å |
Амфотерный |
Mg(OH)2 |
0,49 Å |
Основание средней |
|
|
силы |
|
|
|
Ca(OH)2 |
1,00 Å |
Сильное основание |
|
|
|
Sr(OH)2 |
1,16 Å |
Сильное основание |
|
|
|
Ba(OH)2 |
1,49 Å |
Сильное основание |
Изменение по группе:
увеличение ионного радиуса приводит к ослаблению связи с ОН-
Закономерности изменения кислотноосновных свойств гидроксидов элементов
Гидроксид |
Ионный радиус Эn+ |
Свойства |
NaOH |
0,99 Å |
Сильное основание |
|
|
|
Mg(OH)2 |
0,49 Å |
Основание средней |
|
|
силы |
|
|
|
Al(OH)3 |
0,39 Å |
Амфотерный |
"Si(OH)4" |
|
Слабая кислота |
Уменьшение основных свойств коррелирует с увеличением заряда катиона и уменьшением радиуса катиона
Кислотные свойства бескислородных кислот НЭ
Соединение |
Кислотные св- |
Радиус аниона |
Заряд аниона |
||
|
ва (К |
1 |
в воде) |
Эn-, Å |
|
|
|
|
|
|
|
NH3 |
Основание |
1,71 |
-3 |
||
|
|
|
|
|
|
H O |
10 -16 |
|
|
1,38 |
-2 |
2 |
|
|
|
|
|
HF |
10 -3 |
|
|
1,31 |
-1 |
|
|
|
|
|
|
H O |
10 -16 |
|
|
1,38 |
-2 |
2 |
|
|
|
|
|
H S |
10 -7 |
|
|
1,84 |
-2 |
2 |
|
|
|
|
|
H Se |
10 -4 |
|
|
1,98 |
-2 |
2 |
|
|
|
|
|
H Te |
10 -3 |
|
|
2,21 |
-2 |
2 |
|
|
|
|
|
Два фактора (изменение радиуса аниона и изменение заряда аниона) действуют в противоположных направлениях.
Главным является изменение заряда аниона.

Эмпирическая корреляция между строением и силой кислоты (правила Полинга)
Можно предсказать относительную силу кислот:
для кислородсодержащих кислот:
сила кислоты Э(ОН)nОm тем выше, чем больше m
•рКа ~ 8 5m;
•для многоосновных кислот: при отщеплении каждого последующего Н+ рКа увеличивается на ~5.
HClO Cl(OH) (m=0) – очень слабая кислота (рКа ~ 10 8); HClO2 Cl(OH)О (m=1) – кислота средней силы (рКа ~ 10 2); HClO3 Cl(OH)О2 (m=2) – сильная кислота;
HClO4 Cl(OH)О3 (m=3) – очень сильная кислота.
Н РО : |
рК |
а1 |
~ 10 2; |
рК |
а2 |
~ 10 6; |
рК |
а3 |
~ 10 12. |
3 4 |
|
|
|
|
|
|

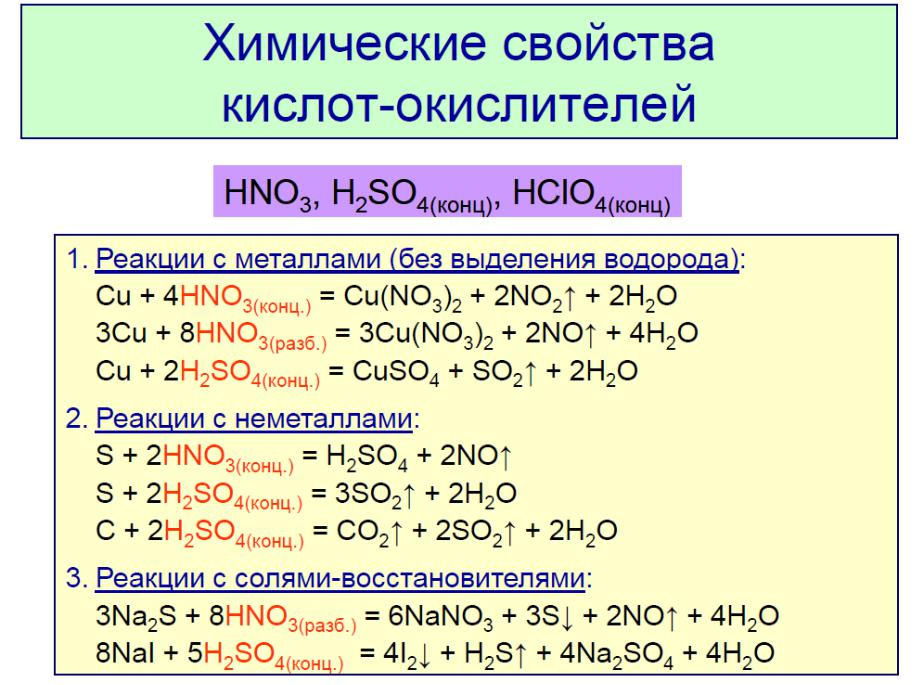
Некоторые закономерности изменения окислительно-восстановительных свойств
• Э + 2е + 2Н+ → Н Э (Э – халькоген) |
||||
|
|
2 |
|
|
|
|
|
|
|
|
Элемент |
|
Ео, В |
|
|
|
|
|
|
|
O |
|
1,23 |
|
|
|
|
|
|
|
S |
|
0,14 |
|
|
|
|
|
|
|
Se |
|
-0,40 |
|
|
|
|
|
|
|
Te |
|
-0,72 |
|
|
|
|
|
|
Окислительные свойства уменьшаются в ряду O2, S, Se, Te
Восстановительные свойства увеличиваются в ряду H2O, H2S, H2Se, H2Te
Аналогичные закономерности для галогенов.
Э2 + 2е + 2Н+ → 2НЭ (Э – галоген)
Окислительно-восстановительные свойства соединений элементов
ввысших степенях окисления
•Главные элементы – s и p:
14 группа: CO2, SiO2, GeO2 – практически не являются окислителями; PbO2 – сильный окислитель.
•Переходные металлы:
5 группа: V(V) – окислитель,
Nb(V) и Ta(V) – не являются окислителями. 6 группа: Cr(VI) - окислитель,
Mo(VI) и W(VI) – не являются окислителями. 7 группа: Mn(VII) - окислитель,
Tc(VII) и Re(VII) – не являются окислителями.
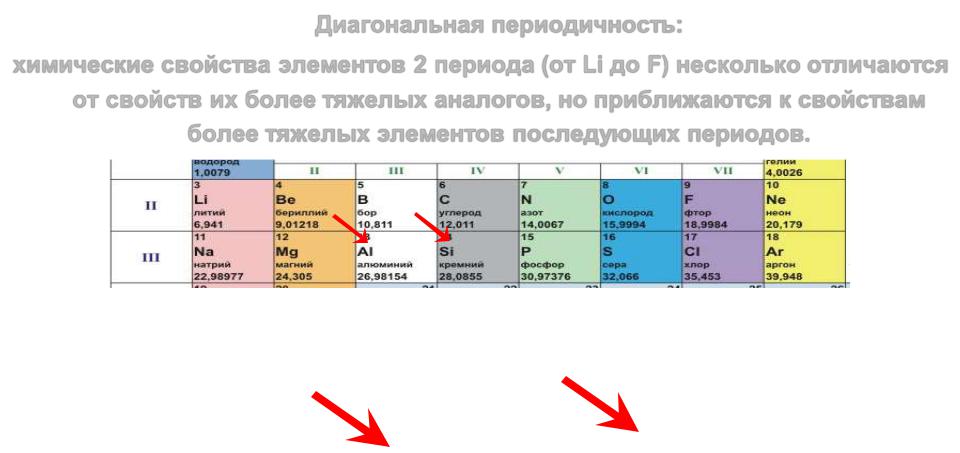
Диагональная периодичность
Диагональная периодичность:
химические свойства элементов 2 периода (от Li до F) несколько отличаются от свойств их более тяжелых аналогов, но приближаются к свойствам
более тяжелых элементов последующих периодов.
Be(OH)2 – |
B(OH)3 – слабая |
|
амфотерный |
кислота |
|
|
|
|
Mg(OH)2- – слабое |
Al(OH)3 – |
"Si(OH)4" - слабая |
основание |
амфотерный |
кислота |
|
|
|




















Комплексные
соединения

УМК «ХИМИЯ»
Тема лекции: Комплексные
соединения
Лектор – Иванов М.Г.

Цель лекции:
изложение основных понятий химии
координационных соединений в рамках современной химической теории
Компетенции, формируемые у студента:
Умения:
прогнозировать на основе положения элементов в Периодической системе, а также современных представлений о строении атомов и химической связи, свойства, строение и поведение в растворах комплексных соединений p-, d –элементов.

СОДЕРЖАНИЕ
Основные понятия Классификация Номенклатура Изомерия
Геометрическая
Оптическая Связевые изомеры
Гидратные и ионизационные изомеры Конформационные изомеры
Лиганды Хелатные комплексы
Макроциклические Сэндвичевые комплексы Многоядерные комплексы
Строение комплексов Метод ВС
Теория кристаллического поля Расщепление d-орбиталей Сильное и слабое поле
Устойчивость комплексов Литература

Основные понятия |
содержание |
|
Комплексными (координационными) называют соединения стехиометрически достоверные, устойчивые в растворе и твердом состоянии , состоящие их центрального атома и координированных вокруг него лигандов.
Основные понятия:
Центральный атом
Лиганды
Координационное число
Внутрення и внешняя сфеда
Дентатаность

Классификация |
содержание |
|
А. Вернер (1866-1919)
Согласно теории Вернера – Миолати существует три типа классических комплексов:
Координационные ацидосоединения, во внутренней сфере которых содержатся только кислотные остатки;
Молекулярные координационные соединения, во внутренней сфере которых содержатся только лиганды в молекулярной форме;
Смешанные ацидо-молекулярные координационные соединения.

Номенклатура |
|
содержание |
|
|
|
Традиционные названия:
[Pt(NH3)4][PtCl4] – соль Магнуса
K3[Fe(CN)6] – красная кровяная соль
цис-[Pt(NH3)2Cl2] – соль Пейроне
Формула по ЮПАК:
квадратные скобки –центральный атом –анионные лиганды по алфавиту –нейтральные лиганды по алфавиту
Na[Ag(CN)2] – дицианоаргентат(I) натрия K2[PtCl6] – тетрахлороплатинат(IV) калия K3[GaF6] – гексафторогаллат(III) калия [Cu(NH3)4]SO4 – сульфат тетрааминмеди(II)

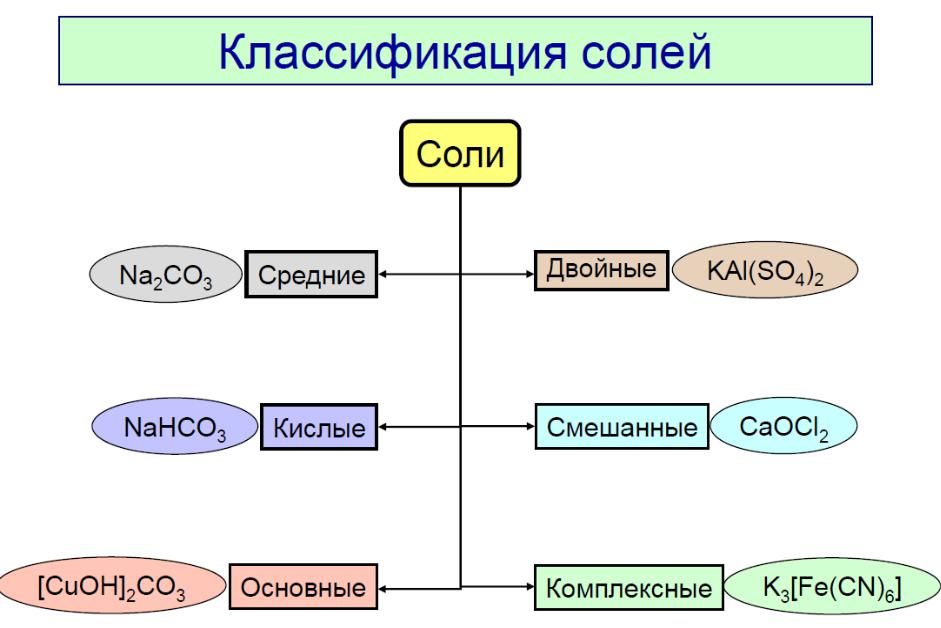
Изомерия |
содержание |
|
Пространственная: геометрическая
иоптическая
Ионизационная
Гидратная
Связевая
Спиновая
Конформационная
Изомерия |
содержание |
|
Геометрические изомеры
|
H N |
|
N |
|
|
|
|
|
2 |
|
äèî êñàí |
Cl |
|
Cl |
|
|
|
|
|
|
|||
Cl |
|
|
|
|
|
|
|
O |
Cu |
O |
O |
O |
|
||
|
|
|
|
|
|||
|
|
|
Cl |
|
|
||
|
|
|
|
|
Cu |
|
|
|
|
|
|
N |
|
N |
|
N |
NH |
|
|
|
|
||
2 |
|
|
|
H N |
|
||
|
|
|
NH |
|
|
||
|
|
|
|
|
|
||
|
|
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
Транс-изомер |
Цис-изомер |
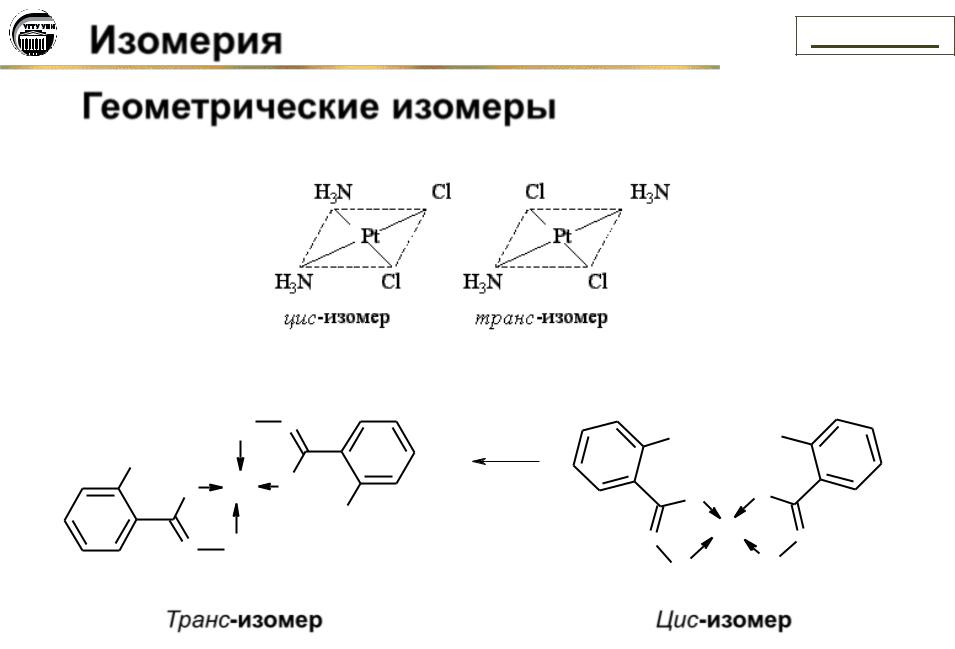
Изомерия |
содержание |
|
Оптические изомеры:
M: Cr(III), Co(III), Rh(III) или Ir(III)
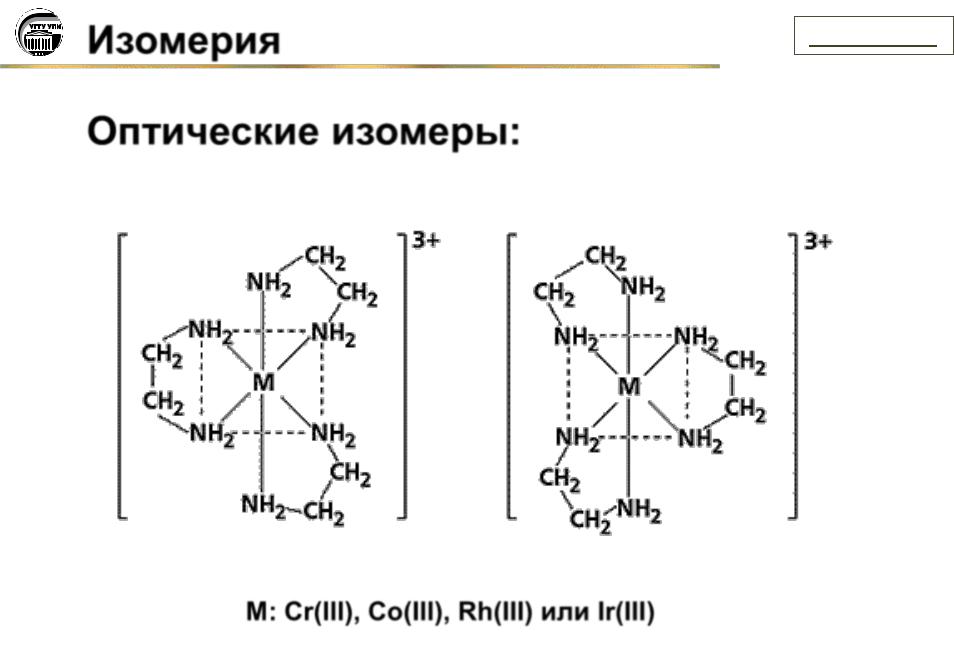
Изомерия |
содержание |
|
Связевые изомеры:
[(CO)5Mn—SCN] и [(CO)5Mn—NCS]
[CoNO2(NH3)5]Cl2 и Co(ONO)(NH3)5]Cl2

Изомерия |
содержание |
|
Гидратные и ионизационные изомеры
[CoBr(NH3)5]SO4 - фиолетовый
[CoSO4(NH3)5]Br - красно-фиолетовый
[CoCl(H2O)5]Cl2·H2O
[CoCl2(H2O)4]Cl·2H2O
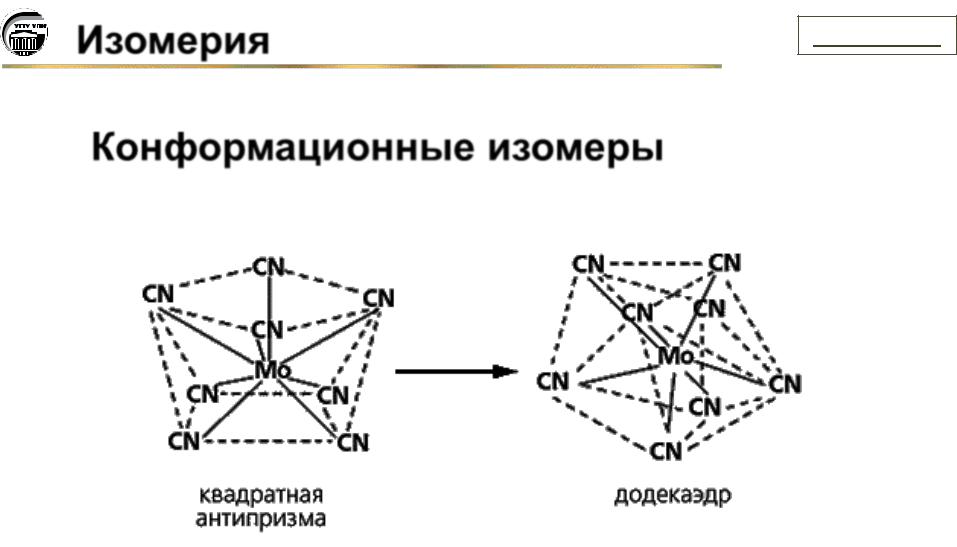
Изомерия |
содержание |
|
Конформационные изомеры

Лиганды |
содержание |
|
Типы:
нейтральные: H2O, NH3, CO, Н2N-CH2-CH2-NH2
анионы: Cl-, OH-, CN-, F-, оксалат-ион- С2O42-
Дентатность:
Монодентатные: H2O, NH3, CO, Cl-, OH-, CN-, F-
Полидентатные: Н2N-CH2-CH2-NH2, С2O42-
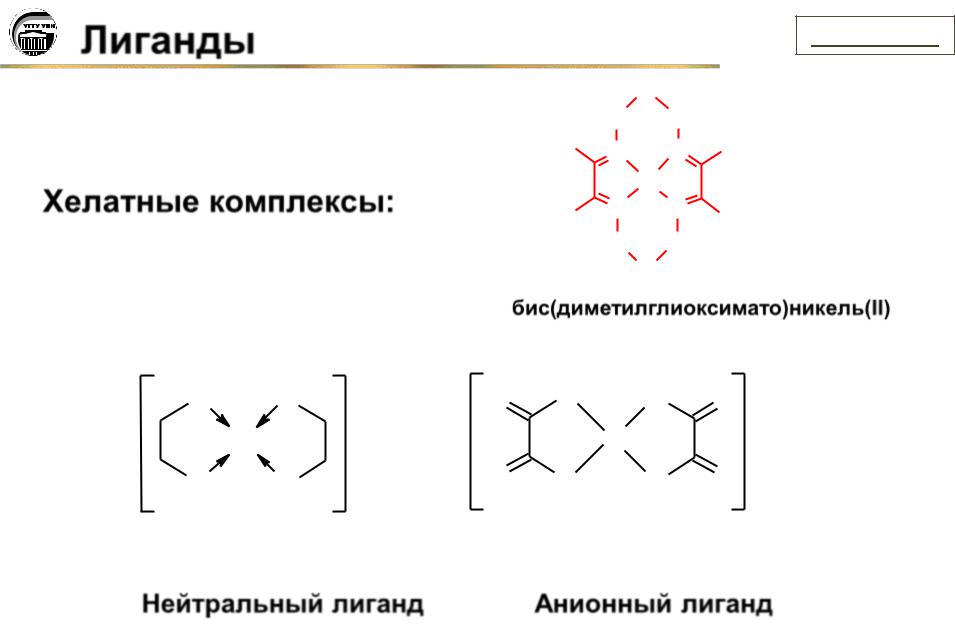
Лиганды
Хелатные комплексы:
H |
H |
|
|
2 |
2 |
2+ |
|
N |
N |
||
|
|||
|
Cu |
|
|
N |
N |
|
|
H |
H |
|
|
2 |
2 |
|
|
|
a |
|
Нейтральный лиганд
содержание
|
|
H |
|
|
|
O |
O |
|
|
H C |
N |
N |
CH3 |
|
3 |
||||
|
|
Ni |
|
|
H C |
N |
N |
CH |
|
|
|
3 |
||
3 |
O |
O |
|
|
|
|
|
||
|
|
H |
|
|
бис(диметилглиоксимато)никель(II)
O |
O |
O |
O |
2- |
|
|
Cu |
|
|
O |
O |
O |
O |
|
á
Анионный лиганд
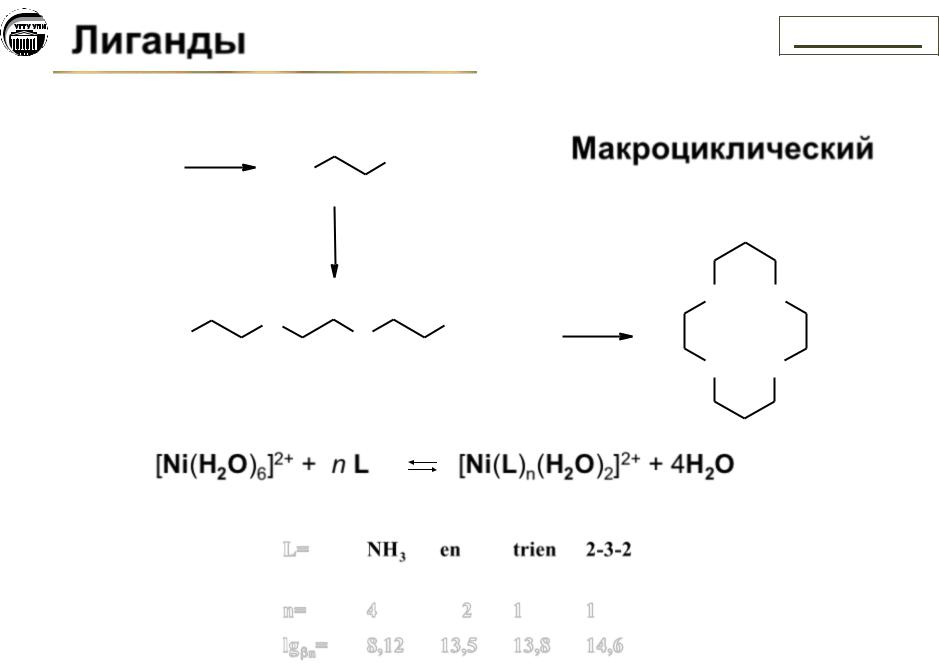
Лиганды |
содержание |
|
NH |
H N |
NH |
2 |
(en) |
|
||||
3 |
|
|
|
|
|
2 |
|
|
|
H |
|
NH |
|
N |
N |
2 |
|
H N |
|
||
|
|
||
2 |
H |
|
|
|
|
|
|
(trien) |
|
|
|
Макроциклический
2-3-2
NH |
HN |
NH |
HN |
[Ni(H O) ]2+ + n L |
[Ni(L) (H O) ]2+ |
+ 4H O |
|||||
2 6 |
|
|
|
n 2 |
2 |
2 |
|
|
|
|
|
|
|
|
|
|
L= |
NH3 |
en |
trien |
2-3-2 |
|
|
|
|
|
|
|
|
|
|
|
n= |
4 |
2 |
1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
lg n= |
8,12 |
13,5 |
13,8 |
14,6 |
|
|
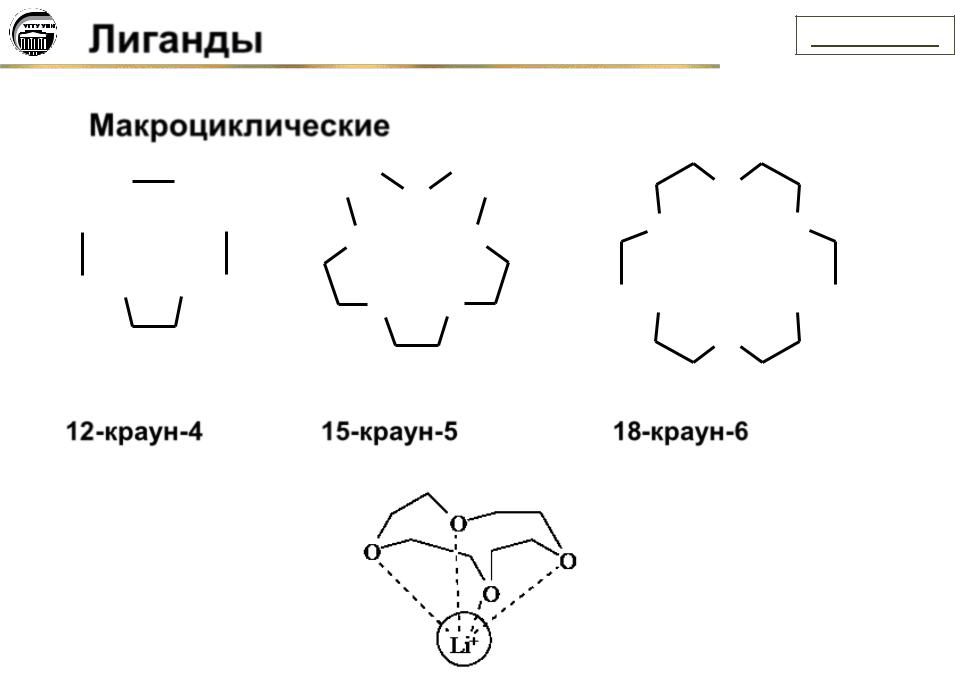
Лиганды
Макроциклические


 O
O 
 O O
O O O O
O O
 O O
O O
O O
12-краун-4 15-краун-5
содержание
O
O O
 O O
O O
O
18-краун-6
Лиганды |
|
содержание |
|
|
|
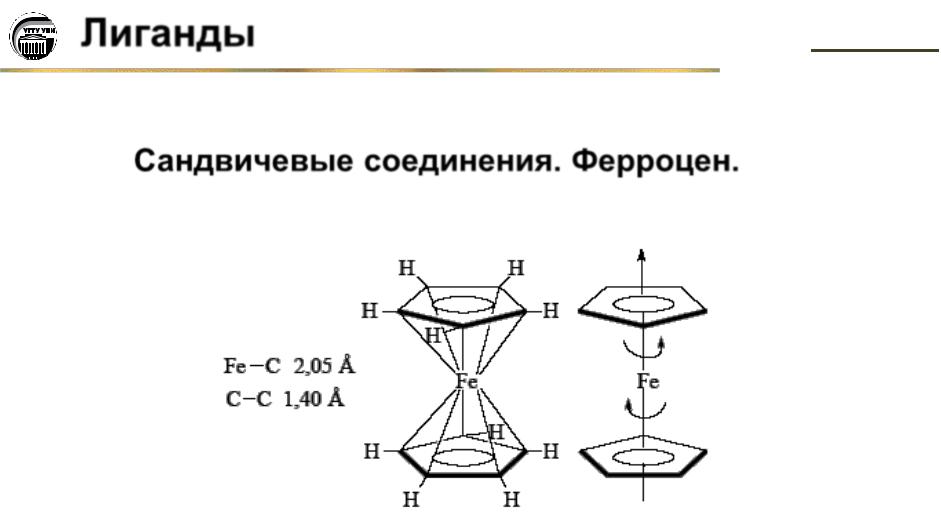
Сандвичевые соединения. Ферроцен.
Лиганды |
|
содержание |
|
|
|
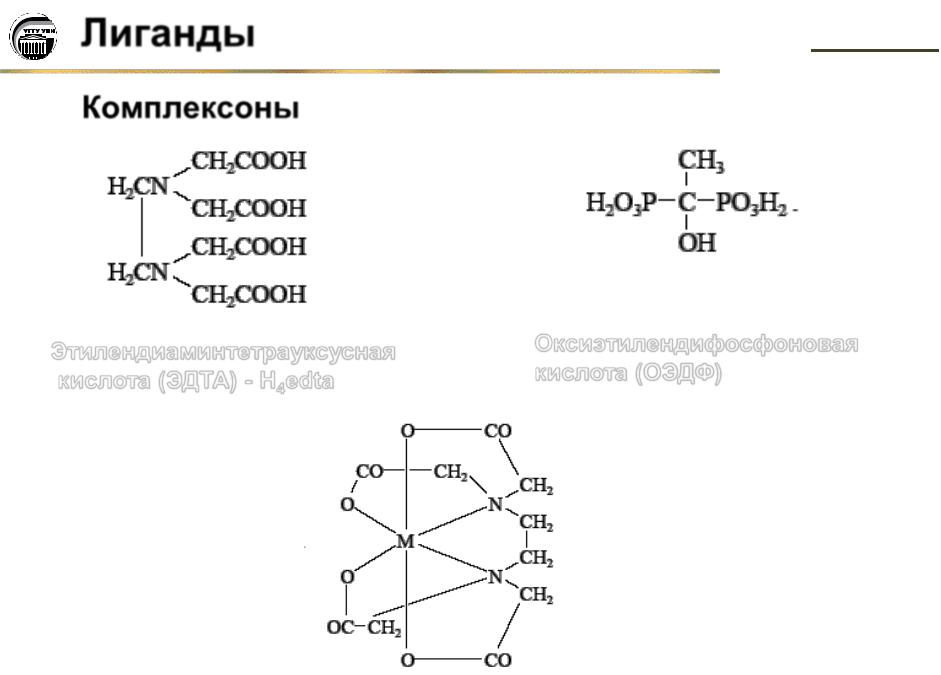
Комплексоны
Этилендиаминтетрауксусная |
Оксиэтилендифосфоновая |
|
кислота (ОЭДФ) |
||
кислота (ЭДТА) - H4edta |
||
|
Многоядерные комплексы |
|
содержание |
|
|
|
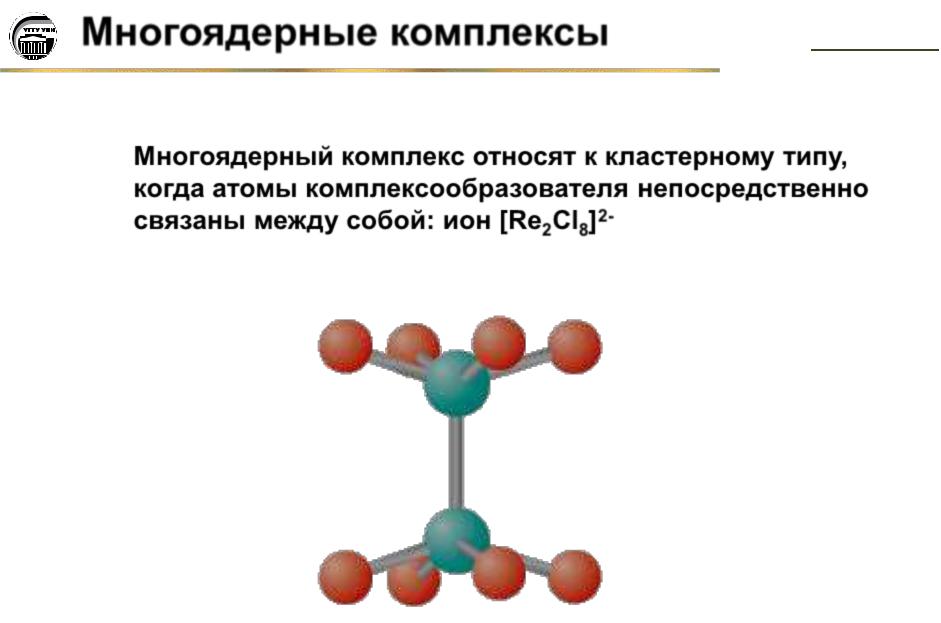
Многоядерный комплекс относят к кластерному типу, когда атомы комплексообразователя непосредственно связаны между собой: ион [Re2Cl8]2-
Многоядерные комплексы |
|
содержание |
|
|
|
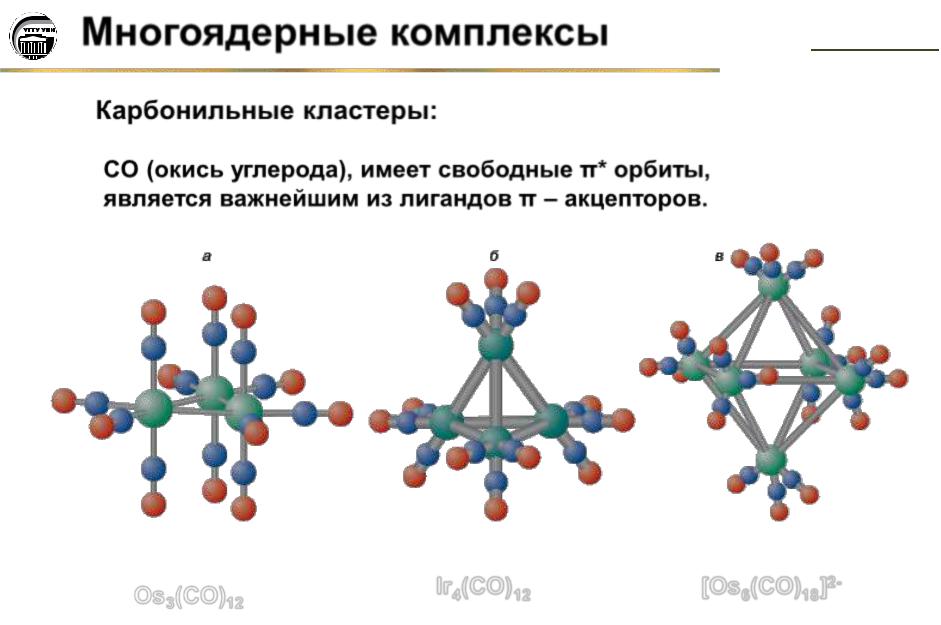
Карбонильные кластеры:
CO (окись углерода), имеет свободные π* орбиты, является важнейшим из лигандов π – акцепторов.
Os3(CO)12 |
Ir (CO) |
|
[Os (CO) |
|
]2- |
4 |
12 |
6 |
18 |
|
|
|
|
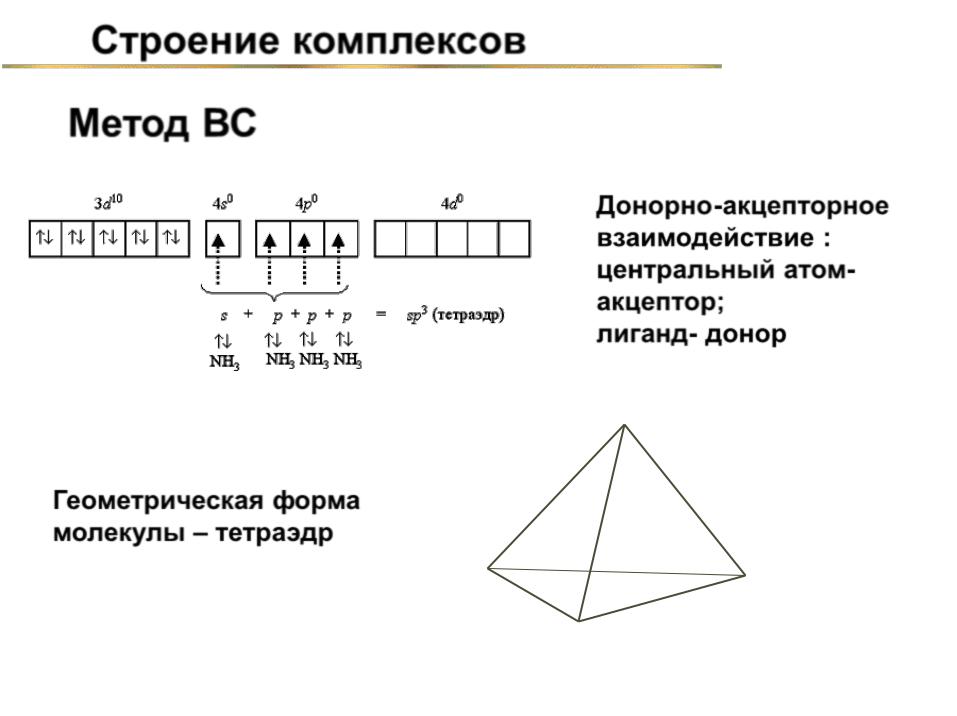
Строение комплексов
Метод ВС
Геометрическая форма молекулы – тетраэдр
NH3
содержание
Донорно-акцепторное взаимодействие : центральный атомакцептор; лиганддонор
NH3
Zn
NH3
NH3

Строение комплексов |
содержание |
|
Недостатки метода ВС
Не объясняет магнитные свойства комплексов
Не объясняет окраску комплексов
Не учитывает π-связывание
Не объясняет различную устойчивость комплексов
Строение комплексов |
|
содержание |
|
|
|
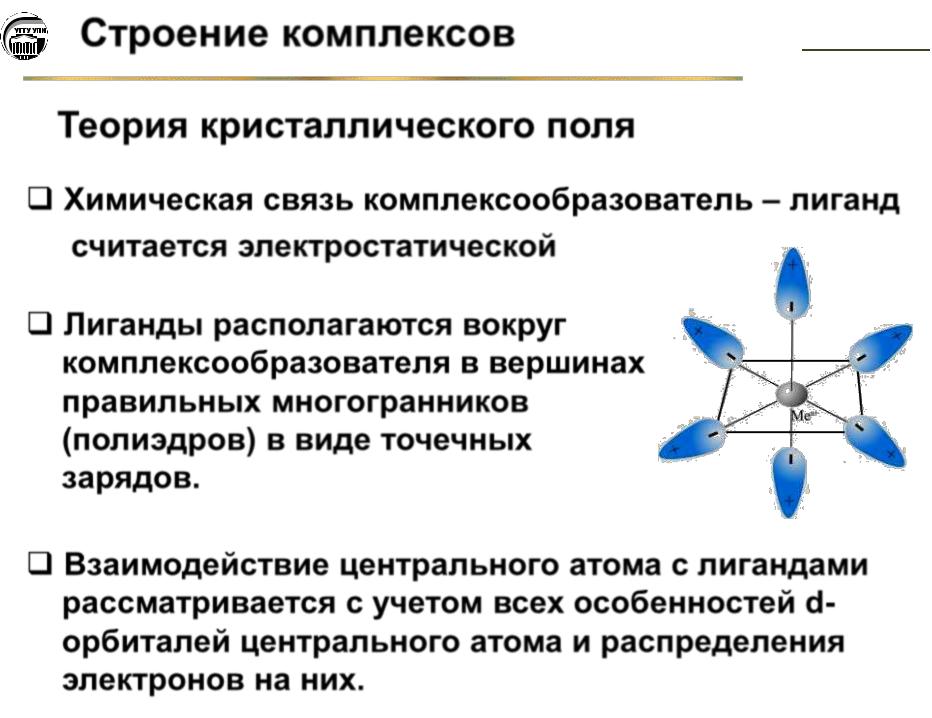
Теория кристаллического поля
Химическая связь комплексообразователь – лиганд считается электростатической
Лиганды располагаются вокруг комплексообразователя в вершинах правильных многогранников (полиэдров) в виде точечных зарядов.
Взаимодействие центрального атома с лигандами рассматривается с учетом всех особенностей d- орбиталей центрального атома и распределения электронов на них.
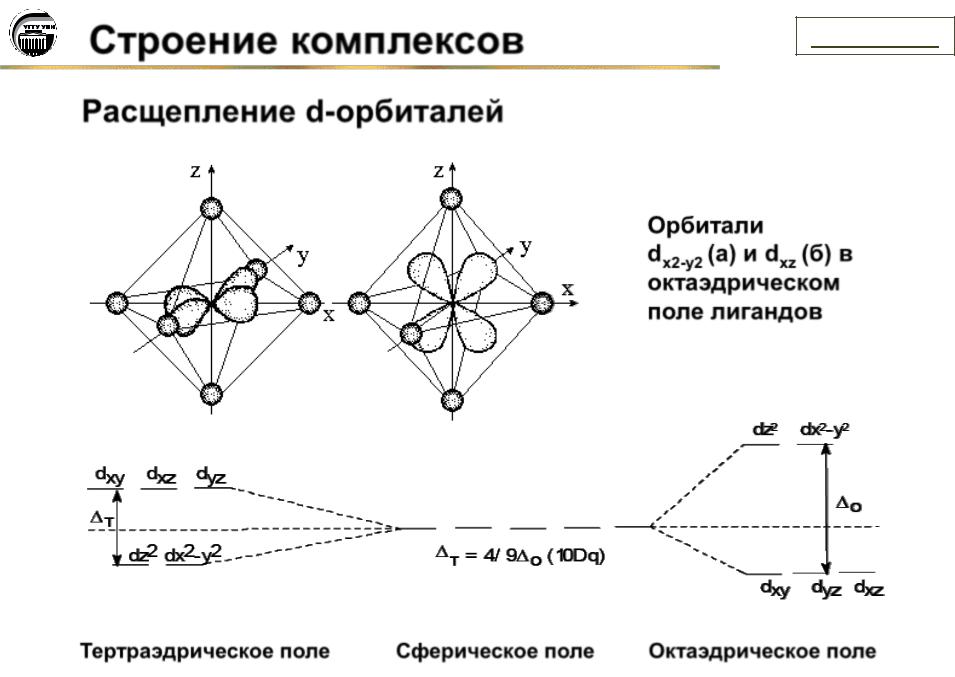
Строение комплексов
Расщепление d-орбиталей
содержание
Орбитали
dх2-у2 (а) и dxz (б) в
октаэдрическом поле лигандов
(а) |
(б) |
Тертраэдрическое поле |
Сферическое поле |
Октаэдрическое поле |
Строение комплексов |
|
содержание |
|
|
|
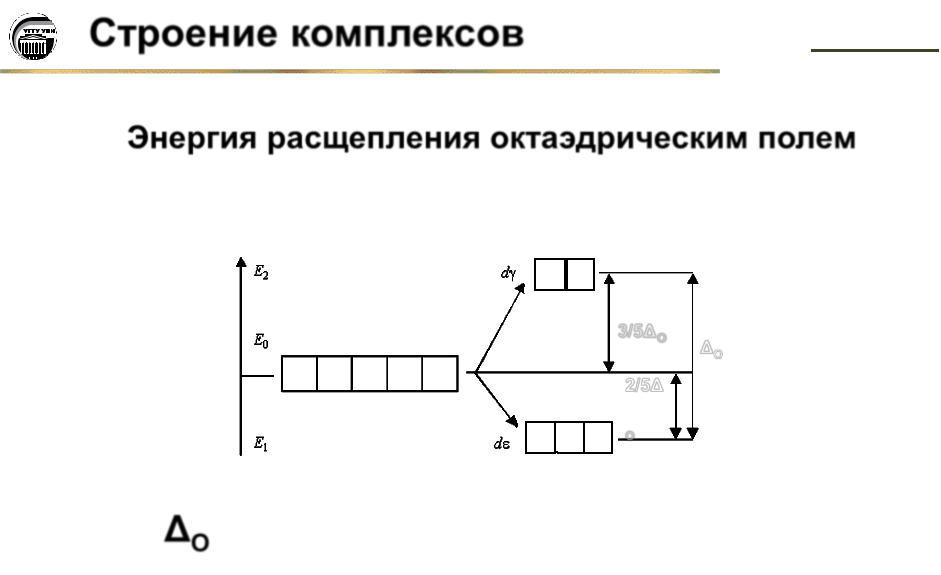
Энергия расщепления октаэдрическим полем
3/5ΔO
O
2/5Δ
O
O – энергия расщепления октаэдрическим полем
Строение комплексов |
содержание |
|
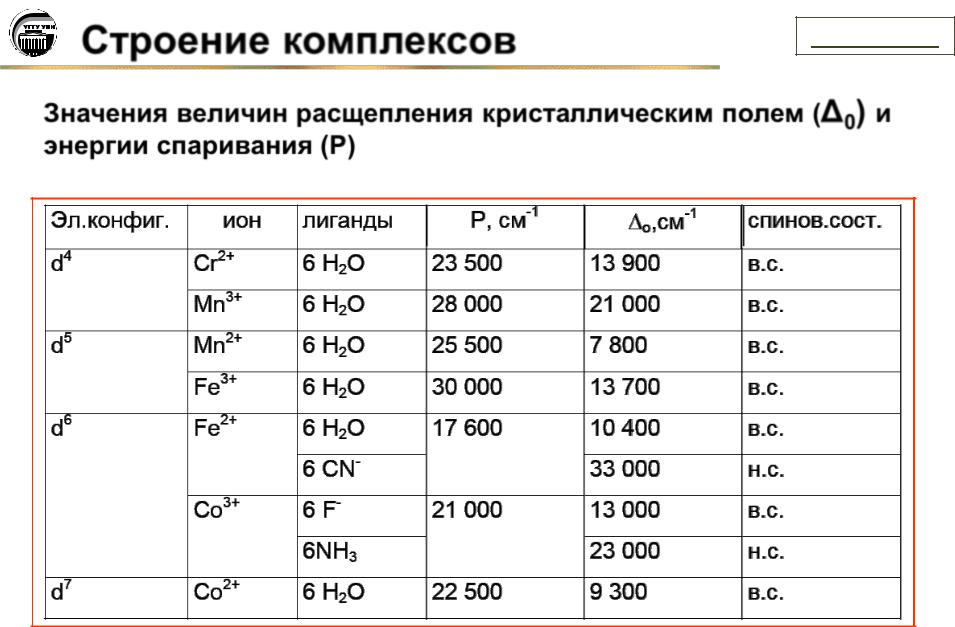
Значения величин расщепления кристаллическим полем ( 0) и энергии спаривания (P)
Строение комплексов |
содержание |
|
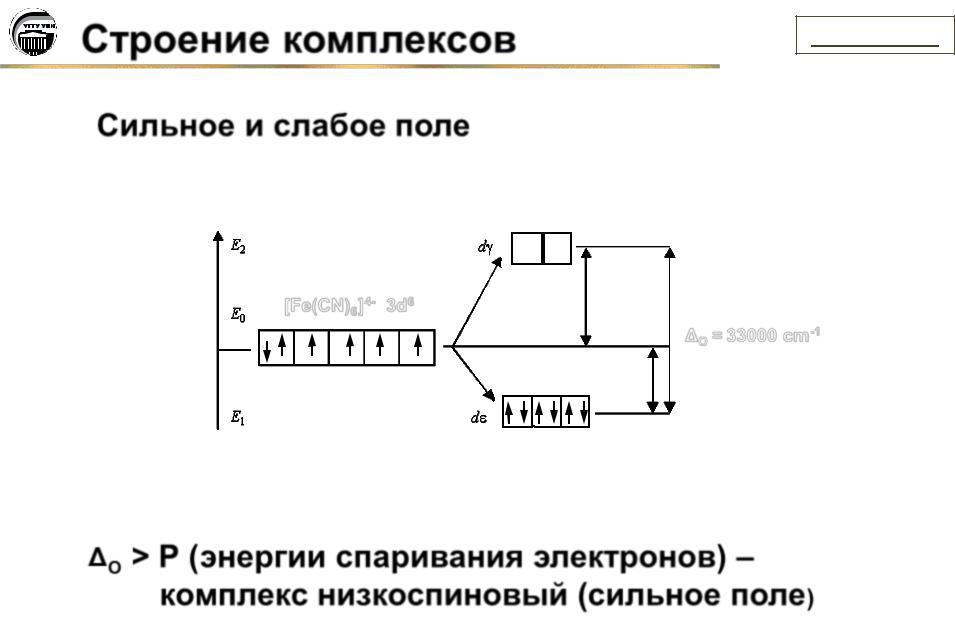
Сильное и слабое поле
[Fe(CN)6]4- 3d6
O = 33000 cm-1
O > P (энергии спаривания электронов) – комплекс низкоспиновый (сильное поле)
Строение комплексов |
содержание |
|
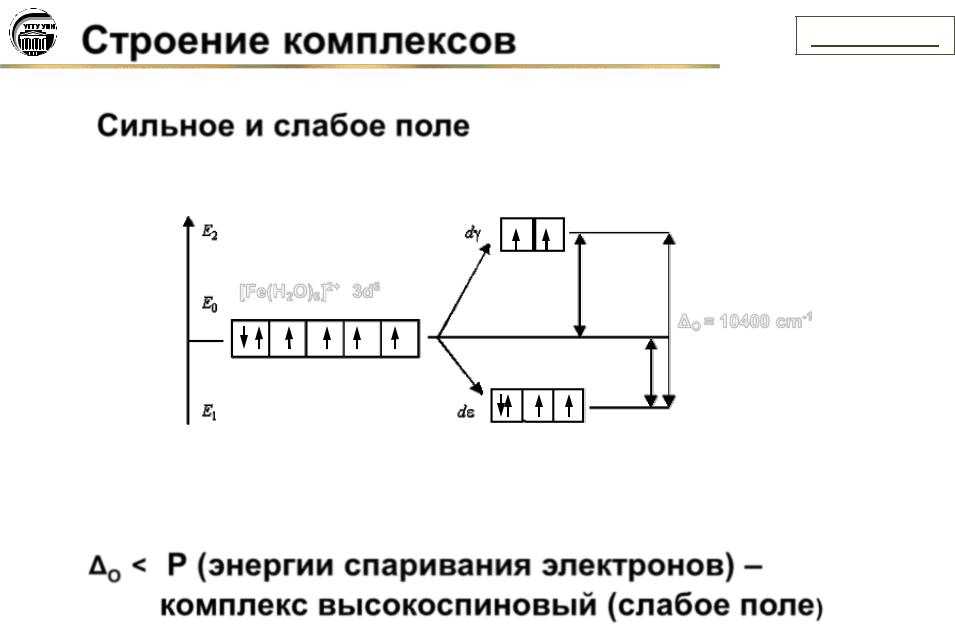
Сильное и слабое поле
[Fe(H2O)6]2+ 3d6
O = 10400 cm-1
O < P (энергии спаривания электронов) –
комплекс высокоспиновый (слабое поле)

Магнитные свойства |
содержание |
|
μэфф = 2 [S(S+1)]1/2 = [n(n+2)]1/2 (магнетон Бора)
S –суммарный спин
n–число неспаренных электронов
содержание
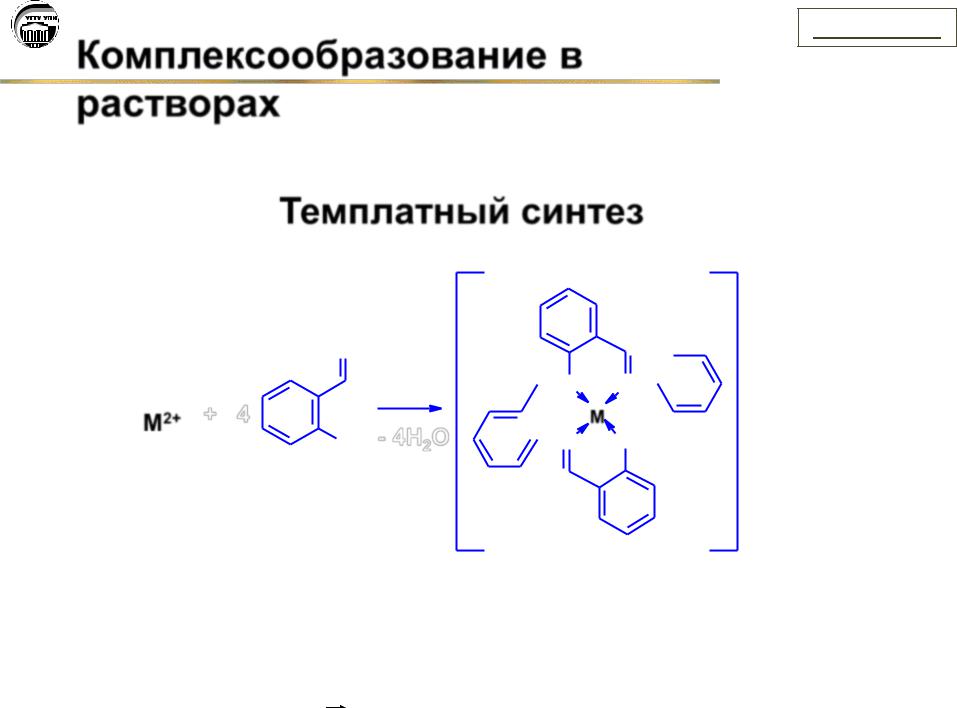
Комплексообразование в
растворах
Темплатный синтез
O
M2+ + 4
NH |
2 |
|
- 4H2O
 N
N  N
N
M
2+
N 

N 

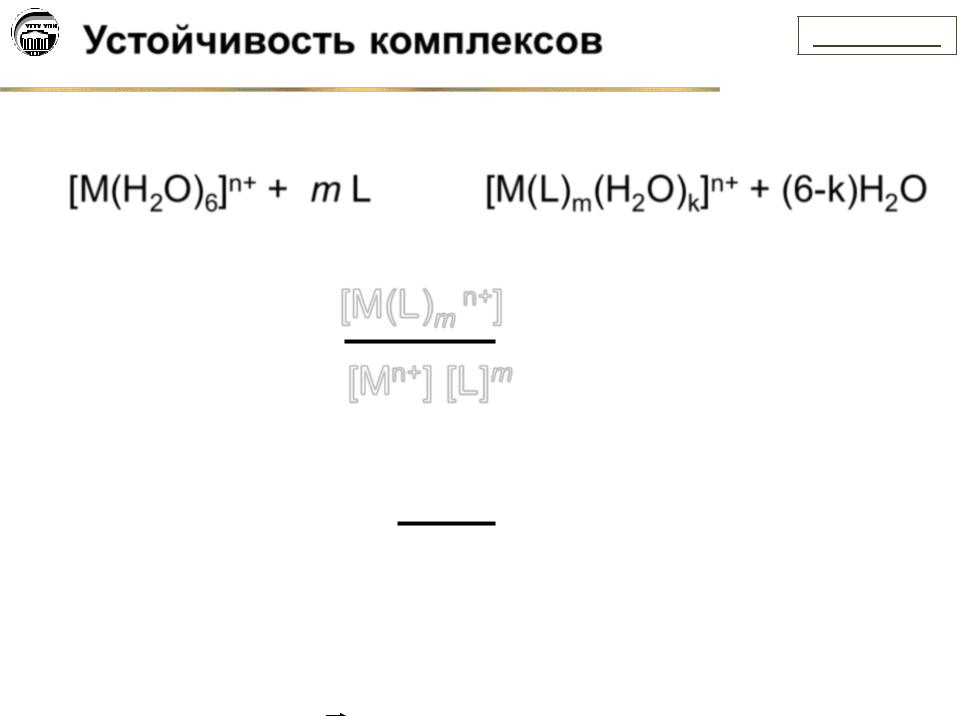
Устойчивость комплексов |
содержание |
|
[М(H2O)6]n+ + m L  [M(L)m(H2O)k]n+ + (6-k)H2O
[M(L)m(H2O)k]n+ + (6-k)H2O
[M(L)m n+]
Куст =
[Mn+] [L]m
1
Кнест =
Куст

Устойчивость комплексов |
содержание |
|
[М]n+ + L |
[ML]n+ ; [МL] n+ + L |
[ML2]n+ |
|
[MLn+] |
|
К1 = |
|
= К1К2…Km |
|
||
|
||
|
[Mn+] [L] |
|
|
|
[ML2n+] |
|
К2 = |
|
|
G0 = –RT ln(β) |
|
|
||
|
|
||
|
[MLn+] [L] |
||
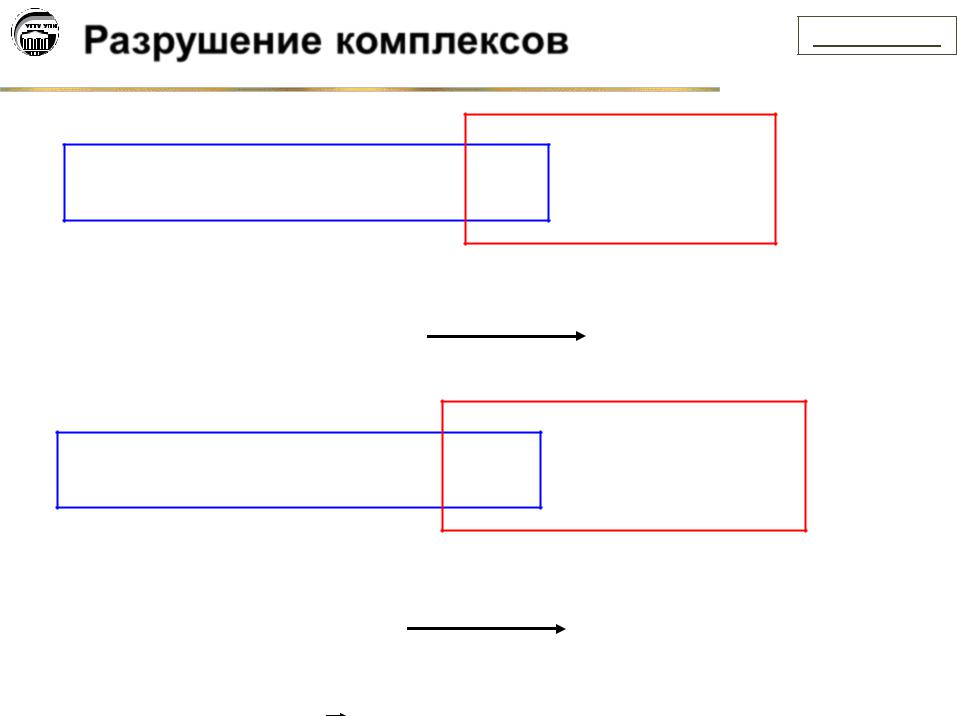
Разрушение комплексов |
содержание |
|
[Cu(NH3)4]2+  4NH3 + Cu2++ S2–
4NH3 + Cu2++ S2–  CuS↓ + 4NH3
CuS↓ + 4NH3
β [Cu(NH ) |
]2+ = 2∙10-13 |
ПР = 6∙10–36 |
3 4 |
|
CuS |
При добавлении S2-
[Сu(NH3)4]2+ Cu2+ + 4NH3 + 4H+
Cu2+ + 4NH3 + 4H+  4NH4+ + Cu2+
4NH4+ + Cu2+
β [Cu(NH ) |
]2+ = 2∙10-13 |
β [NH ]+ = 6∙10-10 |
|
3 |
4 |
|
4 |
При избытке Н+

Устойчивость комплексов |
содержание |
|
Константы нестойкости некоторых комплексов
Комплексный |
Kнест |
Комплексный |
Kнест |
||||
ион |
|
ион |
|
||||
|
|
|
|
||||
|
|
|
|
|
|
||
[Co(NH |
) ]2+ |
7,75 • 10–6 |
[Zn(OH) |
]2– |
3,6 • 10–16 |
||
3 |
|
|
6 |
|
4 |
|
|
|
|
|
|
|
|||
[Ag(NH |
) ]+ |
1,07 • 10–7 |
[Fe(CN) ]3– |
1,0 • 10–31 |
|||
3 |
|
|
2 |
|
6 |
|
|
|
|
|
|
|
|||
[Cu(NH |
) ]2+ |
2,14 • 10–13 |
[Fe(CN) ]4– |
1,0 • 10–36 |
|||
3 |
|
4 |
|
6 |
|
|
|
|
|
|
|
|
|
|
|

Инертность и стабильность |
содержание |
|
Кинетическая стабильность комплекса характеризуется терминами:
лабильный: время жизни комплекса в 0.1М растворе > 1с
инертный время жизни комплекса в 0.1М растворе < 1с
константа скорости изотопного обмена молекул воды во внутренней координационной сфере для
инертного комплекса [Ni(H2O)6]2+ равна 3,3.104 с-1, а для лабильного [Сr(Н2О)6]3+ – 5.10-7 с-1.

Выводы и заключения |
содержание |
|
|
|
Химия комплексных соединений важнейшей является частью неорганической химии.
Знание о природе взаимодействия атомов металла и лигандов в комплексе, позволяет представить механизм образования, строение и реакционную способность комплексных соединений.

Список литературы |
содержание |
|
Кукушкин Ю.Н. Химия координационных соединений. М.: Высшая школа, 1985.
Гринберг А.А. Введение в химию комплексных соединений. М.; Л.: Химия, 1966.
Вернер А. Новые воззрения в области неорганической химии. Л.: ОНТИ, 1936.
Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. М.: Мир, 1969.
Дятлова Н.М., Темкина В.Я., Попов К.И. Комплексоны и комплексонаты металлов. М.: Химия, 1988.
О.В. Михайлов. Многоликая изомерия координационных соединений //Природа, 2002, №5.
О.В. Михайлов. Что такое темплатный синтез// Соросвский образовательный журнал, 1999, № 10.
СОДЕРЖАНИЕ |
|
|
Введение |
2 |
|
Строение атома |
3 |
|
Модель атома Бора |
4 |
|
Квантово-механическая модель атома. |
6 |
|
Квантовые числа |
8 |
|
Главное квантовое число. |
8 |
|
Орбитальное квантовое число |
8 |
|
Магнитное квантовое число |
9 |
|
Спиновое квантовое число |
11 |
|
Строение многоэлектронных атомов |
11 |
|
1. |
Принцип минимума энергии. |
11 |
2. |
Принцип Паули. |
12 |
3. |
Правило Гунда. |
12 |
Электронные формулы атомов и Периодическая система элементов (ПСЭ) 12
Большие периоды |
13 |
Изменение свойств элементов в свете Периодического закона |
16 |
Изменение атомных радиусов. |
16 |
Энергия ионизации |
16 |
Энергия сродства к электрону |
17 |
Электроотрицательность. |
18 |
Изменение химических свойств. |
18 |
Изменение химических свойств по группе |
19 |
Изменение химических свойств по периодам |
19 |
Список литературы |
20 |
Введение
Одной из важнейших химических теорий является атомная теория. В 1805 г. английский химик и физик Дж. Дальтон представил доказательства в поддержку гипотезы о том, что вещества состоят из маленьких частиц материи. Он назвал эти частицы атомами (atomos (греч.) – неделимый). Атомы представляют собой такие частицы, которые сохраняются при химических взаимодействиях. Эта гипотеза дала простое объяснение количественному соотношению веществ, участвующих в химических реакциях. Атомы являются структурными единицами всех твердых веществ, жидкостей и газов. В настоящее время имеются многочисленные доказательства существования атомов. Но если на начальных этапах разработки атомной теории аргументация основывалась на химических фактах, то, начиная с прошлого столетия, методы физики позволили получить множество непосредственных доказательств существования атомов и информацию об их свойствах.
Атом – наименьшая частица химического элемента, способная к самостоятельному существованию и являющаяся носителем его свойств.
Атом – система взаимодействующих элементарных частиц, состоящая из ядра, образованного протонами и нейтронами, и электронов. В ядре сосредоточена основная масса атома.
Название частицы |
масса, кг |
масса, а.е.м. |
заряд, усл.ед |
заряд, Кл |
|
|
|
|
|
Протон |
1,6726·10-27 |
1,00728 |
+1 |
1,6·10-19 |
|
|
|
|
|
Нейтрон |
1,6749·10-27 |
1,00867 |
0 |
0 |
|
|
|
|
|
Электрон |
9,109·10-31 |
5,468·10-4 |
-1 |
-1,6·10-19 |
|
|
|
|
|
А.е.м. – атомная единица массы – 1/12 часть массы наиболее распространенного естественного стабильного изотопа углерода 12С.
Химический элемент – совокупность атомов с одинаковым зарядом ядра.
ZA Э А – массовое число
Z – заряд ядра атома (число протонов в ядре),
соответствует порядковому номеру элемента в периодической системе
А = Z – N, где N – число нейтронов.
Изотопы – атомы с одинаковым зарядом ядра, но разным массовым числом (разное число нейтронов). В химическом отношении изотопы являются неразличимыми атомами. Например, 1735Cl, 1736Cl, 1737Cl .
Изобары – атомы с одинаковым массовым числом, но разным зарядом.
Например, 1840 Ar, 1940 K , 2040Ca .
Строение атома
Долгое время считалось, что атом это неделимая частица, но открытия конца XIX в – начала ХХ в, показали сложную структуру атомов.
Доказательством сложной структуры атомов послужило открытие явления радиоактивности. В 1896 г. Беккерель обнаружил радиоактивность урана, а в 1898 г. П. и М. Кюри определили, что такими же свойствами обладают радий и полоний. Атомы радиоактивных элементов неустойчивы и постепенно разрушаются, образуя новые атомы, новые химические элементы, отличные по своим свойствам от материнских элементов.
Вэто же время в 1897 г. Дж. Дж. Томсон в результате проведенных опытов по изучению прохождения электричества через газы пришел к выводу о существовании электрона и определил некоторые его свойства. Было установлено, что электроны могут быть выделены из атомов любого элемента, при этом отношение заряда электрона к его массе было одним и тем же. Это доказывало, что природа электрона одна и та же не зависимо от природы вещества, то есть электрон является структурной единицей атома любого химического элемента. Электрон является заряженной частицей, заряду электрона было приписано отрицательное значение, а атом не обладает электрическим зарядом, он электронейтрален. Следовательно, в атомах кроме электронов должны содержаться и положительно заряженные частицы. Таким образом, возник вопрос о строении атома, о его внутренней структуре.
В1903 г. Дж. Дж. Томсон предложил модель, согласно которой атом состоит из положительного заряда, равномерно распределенного по всему объему атома и электронов, колеблющихся внутри этого заряда.
Опыты Резерфорда по рассеянию -частиц тонкими металлическими пластинками позволили сделать выводы, что в очень малом объеме атома сконцентрирован положительный заряд. И в 1911 г. Резерфорд предложил планетарную модель атома, согласно которой электроны в атоме вращаются вокруг положительного ядра, в котором сосредоточена основная часть массы атома, и центробежная сила в точности уравновешивается кулоновским притяжением. Уже из опытов Резерфорда следовало, что заряд ядра численно равен порядковому номеру элемента в периодической системе.
Согласно такой модели атом должен был бы поглощать или излучать энергию любыми порциями, при этом изменялся бы только радиус орбиты электрона. Это противоречило экспериментальным данным известным к тому времени и реальным свойствам атома.
1.Из электродинамики известно, что вращающийся вокруг некоторого центра заряд является источником электромагнитных колебаний, поэтому электрон, излучая, должен был непрерывно терять энергию и в итоге упасть на ядро, в результате атом прекратит свое существование.
2.Наличие атомов водорода образующихся при электрическом разряде в газообразном водороде можно установить по испускаемому ими свету. В отличие от излучения нагретого источника свечение электрического разряда приводит к появлению только определенных цветов в виде линейчатого спектра (рис. 1). Это
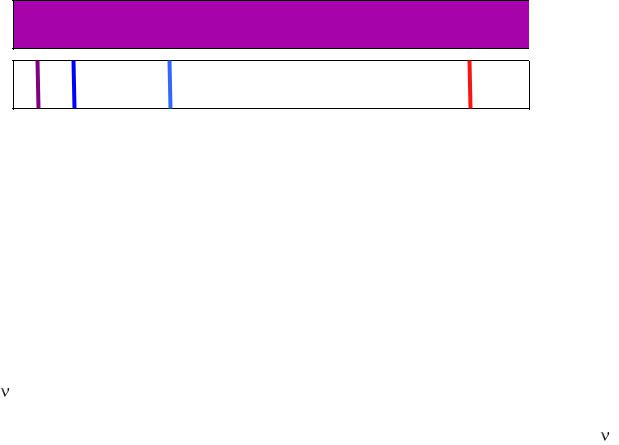
означает, что атом водорода может излучать лишь некоторые определенные количества энергии.
а
б
Рис. 1. Видимая область спектра (а) и линейчатый спектр атома водорода в видимой области (б).
Модель атома Бора
В 1900 г. М. Планк для объяснения особенностей распределения энергии в спектрах нагретых тел предложил теорию, основанную на предположении, что энергия не излучается атомами непрерывно, а испускается отдельными мельчайшими неделимыми порциями – квантами, величина которых зависит от частоты излучаемого света:
E=h
где Е – энергия кванта
– частота колебаний h – постоянная Планка.
Таким образом, энергия тела может меняться на величины, кратные h , подобно тому, как электрический заряд может меняться лишь на величину, кратную заряду электрона.
В 1913 г. Нильс Бор попытался обосновать планетарную модель атома, предложенную Резерфордом, с учетом квантовой природы излучения. Он рассматривал электрон как частицу с определенной массой и определенным зарядом, которая движется вокруг ядра по определенным траекториям и взаимодействует с ядром по законам классической электродинамики.
Бор выдвинул следующие постулаты (бездоказательные утверждения):
1.Электрон может вращаться вокруг ядра не по любым орбитам, а только по некоторым круговым орбитам. Эти орбиты получили название стационарных. Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии.
2.Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергий атома в конечном и исходном состояниях.
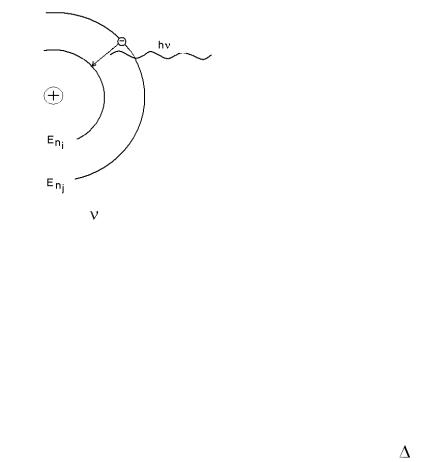
Enj – Eni = h
Достоинства модели атома по Бору
1.Бор вычислил уровни энергии электрона в атоме водорода.
En = -13,6/n2, где n – номер орбиты. Энергия электрона возрастает по мере удаленности орбиты от ядра. Отрицательный знак энергии означает устойчивость системы, которая тем более устойчива, чем ниже ее энергия.
2.Бор вычислил радиусы «дозволенных орбит».
r1 = 0,529 Å, 1 Å (1 ангстрем) = 10-10 м. rn = 0,529n2.
3. Рассчитанные частоты из соотношения E = h совпали с данными полученными из атомных спектров атома водорода и некоторых других частиц с одним электроном, например, Не+.
совпали с данными полученными из атомных спектров атома водорода и некоторых других частиц с одним электроном, например, Не+.
Недостатки модели атома по Бору
1.Модель не может объяснить, почему происходит квантование и почему электрон на орбите не излучает энергию, как того требует электродинамика. Оба эти свойства были постулированы.
2.Теоретические и экспериментальные данные совпадали для частиц, содержащих один электрон, но теория не могла объяснить спектральные характеристики многоэлектронных атомов, даже для самого простого случая – атома Не.
3.Теорию оказалось невозможным применить для объяснения химической связи.
На основе общепринятого сейчас квантовомеханического описания атома можно сказать, что данная теория имела внутренние противоречия – она ни последовательно классическая, ни квантовая. Несмотря на это теория Бора открыла дорогу квантовой механике, хотя впоследствии почти все детали данной модели были опровергнуты.

Квантово-механическая модель атома.
Воснове квантово-механической теории лежат следующие положения:
1.Энергия в микромире поглощается или излучается дискретно в виде квантов. Как уже упоминалось выше, данное представление о квантах было введено М. Планком.
2.Все микрочастицы имеют двойственный характер. В 1924 г. Луи де Бройль предположил, что электрон подобно фотону можно рассматривать и как частицу и как волну. Движение любой материальной частицы можно
рассматривать как волновой процесс, при этом справедливо соотношение = h/mv, где m и v – масса и скорость частицы. Эти волны получили название волн де Бройля. Предположение де Бройля в дальнейшем подтвердилось опытами по дифракции и интерференции электронов на кристаллах металлов.
3.Принцип неопределенности. Соотношение неопределенностей было установлено Гейзенбергом. Согласно этому соотношению невозможно одновременно точно определить местоположение частицы и ее импульс. Соотношение неопределенностей имеет вид:
x p h/2 , где x – неопределенность координаты, p – неопределенность импульса.
p h/2 , где x – неопределенность координаты, p – неопределенность импульса.
Чем точнее определяется координата частицы, тем более неопределенным становится ее импульс, и, наоборот, чем точнее известен импульс, тем более неопределенна координата.
Система понятий в квантовой механике резко отличается от классической. Квантовая механика дает вероятности нахождения частиц и ничего не говорит о траектории частицы, ее координатах и скорости в тот или иной момент времени – эти понятия в квантовой механике не имеют смысла. Однако в ней сохраняют свое значение понятия о величинах массы, заряда, энергии и момента импульса частицы.
Законы движения микрочастиц в квантовой механике выражаются уравнением Шредингера:
|
|
|
|
|
|
(x, y, z) |
2m |
(E U ) (x, y, z) 0 |
, |
|
|
|
|
2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
2 |
|
|
|
|
||
где |
|
|
|
|
|
– оператор Лапласа, |
|
||
x2 |
|
y 2 |
z 2 |
|
|||||
– волновая функция (пси-функция), m – масса частицы,
U – потенциальная энергия, Е – полная энергия,
ħ = h/2 .
Уравнение Шредингера с математической точки зрения является дифференциальным уравнением второго порядка в частных производных. Волновая функция Ψ = Ψ(x,y,z) является решением этого уравнения. Подобные
уравнения чаще всего аналитически не решаются, поэтому в квантовой физике существует очень узкий круг задач, решаемых в аналитическом виде до конца.
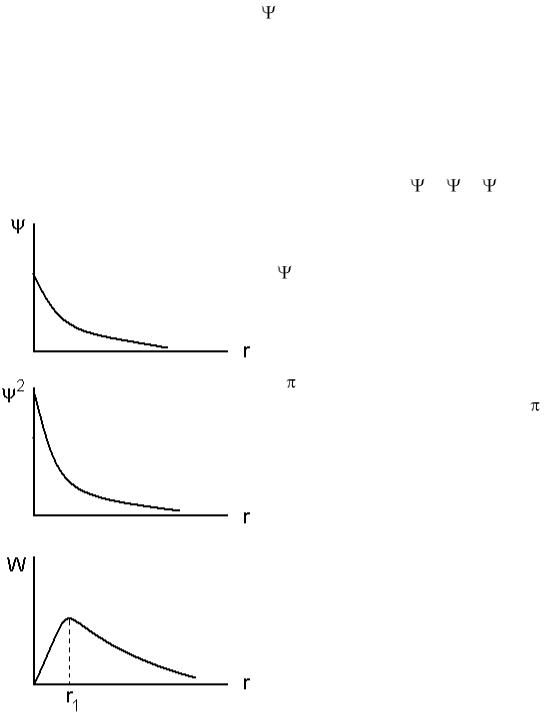
Таким образом, состояние электрона в атоме водорода описывается с помощью волновой функции – (пси). Эта функция содержит информацию об энергии электрона и о вероятности его нахождения в различных областях пространства около ядра.
Величина Ψ2 называется плотностью вероятности обнаружения электрона вблизи заданной точки. Тогда W = Ψ2·dV – вероятность нахождения электрона в объеме dV.
Атом водорода устроен наиболее просто – он имеет только один электрон, движущийся в поле ядра. Решение уравнения Шредингера показывает, что это
уравнение имеет не одно, а набор решений – |
1, |
2, 3. |
Оказывается, что |
допустимые значения Е, соответствующие |
|||
решениям уравнения Шредингера, в точности |
|||
отвечают уровням |
энергии |
атома водорода. |
|
-функция |
основного |
энергетического |
|
состояния является экспонентой с максимумом в начале координат (рис. 2). В качестве элемента объема dV возьмем сферический слой
толщиной dr на расстоянии r от ядра: |
dV = |
|
4 r2dr |
|
|
W = Ψ24 r2dr. |
|
|
Функция W определяющая |
пространственное |
|
распределение электрона в |
невозбужденном |
|
атоме водорода, обращается в нуль вместе с r2 в начале координат и экспоненциально убывает
при больших r, при r1 |
эта функция достигает |
|||
максимума (рис. |
2). |
Для |
атома |
водорода |
r1 = 0,53 Å – эту |
величину |
принято |
называть |
|
радиусом первой боровской орбиты атома водорода. В действительности, никаких орбит у электронов в атоме, конечно, не существует, это название перешло в современную физику из полуклассической теории Бора.
Рис. 2.
Полный анализ уравнения Шредингера не возможен без решения соответствующего дифференциального уравнения, что выходит за рамки нашего курса, поэтому мы ограничимся общими выводами:
1.Из решения уравнения Шредингера автоматически вытекает существование дискретных уровней энергии, то есть квантованность энергетических состояний оказывается следствием присущих электрону волновых свойств.
2.Электрон может находиться в любой части пространства, окружающего ядро, но вероятность его пребывания в той или иной части неодинакова. Область пространства, в которой с вероятностью 90–95 % можно обнаружить электрон получила название атомной орбитали.
3.Решение уравнения Шредингера приводит непосредственно к трем квантовым числам, которые характеризуют энергетическое состояние и поведение электрона в атоме.
Квантовые числа
Энергетическое состояние электрона в атоме может быть полностью описано набором из четырех квантовых чисел: n – главное квантовое число
l – орбитальное квантовое число ml – магнитное квантовое число ms – спиновое квантовое число.
Первые три квантовых числа (n, l, ml) следуют из решения уравнения Шредингера и полностью описывают атомную орбиталь.
Главное квантовое число.
Главное квантовое число принимает целочисленные значения: n = 1, 2, 3… . Оно характеризует основной уровень энергии электрона и размер электронного облака. В многоэлектронных атомах совокупность электронов с одинаковым значением главного квантового числа называется электронным слоем. Каждому уровню энергии (n) соответствует буквенное обозначение электронного слоя.
Главное квантовое число n |
1 |
2 |
3 |
4 |
5 |
6 |
… |
(номер энергетического уровня) |
|
|
|
|
|
|
|
Буквенное обозначение электронного |
K |
L |
M |
N |
O |
P |
… |
слоя |
|
|
|
|
|
|
|
Орбитальное квантовое число
При размещении электрона вдали от ядра происходит расщепление уровня энергии на подуровни. Чем дальше электрон от ядра, тем сильнее расщепление, тем больше подуровней у данного энергетического уровня.
Орбитальное квантовое число зависит от n и может принимать целочисленные значения от 0 до (n – 1): l = 0, 1, …, (n-1). Сумма подуровней на уровне численно равна номеру уровня. В многоэлектронных атомах совокупность

электронов с одинаковым значением орбитального квантового числа называется электронной оболочкой. Каждому подуровню энергии соответствует буквенное обозначение подуровня.
Орбитальное квантовое число l |
0 |
1 |
2 |
3 |
4 |
5 |
… |
Буквенное обозначение подуровня |
s |
p |
d |
f |
g |
h |
… |
Орбитальное квантовое число определяет форму орбитали.
l = 0 |
l = 1 |
l = 2 |
s-орбиталь |
p-орбиталь |
d-орбиталь |
Магнитное квантовое число
Характеризует результат взаимодействия магнитного поля движущегося электрона с наложенным внешним магнитным полем. Экспериментально такое взаимодействие обнаруживается по расщеплению линий в спектре атома в магнитном поле. Тип взаимодействия определяется формой орбитали, поэтому ml зависит от l. Магнитное квантовое число определяет дискретные возможные ориентации атомных орбиталей в пространстве. Магнитное квантовое число принимает целочисленные значения от –l до +l: ml = –l, …, 0, …, +l . Число возможных значений ml при данном значении l соответствует числу способов ориентации орбиталей в пространстве.
l = 0, ml = 0
z
pz
l = 1, ml = -1, 0, +1
y
py
px
x
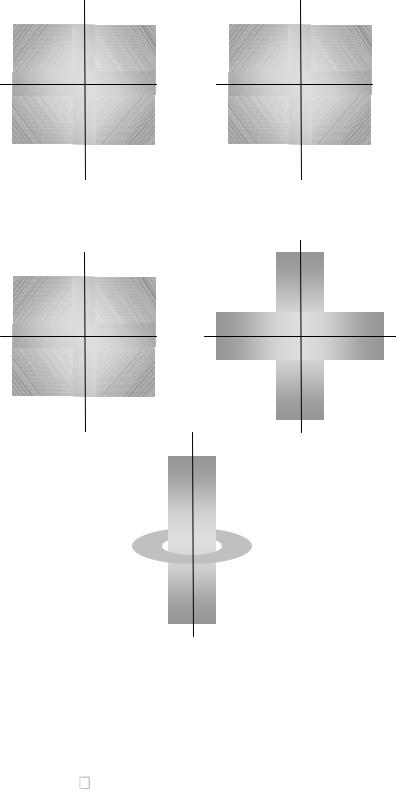
y |
z |
x |
x |
d xy d xz
y
z
l = 2, ml = -2, -1, 0, +1, +2
y |
x |
d yz |
z |
d x2 – y2 |
|
d z2
Таким образом, любой подуровень (кроме s-подуровня) может быть разбит на условные энергетические ячейки ( ), каждая из которых характеризуется определенным значением ml из указанного диапазона допустимых значений. Каждая ячейка представляет атомную орбиталь и описывается определенными значениями n, l, ml. Причем суммарное число значений ml определяет число атомных орбиталей на данном подуровне энергии.
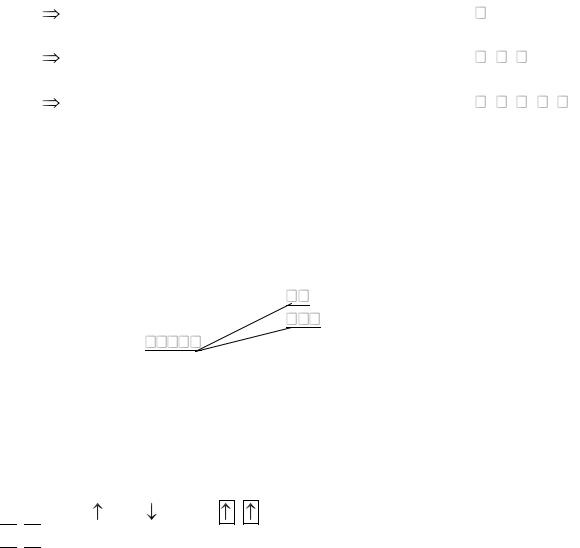
Пример: |
|
|
l = 0 |
ml = 0: |
s-подуровень |
|
|
ml = 0 |
l = 1 |
ml = -1, 0, +1: |
p-подуровень |
|
|
ml = -1 0 +1 |
l = 2 |
ml = -2, -1, 0, +1, +2 |
d-подуровень |
|
|
ml = -2 -1 0 +1 +2 |
|
В отсутствии внешнего магнитного поля энергетические уровни в атоме с |
|
разными значениями ml имеют одинаковую энергию – говорят энергетические уровни вырождены. При наложении внешнего магнитного поля орбитали по разному ориентированные в пространстве по разному с этим полем взаимодействуют. Энергия всех орбиталей возрастает, но неодинаково, то есть подуровень энергии расщепляется.
вырождение
снимается
d-подуровень
Спиновое квантовое число
Спиновое квантовое число характеризует собственный момент количества движения электрона. Направление спина электрона может совпадать с направлением орбитального магнитного момента, тогда ms = +1/2; или противонаправлен, тогда ms = -1/2. Направление спина условно обозначается
стрелками или . Если |
– говорят о параллельной установке спина, если |


 говорят об антипараллельной установке спина.
говорят об антипараллельной установке спина.
Строение многоэлектронных атомов
В многоэлектронном атоме каждый электрон не только притягивается ядром, но и отталкивается другими электронами. Точное решение уравнения Шредингера неизвестно. Существует ряд приближенных методов расчета. Практически при построении электронной оболочки многоэлектронного атома руководствуются следующими тремя принципами (правилами):
1. Принцип минимума энергии.
Электроны в атоме стремятся занять самое низкое из возможных энергетическое положение, что отвечает наибольшей устойчивости системы. Электроны в основном состоянии заполняют орбитали в порядке повышения уровня энергии орбиталей. Последовательность заполнения атомных орбиталей электронами зависит от значений главного квантового (n) и орбитального (l) квантовых чисел. Эту зависимость установил В.М.Клечковский.

Правило Клечковского: Увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел (n+l), а при равной сумме (n+l) в порядке возрастания числа n.
Пример. Какой подуровень заполняется первым 4s- или 3d-подуровень? Для этого в соответствие с правилом Клечковского определим сумму квантовых чисел (n+l) для данных состояний:
Подуровень |
4s |
3d |
n |
4 |
3 |
l |
0 |
2 |
(n + l) |
4 |
5 |
Сумма (n + l) меньше для 4s - электронов, следовательно, энергия электронов Е4s < E3d, т.е. первым заполняется 4s-, а затем 3d-подуровень.
2.Принцип Паули.
Ватоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Следствие из этого принципа: на одной атомной орбитали могут размещаться
только два электрона, отличающиеся спиновыми характеристиками: |
|
. |
||||||
Предельное число электронов |
|
|
|
|||||
|
|
|
||||||
На оболочках |
|
В слоях |
|
|
|
|||
s |
|
2 |
|
K |
2 |
|
|
|
p |
|
6 |
|
L |
8 |
|
|
|
d |
|
10 |
|
M |
18 |
|
|
|
f |
|
14 |
|
N |
32 |
|
|
|
3. Правило Гунда. |
|
|
|
|
||||
|
Электроны |
в пределах одного подуровня распределяются таким образом, |
||||||
чтобы их суммарный спиновый момент был максимален (стремятся остаться неспаренными).
Пример: распределение электронов в состоянии |
р2 |
|
|
|
|
р3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
р4 |
|
|
|
|
|
|
|
|
Электронные формулы атомов и Периодическая система элементов (ПСЭ)
Сравним электронное строение атомов с их положением в таблице Менделеева:
1.Число электронов в атоме элемента численно равно номеру элемента в ПСЭ.
2.Число электронных слоев (номер последнего слоя) соответствует номеру периода.

I период |
|
|
H |
1s1 |
s-элементы |
He |
1s2 |
|
II период |
|
|
Li |
1s22s1 |
s-элементы |
Be |
1s22s2 |
|
B |
1s22s22p1 |
|
С |
1s22s22p2 |
р-элементы |
………………… |
|
|
Ne |
1s22s22p6 |
|
III период |
|
|
Na |
1s22s22p63s1 |
s-элементы |
Mg |
1s22s22p63s2 |
|
Al |
1s22s22p63s23p1 |
|
…………………….. …. р-элементы |
||
Ar |
1s22s22p63s23p6 |
|
s-элементами называются те элементы, у которых построение электронной оболочки заканчивается присоединением s-электрона.
p-элементы – это те, у которых достраивается р-оболочка.
Большие периоды
Последний элемент 3 периода Ar имеет конфигурацию внешнего слоя 3s23p6. Подуровень 3d остается пустым. Следующий за ним элемент К стоит в первой группе, т.е. является s-элементом и имеет конфигурацию … 3s23p64s1. Почему 4s- подуровень начал заполняться раньше 3d-подуровня?
Вследствие взаимодействия электронов между собой в многоэлектронных атомах, стоящих в больших периодах, порядок заполнения подуровней нарушается из-за их перекрывания по шкале энергии. Энергия 4s-подуровня оказывается меньше, чем энергия 3d-подуровня. Причина в том, что ядро экранируется плотными и симметричными орбиталями ближайших к ядру оболочек, силы притяжения ядра не хватает для удержания электронов на 3d оболочке и состояние 4s, отвечающее более высокой симметрии, оказывается энергетически более выгодным. Экранирующий эффект зависит от заряда ядра, числа слоев, формы электронных орбиталей.
Наибольшее перекрывание слоев наблюдается у элементов конца ПСЭ. Подуровни 5d и 4f, а также 6d и 5f настолько близки по энергетическим характеристикам, что электроны легко переходят с одного на другой подуровень и бывает трудно установить их положение.
Напомним, что зависимость последовательности заполнения орбиталей определяется правилом Клечковского.
Элементы, у которых идет заполнение электронами d-подуровня, называются d-элементами. Они образуют побочные подгруппы ПСЭ, у них достраивается d-
подуровень внутреннего (предыдущего) слоя. |
|
|
||
IV период |
|
|
|
|
|
|
|
В соответствии с правилом |
|
K |
…..4s1 |
s-элементы |
Клечковского |
|
Ca |
…..4s2 |
|
3d или 4s |
|
|
|
|
3d: n = 3, l = 2 |
n + l = 5 |
|
|
|
4s: n = 4, l = 0 |
n + l = 4 |
|
|
|
заполняется 4s |
|
Sc |
….3s23p63d14s2 |
|
3d или 4p |
|
………………………. |
|
3d: n = 3, l = 2 |
n + l = 5 |
|
Cr |
….3s23p63d54s1 |
(провал электрона) |
4p: n = 4, l = 1 |
n + l = 5 |
Mn |
….3s23p63d54s2 |
d-элементы |
т.к. n = 3 < n = 4 |
|
………………………. |
|
заполняется 3d |
|
|
Cu |
….3s23p63d104s1 |
(провал электрона) |
|
|
Zn |
….3s23p63d104s2 |
|
|
|
Ga |
….3s23p63d104s14p1 |
|
|
|
………………………. |
p-элементы |
|
|
|
Kr |
….3s23p63d104s14p6 |
|
|
|
Провал электрона – ускоренная достройка d- или f- подуровней до
устойчивой конфигурации d5, d10, f7, f14, что энергетически выгодно |
|
|||
|
1 группа, п/гр Б |
6 группа, п/гр Б |
||
4 |
период Сu 3s23p63d94s2 |
3s23p63d104s1 |
Сr 3s23p63d44s2 |
3s23p63d54s1 |
5 |
период Ag 4s24p64d95s2 |
4s24p64d105s1 |
Mo 4s24p64d45s2 |
4s24p64d55s1 |
6 |
период Au 5s25p65d96s2 |
5s25p65d106s1 |
W 5s25p65d46s2 |
5s25p65d56s1 |
У атома Pd (5 период 8 группа п/гр Б) наблюдается “провал” двух электронов: Pd 4s24p64d 8 5s2 4s24p64d105s0
V период аналогичен IV
внешний слой 5, а у d-элементов заполняется 4d подуровень
VI период
Cs ….4d105s25p66s1
Ba ….4d105s25p66s2 s-элементы
La ….4d105s25p65d16s2 – d-элемент

Сe |
….4d104f2 5s25p65d06s2 |
Pr |
….4d104f3 5s25p65d06s2 |
…………………………………
Gd |
….4d104f7 5s25p65d16s2 |
|
… |
|
|
Lu |
….4d104f14 |
5s25p65d16s2 |
Hf |
….4d104f14 |
5s25p65d26s2 |
…………………………………
Hg …………………5d106s2
Tl ………………5d26s26p1
…………………………………. Rn …..…………..5d26s26p6
VII период аналогичен VI, но неокончен
Выводы:
f-элементы лантаноиды
III гр., вторичная побочная подгруппа У всех лантоноидов кроме Gd и Lu наблюдается провал электрона с 5d подуровня на 4f подуроовень
d-элементы
р-элементы
1)Каждый новый период начинается с заполнения нового слоя.
2)Каждый период начинается с s-элементов, они находятся в I, II группах, а заканчивается р-элементами, которые находятся в III VIII группах (кроме 1
периода). Последний из р-элементов каждого периода – инертный газ с устойчивой восьмиэлектронной конфигурацией внешнего слоя ns2p6. Инертные
газы характеризуются наивысшими энергиями ионизации.
З) s- и p- элементы образуют главные подгруппы ПСЭ (подгруппы А). d-элементы – побочные подгруппы (подгруппы Б)
4)У s- и p- элементов заполняется внешний слой. Число электронов на внешнем слое равно номеру группы.
5)У d-элементов заполняется d-подуровень предвнешнего слоя –
…(n-1) s2p6d1 10ns2.
6)У f-элементов заполняется f-подуровень предпредвнешнего слоя –
…(n-2)s2p2d10f(2 14)(n-1)s2p6d1(0)ns2.
7)Элементы VII все радиоактивны, начиная с Np, все изотопы элементов получены искусственным путем в ходе ядерных реакций.
Изучение строения атомов показало, что элементы располагаются в определенном порядке в соответствии с зарядом их ядер и строением электронной оболочки их атомов.
Современная формулировка периодического закона звучит так: Свойства элементов, а так же состав и свойства их соединений находятся в периодической зависимости от заряда ядра.
Изменение свойств элементов в свете Периодического закона
С увеличением заряда ядра атомов наблюдается закономерное изменение в их электронной структуре, что приводит к закономерному изменению химических и тех физических свойств атомов элементов, которые зависят от электронного строения (радиус атома или иона, энергия ионизации, температуры плавления, кипения, плотность, стандартная энтальпия образования и др.)
Изменение атомных радиусов.
Атом не имеет строго определенных границ, что следует из особенностей его строения. Поэтому на практике пользуются следующими величинами:
Орбитальный радиус атома – расстояние от ядра до наиболее удаленного максимума электронной плотности.
Эффективный радиус – 1/2 межъядерного расстояния для рассматриваемого элемента в кристалле.
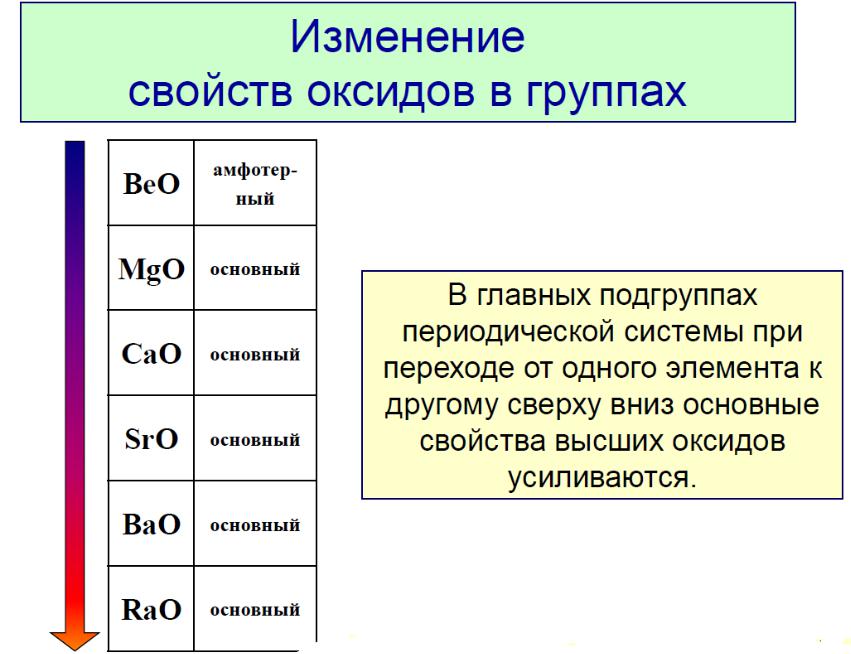
В пределах периода (слева направо) радиус атома уменьшается, т.к. увеличивается заряд ядра при том же числе электронных слоев (увеличивается притяжение электронов к ядру). В пределах подгруппы данной группы радиус атома увеличивается (сверху вниз), т.к. увеличивается число электронных слоев.
В малых периодах, в которых только s- и p-элементы, изменение радиуса от элемента к элементу очень существенно, поскольку происходит изменение внешнего электронного слоя. У переходных d-элементов радиус меняется более монотонно, поскольку электронная структура внешнего слоя не меняется, а внутренние d-орбитали экранируют ядро и ослабляют влияние возрастающего заряда на внешние электронные слои атома. У f-элементов изменяется электронная структура еще более глубоко лежащего слоя, поэтому радиус изменяется еще менее значительно. Замедленное уменьшение размера атома с ростом заряда ядра за счет экранирующего действия на ядро d- и f-орбиталей называется d- и f-сжатием.
Энергия ионизации
Нейтральные атомы элементов при различных взаимодействиях обладают способностью отдавать или присоединять электроны, превращаясь при этом в положительноили отрицательнозаряженные ионы.
Энергия ионизации характеризует способность атомов отдавать электроны.
Энергия ионизации (I) – это та энергия, которую необходимо затратить, чтобы отделить электрон от атома (нейтрального, невозбужденного, газообразного) и увести его в бесконечность.

Н – е = Н+, |
I = 13,6 эВ/атом, |
|
Ниониз. = 1300кДж/моль |
Обычно сравниваются только первые потенциалы ионизации, т.е. отрыв первого электрона. Отрыв последующих электронов требует большей энергии.
Э – е |
Э+ |
I1 |
Э+ – е |
Э2+ |
I2 |
…………………
I1 < I2 < ………
По периоду (слева направо) потенциал ионизации растет, что связано с уменьшением радиуса атомов.
Вподгруппах ПСЭ ионизационные потенциалы изменяются неодинаково. В главных подгруппах потенциал уменьшается сверху вниз, что связано с
возрастанием радиуса и эффектом экранирования ядра внутренними устойчивыми оболочками s2p6. В побочных подгруппах ионизационный потенциал возрастает сверху вниз, поскольку радиус меняется незначительно, а недостороенная оболочка плохо экранирует ядро.
Вцелом, для металлов характерны малые значения энергии ионизации, т.е. атомы металлов легко отдают электроны (минимальный потенциал ионизации имеют Cs, Fr), для неметаллов – большие значения энергии ионизации.
Энергия сродства к электрону
Энергия сродства к электрону характеризует способность атома присоединять электроны.
Энергия сродства к электрону Е (эВ/атом) или энтальпия сродства к электрону
Нсродства (кДж/моль) – это та энергия, которая выделяется при присоединении электрона к нейтральному невозбужденному атому с образованием отрицательно
заряженного иона.
F 2s22p5 + e = F- 2s22p6 + Q
Неметаллы характеризуются большими значениями Е. В электронной структуре их атомов во внешнем слое 5 и более электронов и до устойчивой восьмиэлектронной конфигурации не хватает 1 3 электронов. Присоединяя электроны, атомы неметаллов приобретают отрицательные степени окисления,
например, S (-2), N (-3), O (-2) и т.д.
Металлы характеризуются малыми значениями Е.
Электроотрицательность.
Электроотрицательность позволяет оценить способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения.
Согласно одному из определений ЭО = ½(I + E).
Обычно используют относительные значения ЭО по Полингу (ОЭО) ОЭО (F) = 4 – самый электроотрицательный
Атомы, которые прочно удерживают свои электроны и легко принимают чужие, имеют наибольшие значения ОЭО – это типичные неметаллы - фтор (ОЭО=4), кислород (ОЭО=3,5), водород ОЭО=2,1.
Металлы имеют малые значения ЭО и легко отдают свои электроны. По периоду ЭО увеличивается, по главным подгруппам – уменьшается.
Изменение химических свойств.
При химическом взаимодействии атомов любых элементов наибольшее участие в этом процессе принимают электроны внешних слоев, наиболее удаленные от ядра, наименее связанные с ним, называемые валентными.
Уs-элементов валентными являются электроны внешнего слоя, s-электроны
Ур-элементов – s-электроны и р-электрорны внешнего слоя.
Уd-элементов валентными являются s-электроны внешнего слоя (в первую очередь) и d-электроны предвнешнего слоя.
Уf-элементов валентными будут s-электроны внешнего слоя (в первую очередь), d-электроны предвнешнего слоя (если они есть) и f-электроны предпредвнешнего слоя.
Максимальное количество валентных электронов, которые атом может “отдать”
при |
взаимодействии, приобретая при этом максимальную положительную |
|||||
степень окисления, соответствует № группы в ПСЭ. |
||||||
3 гр. |
Al |
…2s 2 2p6 |
3s2 3p1 |
3e |
Al(+3) 2s2 2p6 |
|
6 гр. |
S |
…2s 2 2p6 |
3s2 3p4 |
6e |
S(+6) 2s2 2p6 |
|
6 гр. |
Cr |
…3s23p63d54s1 2e |
Cr(+2) 3s23p63d4 |
|||
|
Cr(+2)…3s23p63d4 |
1e |
Cr(+3) 3s23p63d3 |
|||
|
Cr(+3)…3s23p63d3 |
3e |
Cr(+6) 3s23p6 |
|||
ИСКЛЮЧЕНИЕ: F – нет положительной степени окисления
О– максимальная положительная степень окисления +2 в соединении OF2
Элементы 1 группы п/гр Б |
Au – максимально +3 |
|
Cu, Ag – максимально +2 |
Элементы 8 группы п/гр Б |
Co, Ni, Rh, Pd, Ir, Pt – нет |
|
степени окисления +8 |

Атомы неметаллов присоединяя электроны приобретают отрицательные степени окисления.
S …2s 2 2p6 3s2 3p4 + 2e S(-2) 3s2 3p6
Металлы не имеют отрицательных степеней окисления.
Изменение химических свойств по группе
Элементы, расположенные в одной подгруппе ПСЭ, имеют одинаковую структуру одного (электронные аналоги) или двух внешних слоев (полные электронные аналоги) и характеризуются близкими химическими свойствами, являются химическими аналогами.
Рассмотрим элементы 7 группы главной подгруппы А:
F |
2s22p5 |
|
Cl |
2s22p63s23p5 |
|
Br |
3s23p63d104s24p5 |
электронные аналоги |
I |
4s24p64d105s25p5 |
полные аналоги |
Элементы, расположенные в одной группе ПСЭ, но в разных погруппах, являются неполными электронными аналогами, например, Cl и Mn, V и Р и др. Почему?
Электронное строение нейтральных атомов хлора и марганца отличаются совершенно и химические свойства этих веществ в свободном состоянии не похожи: Cl –это р-элемент, типичный неметалл, газ, Mn – d-металл. Ионы хлора и марганца со степенями окисления (+7) уже являются электронными аналогами и имеют много общего в химическом отношении:
|
|
|
|
Оксиды |
Кислоты |
Соли |
Cl |
2s22p63s23p5 |
Cl (+7) |
2s22p6 |
Cl2O7 |
HClO4 |
КClO4 |
|
|
|
|
|
хлорная |
перхлорат |
|
|
|
|
|
|
калия |
Mn |
3s23p63d54s2 |
Mn(+7) |
3s23p6 |
Mn2O7 |
HMnO4 |
КMnO4 |
|
|
|
|
|
марган- |
перманганат |
|
|
|
|
|
цовая |
калия |
Изменение химических свойств по периодам
Закономерное изменение химических свойств элементов по периодам связано с закономерным изменением радиусов атомов и строения внешних и предвнешних электронных слоев атомов.
Рассмотрим на примере элементов 2, 3, 4 периодов.
Во 2, 3 периодах от элемента к элементу химические свойства меняются очень существенно: от активного металла Li (Na) через пять элементов к активному неметаллу F (Cl), поскольку от элемента к элементу происходит изменение структуры внешнего электронного слоя.
В 4 периоде за s-элементами К, Са следует группа переходных d-металлов от Sc до Zn, атомы которых отличаются структурой не внешнего, а предвнешнего слоя, что меньше отражается на изменении химических свойств. Начиная с Ga снова меняется внешний электронный слой и резко нарастают неметаллические свойства (Br).
У f-элементов изменяется предпредвнешний электронный слой, поэтому в химическом отношении эти элементы особенно близки. Отсюда – совместное нахождение их в природе, трудности разделения.
Таким образом, в любом периоде ПСЭ наблюдается закономерное, объясняемое с позиции электронного строения, изменение химических свойств элементов (а не простое повторение свойств).
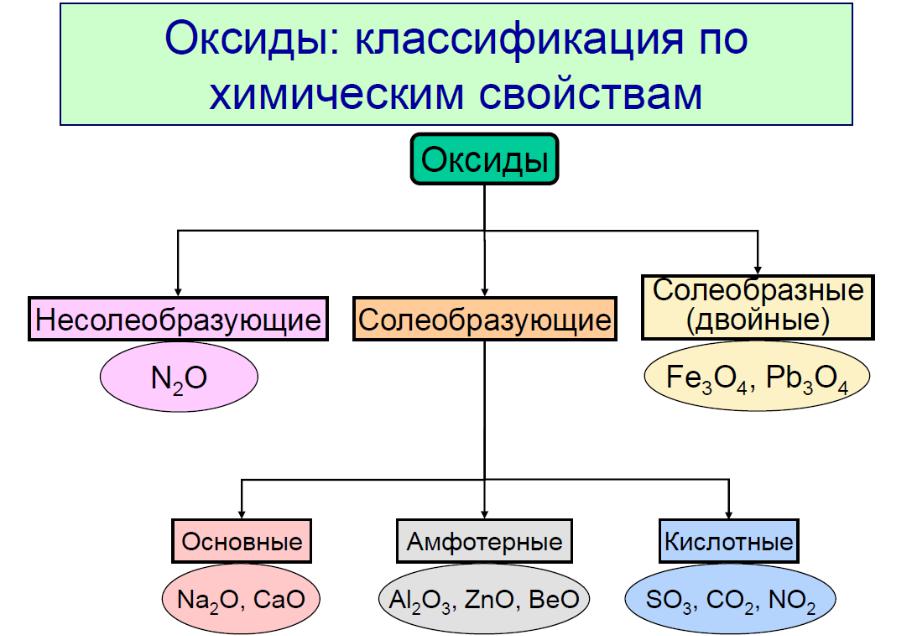
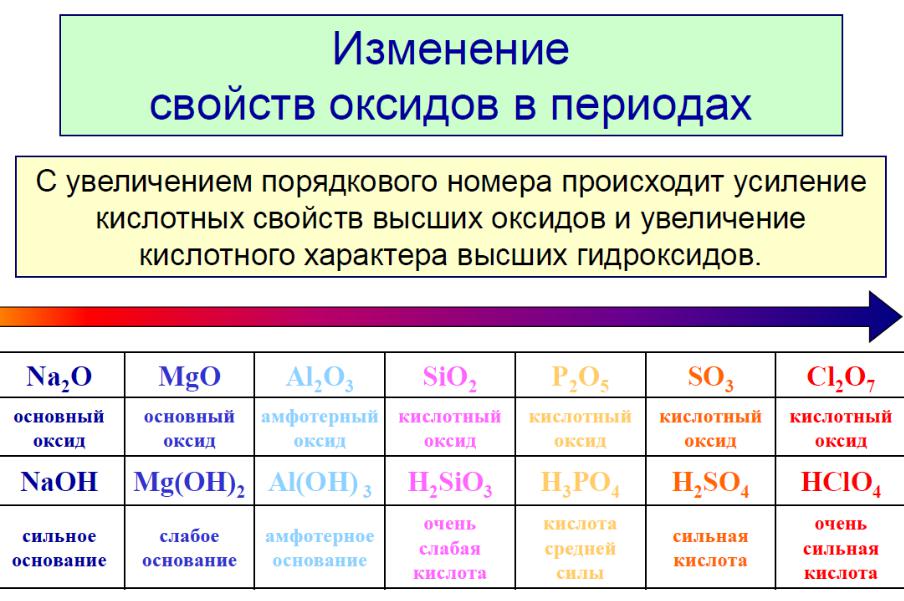
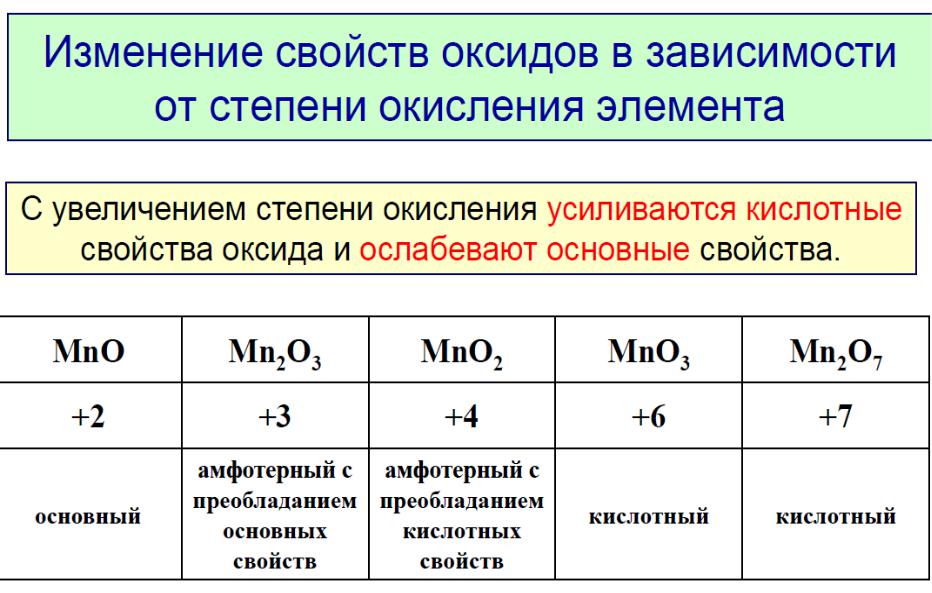
Изменение характера оксидов по периоду (на примере 3 периода).
Элемент |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Высший |
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
Cl2O7 |
оксид: |
основн. |
основн. |
амфотерн. |
кислотн. |
кислотн. |
кислотн. |
кислотн. |
|
|
|
|
|
|
|
|
Гидрат |
NaOH |
Mg(OH)2 |
Al(OH)3 |
H2SiO3 |
H3PO4 |
H2SO4 |
HClO4 |
оксида: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таким образом, в любом периоде характер оксидов (и других однотипных соединений) меняется закономерно: от основного к кислотному через амфотерный.
Список литературы
1.Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н. Л. Глинка ; под ред. А. И. Ермакова. - Изд. 30-е, испр. - М.: Интеграл-Пресс, 2004. - 728 с.: ил.
2.Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах, формулах, химических реакциях: Учеб. пособие / А.П. Гаршин. - 2-е изд., испр. и доп. - СПб.: Лань, 2000. - 288 с.
3.Карапетьянц М.Х. Общая и неорганическая химия: Учебник для студентов вузов / М.Х. Карапетьянц, С.И. Дракин. - 4-е изд., стер. - М.: Химия, 2000. -
592 с.: ил.
4.Угай Я.А. Общая и неорганическая химия: Учебник для студентов вузов, обучающихся по направлению и специальности "Химия" / Я.А. Угай. - 2-е изд., испр. - М.: Высшая школа, 2000. - 527 с.: ил.
5.Неорганическая химия: учебник для студентов вузов, обучающихся по направлению 510500 "Химия" и специальности 011000 "Химия" : в 3 т. Т. 1: Физико-химические основы неорганической химии / М. Е. Тамм, Ю. Д. Третьяков / под ред. Ю. Д. Третьякова. - М.: Академия, 2004. - 240 с.: ил.
6.Неорганическая химия: учебник для студентов вузов, обучающихся по направлению 510500 "Химия" и специальности 011000 "Химия" : в 3 т. Т. 2: Химия непереходных элементов / А. А. Дроздов, В. П. Зломанов, Г. Н. Мазо, Ф. М. Спиридонов / под ред. Ю. Д. Третьякова. - М.: Академия, 2004. - 368 с.: ил.
7.Заградник Р., Полак Р. Основы квантовой химии. Пер с чешс. – М.: Мир,
1979. – 504 с.
8.Хабердитцл В. Строение материи и химическая связь. Пер. с нем. – М.:
Мир, 1974. – 296 с.
9.Гиллеспи Р., Харгиттаи И. Модель отталкивания электронных пар валентной оболочки и строение молекул: Пер. с. англ. – М.: Мир, 1992. – 296 с.

Содержание |
|
|
ХИМИЧЕСКАЯ СВЯЗЬ ............................................................................................................. |
2 |
|
Квантово-механические представления об образовании химической связи. ............. |
2 |
|
Метод валентных связей. Ковалентная связь. .................................................................. |
3 |
|
Механизмы образования ковалентных связей.................................................................... |
4 |
|
Свойства связи. ...................................................................................................................... |
5 |
|
1. |
Энергия связи................................................................................................................. |
5 |
2. |
Длина связи .................................................................................................................... |
5 |
3. |
Направленность химической связи.............................................................................. |
5 |
|
Теория гибридизации. .................................................................................................. |
7 |
4. |
Кратность связи ........................................................................................................... |
10 |
5. Валентность. Насыщаемость. ..................................................................................... |
12 |
|
|
Правила составления валентных схем.................................................................... |
15 |
6. |
Полярность связи. Полярность молекул. .................................................................. |
16 |
Заключение........................................................................................................................... |
18 |
|
Метод молекулярных орбиталей........................................................................................ |
19 |
|
Молекула водорода Н2 ........................................................................................................ |
21 |
|
Гомоядерные молекулы, образованные атомами II периода .......................................... |
23 |
|
Гетероядерные молекулы ................................................................................................... |
24 |
|
Ионная связь .......................................................................................................................... |
25 |
|
Металлическая связь. Металлическая кристаллическая решетка. ........................... |
26 |
|
Водородная связь ................................................................................................................... |
28 |
|
Силы межмолекулярного взаимодействия ...................................................................... |
29 |
|
Литература.................................................................................................................................. |
30 |
|
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

ХИМИЧЕСКАЯ СВЯЗЬ
Взаимодействие атомов, приводящее к образованию молекул простых и сложных веществ, ионов, а также кристаллов, называют химической связью. Это взаимодействие сопровождается изменением электронной плотности, т.е. перегруппировкой электронов в поле ядер взаимодействующих атомов, а так же изменением энергетического состояния системы.
В зависимости от характера распределения электронной плотности в веществе различают следующие типы химической связи:
ковалентная; ионная; металлическая; водородная;
силы межмолекулярного взаимодействия.
Квантово-механические представления об образовании химической связи.
Поскольку силы, действующие внутри молекулы, аналогичны тем, которые действуют внутри атома, то квантово-механическое описание строения молекул получают на основе приближенного решения волнового уравнения Шредингера. Впервые такой расчет был проведен в 1927г. Гейтлером и Лондоном для молекулы водорода.
Записанное ими уравнение учитывало следующие виды взаимодействия: силы притяжения между ядрами и электронами; силы отталкивания между ядрами и между электронами;
собственное движение электронов, т.е. учтены спиновые характеристики.
В результате расчета впервые были получены значения энергии связи, которые хорошо согласовывались с экспериментальными данными. Решение волнового уравнения можно представить графически (рис. 1).
Е
(1) Н 

 +
+ 

 Н
Н
Е0 |
r |
|
r0 |
(2) Н |
+ |
Н |
Рис.1. Изменение потенциальной энергии системы (E) при образовании молекулы водорода из атомов. Е0 – энергия системы, состоящей из двух невзаимодействующих атомов; r – расстояние между ядрами.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Если в атомах спины электронов параллельны, сближение атомов будет приводить к постоянному возрастанию энергии системы и химическая связь между атомами не образуется (кривая 1).
При атипараллельных спинах сближение атомов водорода до расстояния r0 сопровождается уменьшением потенциальной энергии системы (кривая 2), дальнейшее сближение атомов ведет к увеличению энергии, вследствие возрастания межъядерного отталкивания. Таким образом, кривая (2) проходит через минимум, это говорит о том, что образуется устойчивая молекула Н2, а r0 = 0,074 нм соответствует равновесной длине связи в молекуле водорода.
Гейтлер и Лондон показали, что электронная плотность в области между ядрами в молекуле водорода оказывается выше, чем простое наложение электронной плотности атомов. Эта повышенная плотность электронного заряда между ядрами и удерживает их вместе. Таким образом, общая электронная пара двух ядер обуславливает химическую связь в молекуле.
Дальнейшее развитие теории строения молекул привело к возникновению двух основных методов, описывающих химическую связь: метод валентных связей и метод молекулярных орбиталей. Каждый из этих методов обладает преимуществами при описании одних явлений и недостатками при описании других, но в высших своих приближениях они приводят к практически одинаковым результатам, достигаемым, однако, разной ценой.
Метод валентных связей. Ковалентная связь.
В основе метода валентных связей (ВС) лежит положение о том, что каждая молекула составлена из атомов, и для объяснения электронного строения молекулы используют атомные орбитали, причем в образовании связей участвуют только внешние орбитали атомов, называемые валентными.
Согласно методу ВС каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Таким образом, ковалентная связь образуется с участием двух электронов, которые находятся в поле действия двух ядер взаимодействующих атомов, т.е. связь является двухцентровой (два ядра), двухэлектронной, локализованной (электронная плотность сосредоточена в пространстве между ядрами и стягивает их) и образование ковалентной связи происходит за счет перекрывания валентных электронных орбиталей взаимодействующих атомов.
При изображении электронной структуры молекул с помощью валентных схем общую электронную пару условно обозначают чертой ( ). Например, для молекулы водорода орбитальная диаграмма и валентная схема будут выглядеть, как показано на рис. 2.
Н2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н 1s1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н 1s1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н - Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
Орбитальная диаграмма |
Валентная схема |
||||||||||||||
|
|
|
|
||||||||||||||||
Рис. 2. Орбитальная диаграмма и валентная схема молекулы водорода. |
|
|
|
|
|||||||||||||||
Исполнитель: |
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
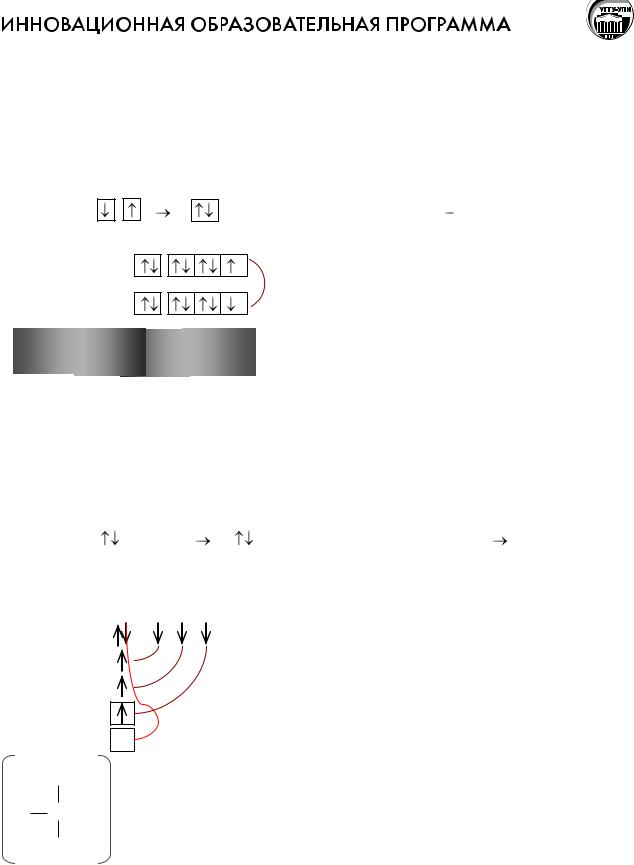
Механизмы образования ковалентных связей.
1.Обменный механизм - атомы предоставляют на образование химической связи одноэлектронные облака, которые перекрываются:
A + B А |
В |
условное обозначение А В |
Пример: Сl2
Cl … 3s23p5
Cl … 3s23p5
|
|
Cl - Cl |
Cl |
Cl |
|
Орбитальная диаграмма |
Валентная схема |
|
В орбитальной диаграмме изображают только те орбитали, которые участвуют в образовании ковалентных связей.
2.Донорно-акцепторный механизм – один атом (донор) предоставляет на образование связи двухэлектронную орбиталь, другой (акцептор) – свободную орбиталь, которые перекрываются.
|
A |
|
|
+ |
|
B А |
|
В |
условное обозначение А В |
|||
|
донор |
акцептор |
|
(направление стрелки от донора к акцептору) |
||||||||
Пример: NH4+ |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
N … 2s22p3 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
H |
1s1 |
|
|
|
|
|
|
|
3 |
связи по обменному механизму |
||
|
|
|
|
|
|
|
|
|
|
|||
H |
1s1 |
|
|
|
|
|
|
|
1 |
связь по донорно-акцепторному механизму |
||
H 1s1
H+ 1s0
H +
H N H
H
H
Валентная схема (без учета валентных углов)
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Свойства связи.
Любую химическую связь можно характеризовать, используя понятия: энергия связи, длина связи, направленность, кратность, полярность, насыщаемость.
1. Энергия связи
При образовании молекул из атомов энергия выделяется. Для того, чтобы разрушить молекулы, надо разорвать химические связи, т.е. затратить энергию.
Энергия связи – это количество энергии, которое выделяется при образовании моля связей из нейтральных невозбужденных газообразных атомов. Энергия связи является мерой прочности любой химической связи, чем больше энергия связи, тем прочнее связь. Энергия связи измеряется в эВ, ккал/моль или кДж/моль.
Например, Н + Н = Н2 , Носвязи = -435 кДж/моль Энтальпию химической связи можно вычислить, используя справочные
термодинамические данные.
2. Длина связи
Длина связи – это расстояние между ядрами атомов в молекуле, которое соответствует минимуму энергии. Длина связи всегда меньше, чем сумма радиусов взаимодействующих атомов. Чем прочнее связь, тем меньше расстояние между ядрами, тем меньше длина связи.
Например, длина связи в молекуле водорода составляет 0,074 нм.
3. Направленность химической связи
Поскольку электронные облака (кроме s) направлены в пространстве определенным образом, то и химические связи в молекулах, образуемые с их участием тоже направлены друг относительно друга под определенными углами, которые называются валентными углами.
Молекула SF2
Оценим валентные возможности атомов:
S … 3s23p4
F … 2s22p5
F … 2s22p5
У атома серы имеется две одноэлектронные валентные орбитали, следовательно, сера может образовать две связи по обменному механизму. В свою очередь, каждый атом фтора имеет по одной одноэлектронной орбитали, следовательно, каждый атом фтора способен образовать одну связь по обменному механизму. Таким образом, в молекуле образуется две ковалентные связи по обменному механизму при перекрывании р- орбиталей атома серы с р-орбиталями атомов фтора. Поскольку две р-орбитали атома серы направлены под углом 90º друг относительно друга, поэтому и образуемые ими связи будут направленны в пространстве под валентным углом 90º друг к другу. Форма молекулы уголковая (рис. 3).
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

S |
S |
F |
|
||
|
F |
90º |
|
|
|
|
F |
|
|
F |
|
Рис.3. Орбитальная диаграмма и валентная схема молекулы SF2
Аналогичную уголковую форму будут иметь другие молекулы (Н2S, H2Se), в которых центральный атом образует связи за счет двух р-орбиталей, направленных под углом 90º.
Молекула РН3 Аналогично рассмотренному примеру сначала оценим валентные возможности
атомов:
Р … 3s23p3 |
|
|
|
|
|
3 одноэлектронных орбитали |
||
|
|
3 |
связи по обменному механизму |
|||||
Н |
1s2 |
|
|
|
|
|
|
|
Н |
1s2 |
|
одноэлектронная орбиталь |
|||||
|
1 |
|||||||
|
|
1 |
связь по обменному механизму |
|||||
Н |
1s2 |
|
|
|
|
|
|
|
Следовательно, в молекуле РН3 три ковалентные связи, образованные перекрыванием трех р-орбиталей атомов фосфора с тремя s-орбиталями атомов водорода, с валентными углами между ними 90º. Такую же форму будут иметь и другие молекулы, в которых центральный атом образует связи за счет трех р-орбиталей, направленных под углом 90º. Геометрическая форма – треугольная пирамида. Орбитальная диаграмма представлена на рис. 4.
|
|
|
|
|
|
|
|
|
|
|
Р |
валентный угол 900 |
|||||||
|
Р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
Н |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
Н |
|
|
|
|
|
Н |
|||||||
|
Н |
Н |
|
Н |
|
|
|
|
|
||||||||||
|
Рис. 4. Орбитальная диаграмма и геометрическая форма молекулы РН3 |
||||||||||||||||||
Исполнитель: |
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Теория гибридизации.
Рассмотрим молекулу ВеСl2. Такие отдельные молекулы могут существовать только при повышенной температуре в виде пара.
Ве … 2s2
Неспаренных электронов у невозбужденного атома Ве нет, тем не менее молекула существует. Можно предположить, что при поглощении энергии происходит “распаривание электронов” и переход одного из них на ближайшую по энергии орбиталь. Затраты энергии на этот переход не должны превышать энергии связи, иначе связь не образуется.
Ве … 2s2
Причем, экспериментальные данные свидетельствуют о том, что обе связи абсолютно равноценны, значит и орбитали бериллия, образующие их должны быть равноценны, а валентный угол равен 180º, то есть молекула является линейной.
Для объяснения этих фактов была предложена теория о гибридизации атомных орбиталей. Гибридизация – это выравнивание валентных атомных орбиталей по форме и энергии. Гибридизация обеспечивает образование более прочных связей за счет более симметричного распределения электронной плотности в молекуле в целом.
Условия гибридизации:
1.В гибридизации могут участвовать любые близкие по энергии орбитали – одноэлекронные, двухэлектронные, пустые.
2.Гибридных орбиталей образуется столько же, сколько атомных орбиталей участвует в гибридизации.
3.Гибридные орбитали располагаются в пространстве симметрично, отталкиваясь на максимальные и, как правило, равные углы.
Таким образом, в атоме Ве после распаривания электронов происходит гибридизация атомных s- и р-орбиталей, в результате образуются две гибридные орбитали. Гибридные орбитали имеют форму несимметричной гантели и обозначаются буквой q. Такая гибридизация называется sp-гибридизайией.
Следовательно получим, что в молекуле ВеС12 образуется две связи при перекрывании q-орбиталей атома бериллия и р-орбиталей атомов С1. Валентный угол составляет 180º. Геометрическая форма молекулы линейная. Орбитальная диаграмма и валентная схема приведены на рис. 5.
Cl |
Ве |
Cl |
|
Cl |
|
Be |
|
Cl |
|
|
валентный угол 1800
Рис. 5. Орбитальная диаграмма и валентная схема молекулы BeCl2
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Молекула BF3
Центральный атом бора, находясь в основном энергетическом состоянии, имеет один неспаренный электрон на 2р подуровне и, следовательно, может образовать только одну связь по обменному механизму. Однако не очень большое энергетическое воздействие переводит атом бора в возбужденное состояние, и в этом состоянии он способен образовать три ковалентные связи.
В … 2s22р1 |
|
|
|
В* … 2s12р2 |
F … 2s22p5
F … 2s22p5
F … 2s22p5
В образовании ковалентных связей у атома бора будут принимать участие гибридные орбитали. Поскольку в гибридизации принимают участие одна s-орбиталь и две р- орбитали, то такую гибридизацию называют – sp2-гибридизацией. В результате гибридизации образуется три гибридные орбитали, которые располагаются в одной плоскости под углом 120º. Геометрическая форма называется – плоский треугольник. Орбитальная диаграмма приведена на рис. 6.
F
F
валентный угол 120º
B
B F 
 F
F
F
 F
F
Рис. 6. Орбитальная диаграмма и валентная схема молекулы BF3
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Молекула SiCl4
Прежде чем образуются химические связи в молекуле SiCl4, должен пройти процесс распаривания электронов в атоме кремния с 3s подуровня на 3р подуровень, и после гибридизации, полученные четыре гибридные орбитали, участвуют в формировании ковалентных связей с р-орбиталями атомов хлора. В гибридизации принимают участие одна s-орбиталь и три р-орбитали, следовательно, такая гибридизация называется – sp3- гибридизацией. Образовавшиеся четыре гибридные орбитали ориентированы в пространстве под углом 109,5º и молекула будет иметь тетраэдрическую форму. Орбитальная диаграмма и геометрическое строение молекулы приведены на рис. 7.
Si … 3s23р2 |
|
|
|
Si* … 3s13р3 |
Сl … 3s23p5
Cl … 3s23p5
Cl … 3s23p5
Cl … 3s23p5
Cl
валентный угол 109,5º
Cl
|
|
|
Si |
|
|
Si |
|
Cl |
|
Cl |
Cl |
|
Cl |
Cl |
|
|
|
Cl |
|
|
|
|
Рис. 7. Орбитальная диаграмма и геометрическая форма молекулы SiCl4
Рассмотренные примеры не охватывают всех типов гибридизации при описании химической связи. Например, теория гибридизации широко используется для описания химической связи в комплексных соединениях d-элементов, где встречается sp3d2- гибридизация, d2sp3-гибридизация, dsp2-гибридизация. В табл. 1 указана геометрическая форма простейших молекул в зависимости от условий образования химических связей.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
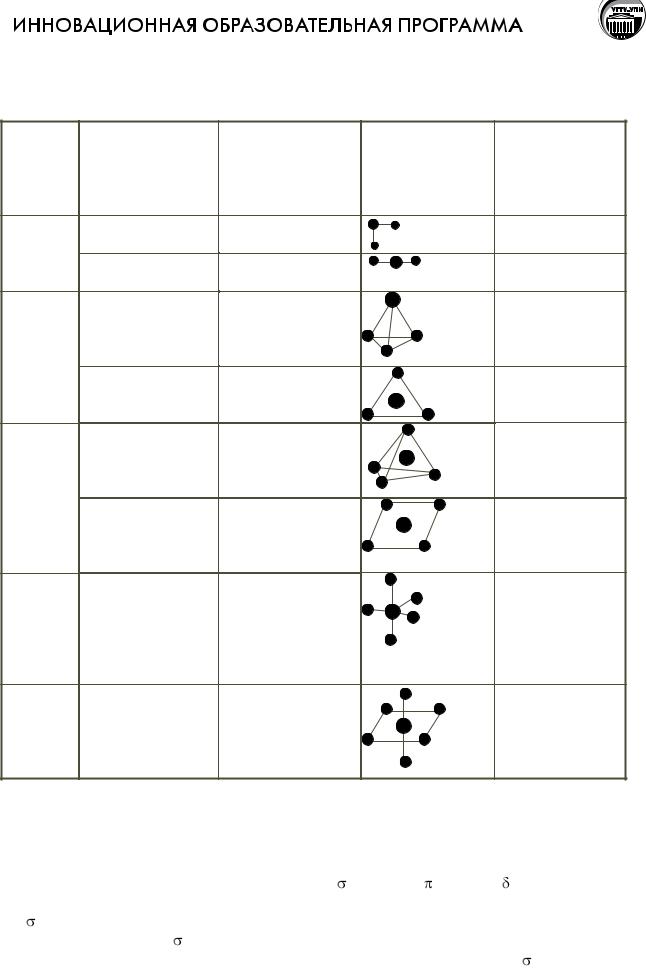
|
|
|
|
Таблица 1. |
|
Геометрическая форма простейших молекул |
|
||
Тип |
Тип гибридизации |
Тип орбиталей |
Геометрическая |
Примеры |
молекулы |
орбиталей |
центрального |
форма молекулы |
|
|
центрального |
атома, |
|
|
|
атома |
участвующих в |
|
|
|
|
образовании связи |
|
|
АВ2 |
нет |
р2 |
|
SF2, SCl2, H2S |
|
|
|
уголковая |
|
|
sp |
q2 |
|
BeCl2, ZnCl2 |
|
|
|
линейная |
|
АВ3 |
нет |
р3 |
|
PCl3, PH3, NCl3, |
|
|
|
треуг. |
AsH3 |
|
|
|
пирамида |
|
|
sp2 |
q3 |
плоский |
AlCl3, BF3 |
|
|
|
треуг. |
|
АВ4 |
sp3 |
q4 |
|
SiCl4, CH4, CF4, |
|
|
|
тетраэдр |
CCl4, NH4+, |
|
|
|
|
AlCl4- |
|
dsp2 |
q4 |
|
Ni(CN)42- |
|
|
|
плоский |
|
|
|
|
квадрат |
|
АВ5 |
sp3d |
q5 |
|
PCl5 |
|
|
|
треуг. |
|
|
|
|
бипирамида |
|
АВ6 |
sp3d2 |
q6 |
Октаэдр |
SF6, AlF63- |
|
d2sp3 |
|
|
|
4. Кратность связи
Поскольку электронные орбитали имеют различную форму, их взаимное перекрывание может осуществляться разными способами. В зависимости от способа
перекрывания атомных |
орбиталей различают - (сигма), |
- (пи) и - |
(дельта) |
связи |
|||||||||||||||
(последняя связь в данном курсе не рассматривается). |
|
|
|
|
|
|
|||||||||||||
-Связи осуществляются при перекрывании облаков вдоль линии соединения атомов |
|||||||||||||||||||
(перекрывание “в лоб”). |
-Связи могут образовываться перекрыванием любых орбиталей. |
||||||||||||||||||
Во всех выше приведенных примерах рассматривалось образование только |
-связей. |
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исполнитель: |
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

-Связи возникают при перекрывании электронных облаков по обе стороны от линии соединения атомов (боковое перекрывание) (рис. 8). -Связь менее прочная, чем -связь. В связи с геометрическими особенностями в образовании -связей не могут участвовать s- орбитали и гибридные орбитали.
а |
в |
с |
Рис.8. -Связь, образованная перекрыванием: а – р-р орбиталей, в – d-p орбиталей, с – d-d орбиталей.
Таким образом, между двумя атомами в молекуле может быть реализована однодвухили трехкратная связь. Согласно методу валентных связей, кратность связи – это число электронных пар, участвующих в образовании данной связи. Одинарная связь – всегда сигма-связь. В случае кратных связей – одна из них -связь, другие -связи.
Например, в молекуле азота образуется три химические связи – одна -связь и две
-связи.
N … 2s22p3
N … 2s22p3
На рис. 9 условно волнистыми линиями одного цвета показано образование двух -связей во взаимно перпендикулярных плоскостях при перекрывании соответствующих
р-орбиталей двух атомов азота.
N  N
N
Рис. 9. Орбитальная диаграмма и валентная схема молекулы N2
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Молекула С2Н4.
Атом углерода из основного состояния (…2s22p2) переходит в возбужденное (…2s12р3) и в результате образуется четыре валентные одноэлектронные орбитали. В молекуле С2Н4 каждый атом углерода образует четыре связи (рис. 10): три -связи и одну -связь, таким образом между двумя атомами углерода возникает двойная связь. У атомов углерода в образовании -связей участвуют гибридные орбитали, в образовании -связи в данном случае могут участвовать только р-орбитали. В результате у обоих атомов углерода реализуется sp2-гибридизация, так как по одной р-орбитали каждого атома углерода остаются на образование -связи. Орбитальная диаграмма молекулы представлена на рис. 10. Отметим, что молекула является плоской, а перекрывание р-орбиталей происходит в перпендикулярном направлении к этой плоскости.
С … 2s22р2 |
|
|
|
С* … 2s12р3 |
на -связь
H |
H |
C |
C |
H |
H |
H |
H |
|
C C |
H |
H |
Рис. 10. Валентная схема и орбитальная диаграмма молекулы С2Н4
5. Валентность. Насыщаемость.
Валентность (ковалентность) – число ковалентных связей, которые элемент образует в соединении или потенциально может образовать.
Насыщаемость – это способность атома взаимодействовать только с определенным числом атомов других элементов.
Число химических связей, которые может образовать каждый атом не безгранично. Оно определяется, во-первых, количеством валентных орбиталей (одноэлктронных, свободных, двуэлектронных), при этом в первую очередь реализуются одноэлектронные орбитали, затем свободные и двуэлектронные (чаще в конденсированном состоянии). Вовторых, доступностью валентных орбиталей для образования химических связей и конечными размерами взаимодействующих атомов.
Рассмотрим валентные возможности элементов в зависимости от местоположения в периодической системе.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 период
В первом периоде находится водород и имеет только одну валентную орбиталь (s-рбиталь), т.е. водород является одновалентным.
Н |
1s1 |
|
– может образовать одну ковалентную связь по обменному механизму |
Н+ |
1s0 |
|
– может образовать одну ковалентную связь по донорно-акцепторному |
|
|||
|
|
|
механизму, в качестве акцептора электронной пары. |
2 период
Элементы 2 периода имеют четыре валентные орбитали (одну s- и три р-) на внешнем
слое и, следовательно, могут образовать максимально 4 связи:
[BF4]-, CH4, [NH4]+, [H2O]n (лед).
Рассмотрим несколько примеров.
Бериллий |
|
Ве … 2s2 |
Ве* … 2s12р1 |
Атом бериллия имеет две одноэлектронные орбитали и две свободные орбитали, т.е максимально может образовать две ковалентные связи по обменному механизму и две ковалентные связи по донорно-акцепторному механизму. То есть максимальная валентность равна четырем.
BeCl2 |
(газ) |
Cl – Be – Cl |
|
|
|
|
|
|
|
Сl |
Сl |
Be |
Сl |
|
Сl |
BeCl2 |
(крист) |
… |
Be |
Сl |
Сl |
Be |
… |
|
|
||||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
n |
Углерод |
|
|
|
|
|
|
|
С … 2s22р2 |
|
|
С* … 2s12р3 |
|
|
||
Атом углерода практически во всех соединениях образует связи, находясь в возбужденном состоянии и имея четыре одноэлектронные орбитали, то есть максимальная валентность атома углерода также равна четырем. Причем, если реализуются все валентные возможности атома углерода, то возможны следующие сочетания одинарных и кратных связей, образованных атомами углерода, и соответствующая им гибридизация атомных орбиталей.
|
C |
|
C |
|
|
|
C |
|
|
|
C |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
sp3 – гибр. |
sp2 – гибр. |
|
|
|
|
sp – гибр. |
||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Кислород
О … 2s22p4
Атом кислорода имеет две одноэлектронные орбитали, следовательно, может образовать две связи по обменному механизму. Именно двух валентное состояние наиболее характерно для атома кислорода. В этом случае обязательно образуются либо две одинарные связи, либо одна двойная связь.
О или О  Помимо этого, атом кислорода, переходя в возбужденное состояние, спаривает электроны,
Помимо этого, атом кислорода, переходя в возбужденное состояние, спаривает электроны,
при этом образуется одна свободная орбиталь и атом кислорода, выступая в качестве акцептора электронной пары, может образовывать одну связь по донорно-акцепторному механизму. В этом случае валентность атома кислорода равна одному.
О … 2s22p4 |
|
|
|
О* … 2s22p4 |
О*
Существуют состояния, в которых кислород реализует свою максимально возможную валентность. Примером может служить вода в кристаллическом состоянии. Лед имеет валентную схему, приведенную на рис. 11. Атом кислорода находится в состоянии sp3- гибридизации, поэтому лед имеет тетраэдрическую структуру.
H |
H |
H |
H |
O |
O |
O |
|
|
H |
H |
|
… O |
|
O |
… |
Рис. 11. Структура льда
3 период
Элементы 3 периода имеют 9 валентных орбиталей (одну s- , три р- и пять d-орбиталей), но практически образуют не более шести связей, с участием одной s-, трех р- и двух d-орбиталей: [AlF6]3-, [SiF6]2-, PCl5, SF6.
Число связей больше шести возможно у некоторых элементов, но это довольно редкое явление.
4 период
Элементы 4 периода максимально имеют валентность не более четырех:
AsO43-, SeO42-, BrO4-.
5 период
Элементы 5 периода максимально имеют валентность не более шести:
Sb(OH)6-, TeO66-, IO65-.
Координационное число – число ближайших соседних частиц данного элемента. Максимальное координационное число численно равно максимальной валентности. Если
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

в соединении координационное число и валентность максимальны, то состояние атома называется валентно и координационно насыщенным. Например, в молекуле СН4 валентность и координационное число атома углерода равны четырем – это координационно и валентно насыщенное соединение. В молекуле С2Н4 валентность атома углерода равна четырем, а координационное число равно трем – это валентно насыщенное и координационно ненасыщенное соединение. А если взять молекулу аммиака NH3, в которой у атома азота валентность и координационное число равны трем, то это соединение является ни валентно ни координационно ненасыщенным.
Правила составления валентных схем
1.Оценить валентные возможности всех атомов в данном соединении, сначала в невозбужденном состоянии.
2.Учесть, что наиболее энергетически выгодна восьми электронная конфигурация – правило октета.
Например, S … 3s23p4
Находясь в основном энергетическом состоянии, атом серы может потенциально образовать две связи по обменному механизму и две связи по донорно-акцепторному механизму:
 S
S
В этом случае сера окружает себя энергетически устойчивой восьми электронной структурой.
Напротив, для перевода атома серы в возбужденное состояние, которое характеризуется
электронной конфигурацией S* … 3s13p33d2 |
|
|
|
|
|
|
|
|
|
|
|
, |
требуются некоторые энергетические затраты, которые не всегда могут быть скомпенсированы за счет образования химических связей. Поэтому данное состояние атома серы является энергетически менее выгодным.
3.В молекулах оксидов атомы кислорода соединяются друг с другом через оксидообразующий элемент. Исключение составляют пероксидные соединения, в которых атомы кислорода непосредственно связаны друг с другом. Например, пероксид водорода Н2О2 имеет структуру Н – О – О – Н.
4.В молекулах кислот водород всегда присоединяется к кислотообразующему элементу через атом кислорода. Существуют исключения, например фосфористая кислота
Н3РО3, в молекуле, которой один атом водорода непосредственно связан с атом фосфора. Поэтому данная кислота является двухосновной.
НО  Р
Р О*
О*
НО Н
5.Атом кислорода образует либо две связи по обменному механизму (одна двойная или две одинарных), либо одну связь по донорно-акцепторному механизму, если находится в возбужденном состоянии.
6.Атом углерода образует четыре связи по обменному механизму.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

6. Полярность связи. Полярность молекул.
Если ковалентная связь образована атомами одного элемента, то область повышенной электронной плотности находится на одинаковом расстоянии от ядер атомов. Такая связь называется неполярной или гомеополярной: H – H, F – F, N N и др.
Если ковалентная связь образована атомами различных элементов, то область повышенной электронной плотности будет смещена к атому с наибольшей электроотрицательностью. При этом один из атомов приобретает некоторый отрицательный заряд, а другой – положительный. В этом случае говорят о полярной
ковалентной связи. |
|
|
|
Например: |
H |
Cl |
|
|
+ |
- |
= 0,17 от заряда электрона |
Система из двух равных, но противоположных по знаку зарядов, расположенных на некотором расстоянии, называется диполем. Величина дипольного момента может служить мерой полярности связи. Чем больше дипольный момент, тем полярнее связь. Дипольный момент – векторная величина. Он рассчитывается по формуле = L, где L – длина диполя. Условно принято направление вектора дипольного момента от положительного конца диполя к отрицательному. Дипольный момент молекул измеряют в дебаях [D]и [Кл м]. 1 D = 3,33 10-30 Кл м.
Крайний случай полярной связи – ионная связь, когда пара электронов на 90% принадлежит атому с наибольшей электроотрицательностью.
Полярность связи в молекулах вещества в значительной степени определяет его физико-химические свойства. Так, соединения ковалентного типа (с малополярными связями) характеризуются слабой связью между молекулами в веществе. Поэтому ковалентные соединения имеют низкие температуры плавления, кипения, летучи, плохо растворяются в воде, хорошо растворяются в неполярных растворителях. Это углеводороды, галогениды, оксиды, сульфиды неметаллов и переходных металлов. Напротив, соединения с сильно полярными связями имеют высокие температуры плавления, кипения, малолетучи, плохо растворяются в неполярных растворителях, их растворы в воде электропроводны. Это большинство солей, которые имеют ионные кристаллические решетки.
Если молекула обладает собственным постоянным дипольным моментом  , то такая молекула полярна (является диполем). Если суммарный дипольный момент молекулы равен нулю
, то такая молекула полярна (является диполем). Если суммарный дипольный момент молекулы равен нулю  , то молекула неполярна, электросимметрична.
, то молекула неполярна, электросимметрична.
Для двухатомных молекул полярность связи определяет полярность молекулы в целом.
Для молекул с числом атомов три и более полярность зависит не только от полярности каждой связи, но и от их взаимной направленности в пространстве, т.е. геометрии молекул.
Рассмотрим молекулы SF2 и ВF3. Вспомним их валентные схемы, геометрическую форму (рис. 12), оценим полярность связей, определим направление векторов дипольных моментов, составим векторную диаграмму каждой молекулы. Найдем суммарный векторный момент.
Фтор более электроотрицательный элемент, поэтому область повышенной электронной плотности смещена именно к атому фтора, и он приобретает некоторый отрицательный заряд, тогда дипольный момент каждой связи направлен от атома серы или бора к атому фтора.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Молекула SF2 является уголковой и векторная сумма дипольных моментов двух связей отличается от нуля; такая молекула обладает дипольным моментом и является полярной (рис.12). В молекуле BF3 все связи направлены под одинаковыми углами (120º), а дипольные моменты равны по модулю, следовательно, суммарны дипольный момент такой молекулы будет равен нулю, а молекула является неполярной (рис.12).
|
|
|
|
F |
|
|
|
S |
|
|
|
|
|
||
|
F |
|
|
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
|
|
|
= 0 |
|
|
|
|
|
|||||
|
|
0 |
|
|
|
|
|
|
|
|
|
|
F |
||
|
F |
F |
|
||||
|
|
|
|
|
|
|
|
Рис. 12. Дипольные моменты отдельных связей и молекул SF2 |
и BF3 в целом. |
||||||
Пользуясь представлениями об электроотрицательности элементов, можно дать количественную оценку состояния атома в соединении в виде так называемой степени окисления. Под степенью окисления условно понимают тот заряд, который получился бы у атома, если все ковалентные связи разорвать с учетом их полярности. Согласно этому представлению значение положительной степени окисления элемента соответствует числу оттянутых от атома связывающих электронных пар, а значение отрицательной степени окисления – числу притянутых электронных пар.
При пользовании степенями окисления полезно придерживаться следующих правил:
1.в целом молекулы электронейтральны. Следовательно, степень окисления элемента
вего простом веществе (состоящем из одного сора атомов) равна нулю.
2.в соединениях фтор всегда проявляет степень окисления (-1).
3.степень окисления кислорода в соединениях обычно (-2) (кроме OF2, H2O2 и других пероксидов).
4.степень окисления водорода обычно (+1) (кроме гидридов металлов).
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
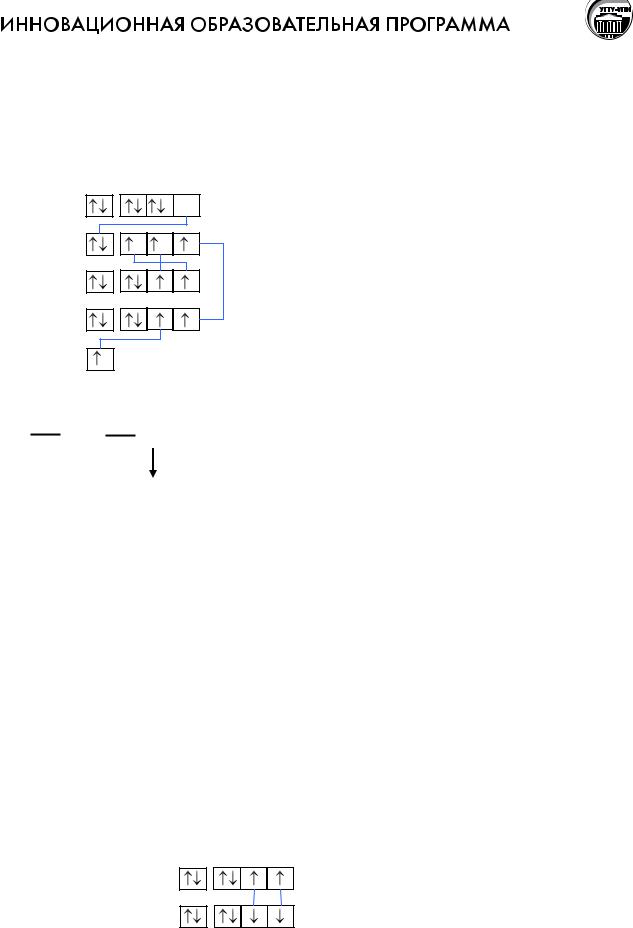
В заключение приведем пример молекулы HNO3, для которой составим валентную схему, определим валентность и степени окисления всех атомов. Атом азота может образовать четыре связи, так как имеет только четыре валентные орбитали. В данном соединении атом азота образует одну одинарную связь по обменному механизму, одну двойную связь по обменному механизму и одну связь по донорно-акцепторному механизму с атомом кислорода-акцептора (рис. 13).
O* … 2s22p4
N … 2s22p3
O … 2s22p4
O … 2s22p4
H 1s1
H O N  O
O
O*
Элемент |
Валентность |
Степень |
|
|
окисления |
|
|
|
N |
4 |
+5 |
|
|
|
O |
2 |
-2 |
|
|
|
O |
2 |
-2 |
|
|
|
O* |
1 |
-2 |
|
|
|
H |
1 |
+1 |
|
|
|
Заключение
Рассмотренный метод валентных связей, несомненно, имеет ряд достоинств. Метод позволяет понять способность атомов к образованию определенного числа ковалентных связей, объясняет направленность ковалентной связи, дает удовлетворительное описание структуры и свойств большого числа молекул. Однако свойства некоторых молекул метод валентных связей объяснить не в состоянии или приводит к неверным заключениям о свойствах молекул.
Приведем несколько примеров.
1.Метод валентных связей не дает удовлетворительного объяснения существованию молекулярного иона водорода H2+ , хотя существование этого иона установлено уже достаточно давно. Согласно методу ВС, связь осуществляется общей электронной парой, а в состав данной частицы входит всего один электрон.
2.Согласно методу ВС, молекула кислорода О2 образуется вследствие возникновения двух общих электронных пар:
O … 2s22p4
O … 2s22p4
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

В результате образования двух общих электронных пар в молекуле кислорода не остается неспаренных электронов, однако данная молекула является парамагнитной, и экспериментальные данные свидетельствуют о том, что в молекуле имеются два неспаренных электрона. Именно неспаренные электроны ответственны за наличие магнитных свойств вещества, если неспаренных электронов нет, то молекула является диамагнитной, то есть не создает собственного магнитного поля, поскольку магнитные поля, образованные двумя спаренными электронами, взаимно компенсируют друг друга.
3. Молекула NO в соответствии с методом ВС должна иметь следующую структуру:
N … 2s22p3
O … 2s22p4
То есть в молекуле имеется один неспаренный электрон, следовательно, молекула является радикалом и должна обладать реакционной активностью. Однако данная молекула даже не образует димеров.
Приведенные примеры и многие другие говорят о том, что представления о двухцентровых связях нельзя применить для объяснения строения многих молекул. Более общим и универсальным методом является друга квантово-механическая теория, которая получила название метод молекулярных орбиталей.
Метод молекулярных орбиталей
Метод молекулярных орбиталей (МО), как и метод валентных связей, является приближенным. Для молекул, к которым применим метод ВС, а метод МО дает аналогичные результаты, обычно применяют метод ВС, так как он наглядней. Метод МО является более общим по сравнению с методом ВС; он менее нагляден, но позволяет описывать строения и физические свойства молекул тех соединений, которые не могут быть описаны по методу ВС.
Согласно теории молекулярных орбиталей молекула рассматривается как совокупность ядер и электронов, где каждый электрон движется в поле всех ядер и остальных электронов. Теория МО считает, что как в атоме существуют области наиболее вероятного нахождения электронов, которые называются атомными орбиталями, так и в молекуле существуют области наиболее вероятного местонахождения электронов, которые называются молекулярными орбиталями. Молекулярная орбиталь, так же как и атомная, описывается волновой функцией .
Молекулярные орбитали можно представить как результат комбинации орбиталей атомов, образующих молекулу. Одним из методов комбинации атомных орбиталей является метод линейной комбинации атомных орбиталей (ЛКАО). Согласно методу МО ЛКАО молекулярные орбитали получаются путем сложения или вычитания волновых функций атомных орбиталей. При сложении атомных орбиталей образуется связывающая молекулярная орбиталь, при вычитании – разрыхляющая молекулярная орбиталь.
Например, для образования молекулы АВ из атомов А и В математически это можно записать так:
образование связывающей молекулярной орбитали: |
АВ |
|
|
А |
c j |
В |
|||||||||||||||
МО |
сi АО |
АО |
|||||||||||||||||||
образование разрыхляющей молекулярной орбитали: |
|
АВ |
|
|
А |
c j |
В |
||||||||||||||
|
МО |
|
сi АО |
АО |
|||||||||||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

где, |
АВ |
|
МО |
||
|
А
АО
В
АО
– молекулярная орбиталь
–атомная орбиталь атома А;
–атомная орбиталь атома В.
Коэффициенты сi и сj учитывают вклад атомных орбиталей в формирование молекулярных орбиталей, их ищут специальными математическими методами. Для упрощения будем считать эти коэффициенты равными 1.
Связывающая молекулярная орбиталь характеризуется повышенной электронной плотностью в пространстве между ядрами, и поэтому нахождение электронов на связывающих МО приводит к упрочению химической связи, возрастанию энергии связи, уменьшению длины связи.
В разрыхляющей молекулярной орбитали электронная плотность концентрируется за ядрами, а между ними она равна нулю. Нахождение электронов на разрыхляющих МО приводит к ослаблению химической связи, уменьшению энергии связи, увеличению межъядерного расстояния.
Следует учитывать, что атомные орбитали могут комбинироваться с образованием устойчивых молекулярных орбиталей только в том случае, если их энергии близки и перекрывание возможно в заметной степени. То есть если орбитали имеют различную ориентацию в пространстве, например, рx, py, pz, то в линейной комбинации будут участвовать одинаково ориентированные орбитали рx–рx, py–py, pz–pz. Также в образовании молекулярной орбитали могут принимать участи электроны в s-состоянии и рz-состоянии (ось z совпадает с осью соединения ядер атомов).
Обозначение молекулярных орбиталей определяется тем, какие атомные орбитали участвуют в образовании молекулярных (табл. 2).
|
|
|
Таблица 2. |
|
|
|
Обозначение молекулярных орбиталей |
||
АО, участвующие в |
Обозначение МО |
Связывающие свойства |
|
|
|
образовании МО |
|
|
|
1s |
+ 1s |
1s |
связывающая |
|
1s |
– 1s |
1s* |
разрыхляющая |
|
2s |
+ 2s |
2s |
связывающая |
|
2s |
– 2s |
2s* |
разрыхляющая |
|
2рz – 2рz |
2pz |
связывающая |
|
|
2рz + 2рz |
2pz* |
разрыхляющая |
|
|
2рх + 2рх |
2pх |
связывающая |
|
|
2рх – 2рх |
2pх* |
разрыхляющая |
|
|
2рy + 2рy |
2py |
связывающая |
|
|
2рy – 2рy |
2py* |
разрыхляющая |
|
|
Суммируем основные положения метода МО ЛКАО:
 Молекула рассматривается как единый коллектив электронов и ядер;
Молекула рассматривается как единый коллектив электронов и ядер;  Электроны занимают молекулярные орбитали, которые охватывают всю молекулу, то есть являются многоцентровыми;
Электроны занимают молекулярные орбитали, которые охватывают всю молекулу, то есть являются многоцентровыми;
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

 Молекулярные орбитали можно представить как линейную комбинацию атомных орбиталей, в результате которой образуются связывающие и разрыхляющие орбитали. Число образующихся молекулярных орбиталей равно общему числу атомных орбиталей, из которых комбинируются МО;
Молекулярные орбитали можно представить как линейную комбинацию атомных орбиталей, в результате которой образуются связывающие и разрыхляющие орбитали. Число образующихся молекулярных орбиталей равно общему числу атомных орбиталей, из которых комбинируются МО;
 В линейной комбинации могут участвовать только электроны близкие по энергетическому состоянию и если перекрывание атомных орбиталей геометрически возможно в заметной степени;
В линейной комбинации могут участвовать только электроны близкие по энергетическому состоянию и если перекрывание атомных орбиталей геометрически возможно в заметной степени;  Заполнение МО электронами происходит по тем же правилам, что и для атомных
Заполнение МО электронами происходит по тем же правилам, что и для атомных
орбиталей: принцип минимума энергии, принцип Паули, правило Гунда;
Молекула водорода Н2
При образовании молекулы водорода в образовании молекулярных орбиталей будут участвовать 1s орбиталь одного атома и 1s орбиталь второго атома. При этом образуются связывающая молекулярная орбиталь 1s, которая характеризуется повышенной электронной плотностью в межъядерном пространстве (рис. 13) и разрыхляющая молекулярная орбиталь 1s*, в которой электронная плотность концентрируется за ядрами
(рис. 13).
|
|
1s – связывающая |
|
+ |
|
|
– |
|
1s |
1s |
1s* – разрыхляющая |
|
||
Н |
Н |
Н2 |
Рис. 13. Образование связывающей и разрыхляющей молекулярных орбиталей атома водорода
Образование молекулярных орбиталей из атомных обычно изображают в виде энергетической диаграммы, где по вертикали откладывают значения энергии Е орбиталей. Слева и справа на диаграмме показывают энергетические уровни атомных орбиталей, в середине – энергетические уровни молекулярных орбиталей. Причем, из решения уравнения Шредингера следует, что энергия связывающей орбитали ниже, чем энергия соответствующей разрыхляющей орбитали. Для молекулы водорода Н2 и молекулярных ионов Н2+ и Н2– на рис.14 приведены энергетические диаграммы, на которых также указано размещение электронов на атомных и молекулярных орбиталях. Как видно, существование молекулярного иона Н2+ объясняется тем, что на связывающей орбитали находится один общий электрон.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
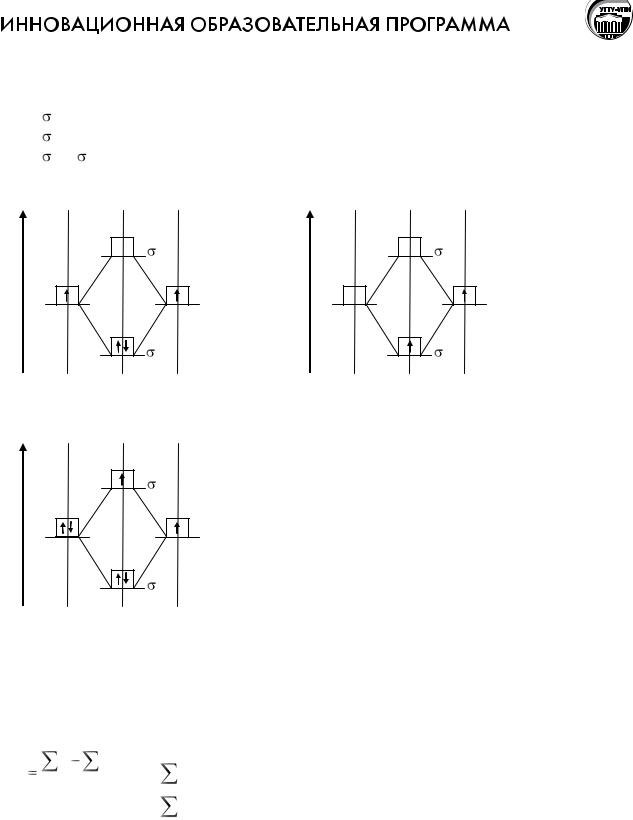
Электронные конфигурации для данных частиц будут выглядеть следующим образом (верхний индекс указывает число электронов на молекулярной орбитали):
Н2 ( 1s)2 Н2+( 1s)1
Н2– ( 1s)2( 1s*)1.
а) |
|
|
Н |
Н2 |
Н |
б) |
|
Н+ |
Н2+ |
|
Н |
||||||||
Е |
|
|
|
|
|
|
|
|
|
|
Е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1s* |
|
|
|
|
|
|
1s* |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1s |
|
|
|
|
|
|
|
|
1s |
|
1s |
|
|
|
|
|
|
1s |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
1s |
|
|
|
|
|
|
|
|
|
1s |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
АО |
МО |
АО |
|
|
АО |
МО |
|
АО |
||||||||
в) |
|
|
Н– |
Н2– |
Н |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1s* |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
1s |
|
|
|
|
1s |
|
|
1s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
АО |
МО |
АО |
|
|
|
|
|
|
|
|
|
|||||
Рис.14. Энергетическая диаграмма молекулы Н2 (а), молекулярного иона Н2+ (б) и молекулярного иона Н2– (в)
В методе МО ЛКАО порядок связи (n) определяется числом электронов на связывающих и разрыхляющих орбиталях соотношением:
n |
e |
e * |
, где |
e – суммарное число электронов на связывающих орбиталях, |
|
|
2 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
e * – суммарное число электронов на разрыхляющих орбиталях. |
В отличие от кратности связи в методе ВС, порядок связи в методе МО может быть дробным числом. Если суммарное число электронов на связывающих орбиталях равно общему числу электронов на разрыхляющих орбиталях, то порядок связи равен нулю, это говорит о том, что молекула является энергетически неустойчивой и не образуется.
Так в молекуле водорода Н2 согласно методу МО порядок связи n = 1, и, если проводить аналогию с методом ВС, это соответствует одинарной связи. В молекулярных ионах Н2+ и Н2– порядок связи n = ½.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Если обратиться к другому элементу первого периода, гелию, то можно увидеть, что гипотетическая молекула Не2 ( 1s)2( 1s*)2 должна быть энергетически неустойчивой, так как два электрона занимают связывающую орбиталь, а два других – разрыхляющую и n = 0. Действительно молекулы Не2 в основном энергетическом состоянии экспериментально не обнаружены, в отличие от молекулярного иона Не2+ ( 1s)2( 1s*)1, у которого связывающих электронов на единицу больше, чем разрыхляющих.
Гомоядерные молекулы, образованные атомами II периода
При рассмотрении молекул, образованных атомами II периода можно считать, что молекулярные орбитали ( 1s) и ( 1s*) не вносят вклада в энергию связи молекулы, и электроны, приписанные к этим орбиталям, сохраняют в молекуле характер атомных K- электронов и принадлежат соответствующим ядрам (K-остов). Поэтому в энергетических диаграммах данные МО не указаны, а в электронных конфигурациях молекул обозначены символом K. Электронные конфигурации и некоторые свойства молекул приведены в табл. 3.
Таблица 3 Электронные конфигурации и молекулярные характеристики двухатомных молекул,
образованных элементами второго периода
Молекула |
|
Электронная конфигурация |
|
Порядок |
Магнитные |
Примечания |
||
|
|
|
|
|
|
связи n |
свойства |
|
Li2 |
KK ( 2s)2 |
|
|
|
1 |
Диамагн. |
Одинарная связь |
|
Be2 |
KK ( 2s)2 ( 2s*)2 |
|
|
|
0 |
- |
Связь не образуется |
|
B2 |
[Be2] ( 2pх)1 ( 2py)1 |
|
|
|
1 |
Парамагн. |
Одинарная связь |
|
C2 |
[Be2] ( 2pх)2 ( 2py)2 |
|
|
|
2 |
Диамагн. |
Двойная связь |
|
N2 |
[Be2] ( 2pх)2 ( 2py)2 ( |
2pz)2 |
|
|
3 |
Диамагн. |
Тройная связь |
|
O2 |
[Be2] ( |
2pz)2 ( 2pх)2 ( 2py)2 |
( 2pх*)1 |
( 2py*)1 |
2 |
Парамагн. |
Двойная связь |
|
F2 |
[Be2] ( |
2pz)2 ( 2pх)2 ( |
2py)2 |
( 2pх*)2 |
( 2py*)2 |
1 |
Диамагн. |
Одинарная связь |
[Be2] – электронная конфигурация гипотетической молекулы Ве2
Энергетические диаграммы двухатомных молекул р-элементов начала второго периода (В2, С2, N2) приведены на рис. 15а, распределение электронов по МО указано для молекулы азота.
Энергетические диаграммы двухатомных молекул р-элементов конца второго периода (О2, F2) приведены на рис. 15б, распределение электронов по МО указано для молекулы кислорода.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
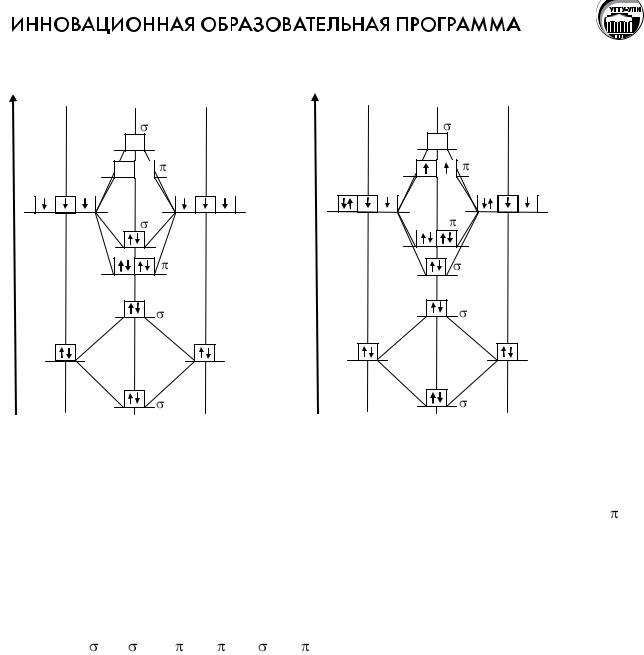
а) |
|
|
|
|
б) |
|
|
|
Е |
N |
N2 |
N |
|
Е |
O |
O2 |
O |
|
|
|
|
|
|
|
||
|
|
|
2p* |
|
|
|
2p* |
|
|
|
|
2p |
|
|
|
2p |
|
|
|
|
* |
|
|
|
* |
|
2 |
|
|
2p |
2 |
2 |
|
2p |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
2p |
|
|
|
2p |
|
|
|
|
2s* |
|
|
|
2s* |
|
|
2s |
|
2s |
|
|
|
|
2s |
|
|
|
2s |
|
|
|
2s |
|
|
АО |
МО |
АО |
|
|
АО |
МО |
АО |
Рис. 15. Энергетические диаграммы гомоядерных молекул II периода: а) молекула N2; б) молекула О2.
Как видно метод МО объясняет парамагнитные свойства молекулы кислорода (рис. 15 б), в которой два неспаренных электрона находятся на разрыхляющих - орбиталях. До этой теории считали все электроны в молекуле О2 спаренными.
Гетероядерные молекулы
Примером молекул, образованных их двух различных атомов, может служить молекула NO (рис. 16):
NO [KK ( 2s)2 ( 2s*)2 ( 2pх)2 ( 2py)2 ( 2pz)2 ( 2pх*)1].
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
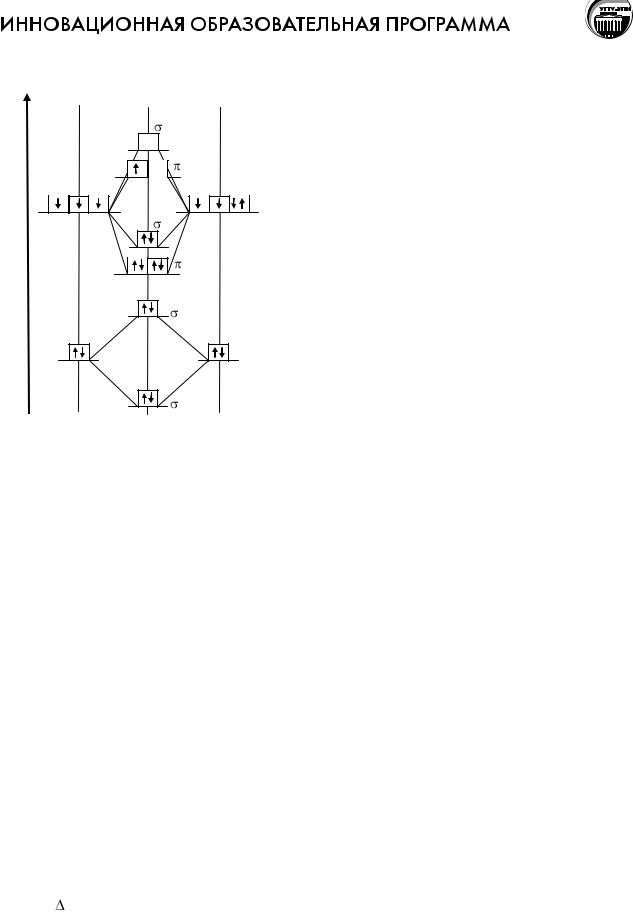
Е |
N |
NО |
|
О |
|
|
|
|
|
|
|
|
2p* |
|
|
|
|
2p |
|
|
|
|
* |
|
2 |
|
|
2p |
2 |
|
|
|
|
|
|
|
|
2p |
|
|
|
|
2s* |
|
|
2s |
|
|
2s |
|
|
|
2s |
|
|
АО |
МО |
АО |
|
Рис. 16 Энергетическая диаграмма молекулы NO
Число избыточных связующих электронов в NO равно 5, кратность связи n = 2,5 – связь промежуточная между двойной и тройной.
Метод МО находит очень широкое применение, т.к. дает самый общий подход ко всем типам химических соединений. Он позволяет объяснить многие свойства молекул: прочность связи, магнитные свойства, окраску веществ и др. Но, теория мало наглядна и требует использования сложного математического аппарата.
Ионная связь
Ионная связь осуществляется в результате электростатического взаимодействия противоположно заряженных ионов, электрическое поле которых имеет сферическую симметрию, равномерно распределяется в пространстве и не обладает направленностью. При образовании связи между двумя противоположно заряженными ионами сохраняется возможность электростатического взаимодействия и с другими ионами, проявляется ненасыщаемость связи. Таким образом, в отличие от ковалентной связи, ионная связь является ненаправленной и ненасыщаемой.
Подразделение веществ на ковалентные и ионные относительно, так как даже в галогенидах щелочных металлов нет полного перехода электрона (смешения электронной плотности) от атомов металлов к атомам галогенов. Например, в молекуле NaCl эффективный заряд ионов составляет 0,94 заряда электрона. Ионная связь – предельный случай ковалентной полярной связи. Когда разность в электроотрицательности атомов велика ( ОЭО > 1,8 ед.), то общая электронная пара практически полностью принадлежит атому с большим значением электроотрицательности, тогда и можно говорить об ионной связи.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Ионные соединения при обычных условиях являются кристаллическими веществами. В узлах кристаллической решетки находятся положительно и отрицательно заряженные ионы.
 ион хлора Cl-
ион хлора Cl-
 ион натрия Na+
ион натрия Na+
к.ч. = 6
Рис. 17. Кристаллическая решетка хлорида натрия NaCl
Данный тип решеток характерен для солей, гидридов, карбидов, нитридов, оксидов активных металлов.
Соединения с ионными кристаллическими решетками имеют высокие температуры плавления и кипения.
Металлическая связь. Металлическая кристаллическая решетка.
Кристаллические решетки, которые образуют металлы, называются металлическими. В их узлах находятся положительные ионы металлов, связь между которыми осуществляется коллективом валентных электронов, относительно свободно перемещающихся по кристаллу. Такая связь получила название металлической связи. Металлическая связь – это нелокализованная ненаправленная химическая связь. Металлическая связь обуславливает такие свойства металлов, как электропроводность, теплопроводность, ковкость, пластичность. Свободные электроны практически полностью поглощают свет, но также частично его отражают, поэтому кристаллы металлов непрозрачны и имеют характерный металлический блеск.
Для металлических решеток характерны высокие координационные числа; большинство металлов кристаллизуется в структурах плотнейших упаковок – гексагональной и гранецентрированной кубической решеток с координационным числом 12, кубической объемно центрированной с координационным числом 8.
Для описания металлической связи как единого коллектива взаимодействующих частиц в твердом теле применяют зонную теорию кристаллов – частный случай метода молекулярных орбиталей.
Согласно теории молекулярных орбиталей при взаимодействии двух атомов происходит перекрывание атомных орбиталей с образованием связывающей и разрыхляющей молекулярных орбиталей. Если рассматривать систему из четырех атомов, каждый из которых предоставляет атомную орбиталь на образование молекулярных орбиталей, то соответственно образуется 4 связывающих и 4 разрыхляющих орбитали. В свою очередь металлическая кристаллическая решетка представляет собой коллектив весьма большого числа атомов, соответственно образуется большое число молекулярных орбиталей. Соседние уровни настолько мало различаются по энергии, что образуются практически непрерывные энергетические зоны. Совокупность энергетических уровней занятых валентными электронами называется валентной зоной. Остальные уровни остаются незаполненными, и образуют зону проводимости. Для металлических
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кристаллических решеток характероно перекрывание этих двух зон (рис. 18), вследствие чего валентные электроны достаточно легко переходят в зону проводимости, то есть ведут себя как «свободные» электроны. Вследствие делокализованности орбиталей валентные электроны могут перемещаться по кристаллу при сколь угодно малых энергетических воздействиях. Это и создает возможность, например, переноса тока электронами – обеспечивает электропроводность металла и другие свойства металла.
|
|
ЗП |
|
ЗП |
|
ЗП |
|
|
|
|
|
|
|
|
|
Е |
ЗЗ |
Е |
ЗЗ |
|
|
|
||
|
ВЗ |
ВЗ |
|
ВЗ |
|
|
|
||
а |
б |
|
в |
|
Рис. 18 Схема расположения энергетических зон в металле (а), диэлектрике (б), полупроводнике (в): ВЗ – валентная зона, ЗП – зона проводимости, ЗЗ – запрещенная зона
В отличие от металлов кристаллы простых веществ, образованных неметаллами, обычно не обладают заметной электронной проводимостью; они представляют собой диэлектрики. Хотя в этом случае тоже возможно образование энергетических зон, но здесь зона проводимости отделена от валентной зоны запрещенной зоной, то есть значительным энергетическим промежутком Е (рис. 18). Энергия теплового движения или слабого электрического поля оказывается недостаточной для преодоления этого промежутка, и электроны не переходят из валентной зоны в зону проводимости. Таким образом, в диэлектриках электроны не могут свободно перемещаться по кристаллу и служить переносчиками электрического тока.
Особыми свойствами, отличающими их как от металлов, так и от диэлектриков, обладают полупроводники. Здесь, как у и диэлектриков, валентная зона отделена от зоны проводимости запрещенной зоной Е (рис. 18). Однако ширина запрещенной зоны в случае полупроводников невелика. Поэтому при энергетическом воздействии (энергия квантов, тепловая энергия) электроны, занимающие верхние уровни валентной зоны, могут переходить в зону проводимости и участвовать в переносе электрического тока, обеспечивая так называемую электронную проводимость полупроводника. При этом в валентной зоне возникают неполностью занятые электронами энергетические уровни – электронные вакансии или «дырки». В электрическом поле такие «дырки» ведут себя как положительные электрические заряды, обеспечивая так называемую дырочную проводимость полупроводника. Электронная и дырочная проводимость сильно зависит от наличия в полупроводнике примесей. Кроме того регулируя количество той или иной примеси можно добивать преобладания электронной или наоборот дырочной проводимости.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Водородная связь
Водородная связь – связь через атомы водорода сильно электроотрицательных атомов, имеющих очень малые радиусы (F, O, N).
В качестве примера рассмотрим молекулу HF. Возникновение водородной связи в первом приближении можно объяснить действием электростатических сил. При образовании ковалентной полярной связи между атомом водорода и атомом фтора, характеризующимся высокой электроотрицательностью, область повышенной электронной плотности сильно смешается к атому фтора. В результате атом фтора приобретает значительный эффективный отрицательный заряд, а ядро атома водорода (протон) почти лишается электронной оболочки. Между протоном атома водорода и отрицательно заряженным атомом фтора соседней молекулы HF возникает электростатическое притяжение, что и приводит к образованию водородной связи. Это объясняется тем, что обладая ничтожно малыми размерами и не имея внутренних электронных слоев, ион водорода способен проникать в электронные оболчки других атомов.
Схема образования водородной связи при взаимодействии двух молекул HF (пунктиром обозначена водородная связь):
F
H |
|
F + H F H |
H |
|
F
Помимо электростатического взаимодействия механизмом образования водородной связи может явиться также донорно-акцепторное взаимодействие. Но, как правило, при образовании водородной связи реализуются одновременно оба механизма.
Водородные связи могут образовываться также между молекулами различных веществ, например, между молекулами аммиака и молекулами воды, что объясняет хорошую растворимость аммиака в воде. Кроме того водородная связь может образоваться и внутри молекулы, если молекула особым образом ориентирована в пространстве:
О
С
О Н Энергия водородной связи значительно меньше энергии ковалентной связи. Однако
этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры, которые в ряде случаев существуют не только в жидком состоянии вещества, но сохраняются и при переходе его в пар. Именно ассоциация молекул, затрудняющая отрыв их друг от друга, и служит причиной аномально высоких температур плавления и кипения таких веществ как фтористый водород, вода, аммиак, по сравнению с однотипными соединениями (рис. 19).
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t, C |
|
|
100 |
Н2О |
|
60 |
|
|
20 |
|
|
-20 |
|
|
|
|
Н2Te |
-60 |
Н2S |
Н2Se |
|
|
Рис. 19. Зависимость температуры кипения водородных соединений элементов главной подгруппы VI группы
Силы межмолекулярного взаимодействия
Силы межмолекулярного взаимодействия действуют на расстоянии 1–10 Å. Характеризуются небольшими значениями энергии 15–20 кДж/моль.
Природа этих сил определяется электростатическим взаимодействием диполей.
1. Ориентационное взаимодействие Отвечает за образование связи между полярными молекулами.
С увеличением температуры ориентационное взаимодействие ослабевает.
2. Индукционное взаимодействие Отвечает за образование связи между неполярными и полярными молекулами.
Неполярная молекула в поле полярной молекулы поляризуется, в результате чего образуется индуцированный диполь и далее идет ориентационное взаимодействие.
индуцированный
диполь
3. Дисперсное взаимодействие Межмолекулярное взаимодействие между неполярными молекулами за счет возникновения мгновенных диполей.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Литература
1.Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н. Л. Глинка ; под ред. А. И. Ермакова. - Изд. 30-е, испр. - М.: Интеграл-Пресс, 2004. - 728 с.: ил.
2.Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах, формулах, химических реакциях: Учеб. пособие / А.П. Гаршин. - 2-е изд., испр. и доп. - СПб.:
Лань, 2000. - 288 с.
3.Карапетьянц М.Х. Общая и неорганическая химия: Учебник для студентов вузов / М.Х. Карапетьянц, С.И. Дракин. - 4-е изд., стер. - М.: Химия, 2000. - 592 с.: ил.
4.Угай Я.А. Общая и неорганическая химия: Учебник для студентов вузов, обучающихся по направлению и специальности "Химия" / Я.А. Угай. - 2-е изд., испр. - М.: Высшая школа, 2000. - 527 с.: ил.
5.Неорганическая химия: учебник для студентов вузов, обучающихся по направлению 510500 "Химия" и специальности 011000 "Химия" : в 3 т. Т. 1: Физико-химические основы неорганической химии / М. Е. Тамм, Ю. Д. Третьяков / под ред. Ю. Д. Третьякова. - М.: Академия, 2004. - 240 с.: ил.
6.Неорганическая химия: учебник для студентов вузов, обучающихся по направлению 510500 "Химия" и специальности 011000 "Химия" : в 3 т. Т. 2: Химия непереходных элементов / А. А. Дроздов, В. П. Зломанов, Г. Н. Мазо, Ф. М. Спиридонов / под ред. Ю. Д. Третьякова. - М.: Академия, 2004. - 368 с.: ил.
Дополнительная литература
1.Заградник Р., Полак Р. Основы квантовой химии. Пер с чешс. – М.: Мир, 1979. – 504 с.
2.Хабердитцл В. Строение материи и химическая связь. Пер. с нем. – М.: Мир, 1974. – 296 с.
3.Гиллеспи Р., Харгиттаи И. Модель отталкивания электронных пар валентной оболочки и строение молекул: Пер. с. англ. – М.: Мир, 1992. – 296 с.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
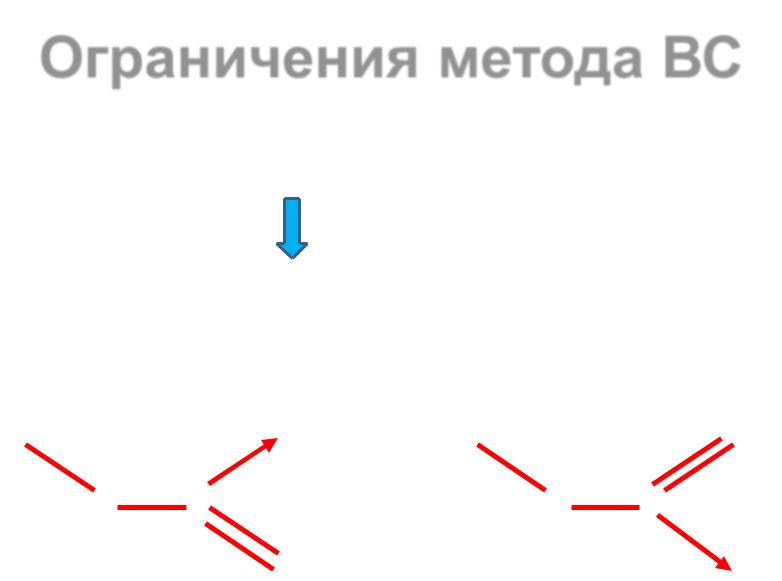
Ограничения метода ВС
• азотная кислота, бензол, озон???
наложение валентных схем или
резонансные структуры
H |
|
O |
H |
|
O |
О |
N |
|
|
O |
N |
|
|
O |
|
|
|

Метод МО
(Малликен, Хунд):
•молекула – совокупность ядер и электронов,
•каждый электрон движется в поле остальных электронов и ядер.
(связь многоцентровая, многоэлектронная)

ЛКАО
•(МО)связ = С1 (АО1) + С2 (АО2)
•(МО)разр = С3 (АО1) – С4 (АО2)
•Энергии АО близки С1 и С2 близки максимальное перекрывание, снижение энергии связывающих МО
•Энергии АО сильно различаются несвязывающие МО

Принципы метода МО
1.Как и в атоме, в молекуле е занимают соответствующие орбитали.
При этом продолжают действовать:
•принцип min Е,
•принцип Паули,
•правило Хунда
2. Число МО = суммарному числу АО
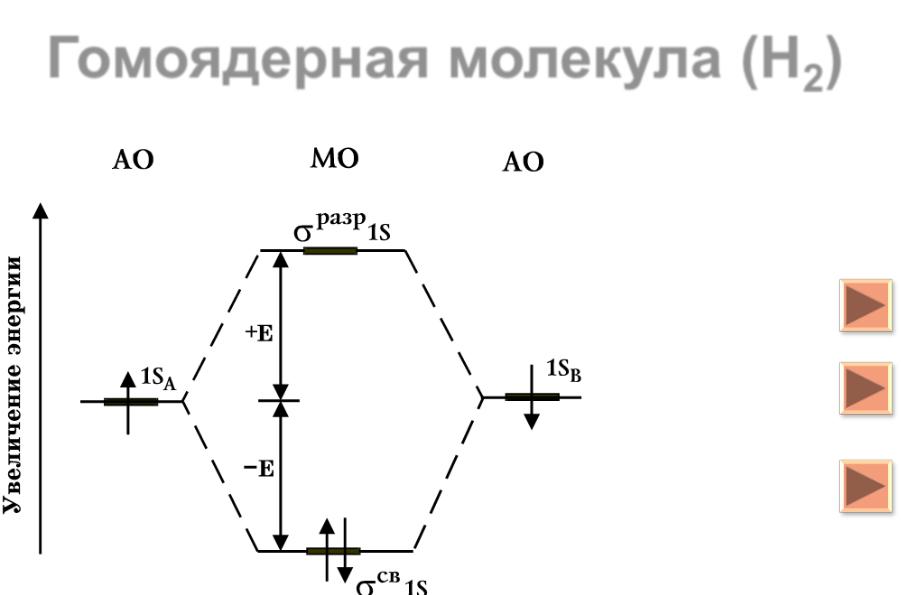
Гомоядерная молекула (Н2)
1 период
2 период
S2
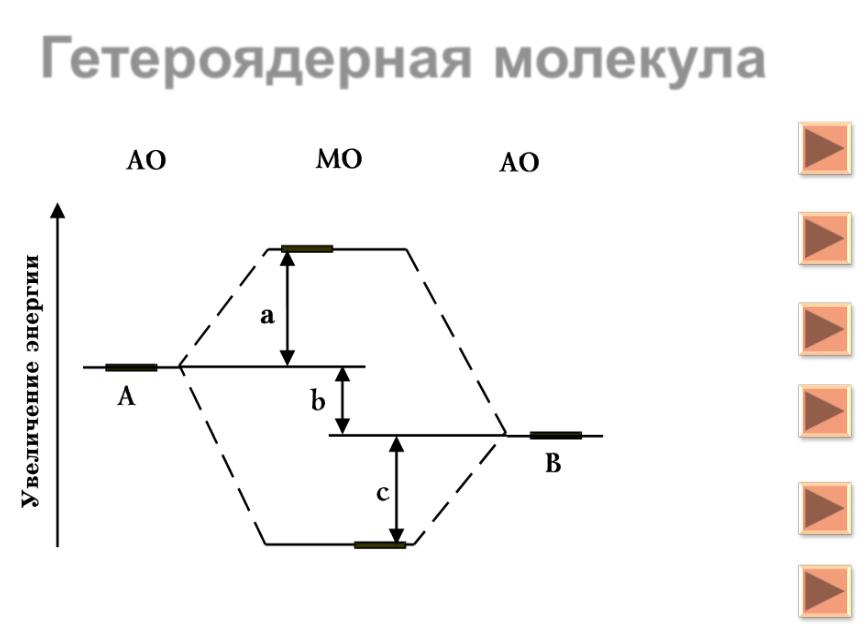
Гетероядерная молекула
СО
Н2О
NH3
CH4
BeH2
BH3
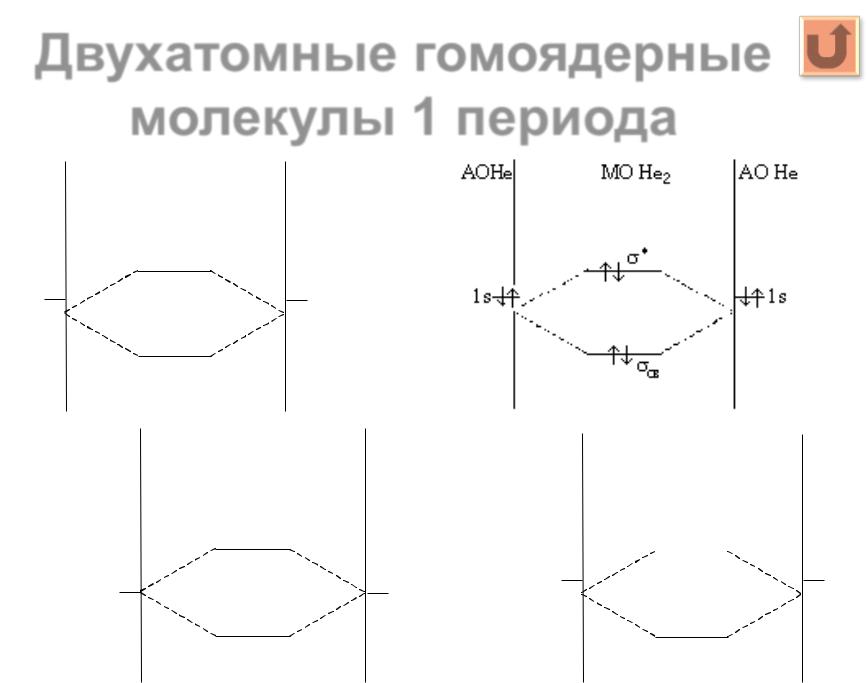
Н2
Двухатомные гомоядерные молекулы 1 периода
АО Н |
МО Н |
2 |
АО Н |
|
|
|
* |
Не2 |
|
|
1s |
1s |
|
|
св |
|
АО Н МО H2 АО Н АО Н МО H2 АО Н
Н |
- |
|
|
|
* |
|
|
Н |
+ |
|
|
* |
|||
2 |
|
|
|
|
2 |
|
|
||||||||
|
1s |
|
|
|
|
|
1s |
1s |
|
|
|
|
|
1s |
|
|
|
св |
|
|
св |
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
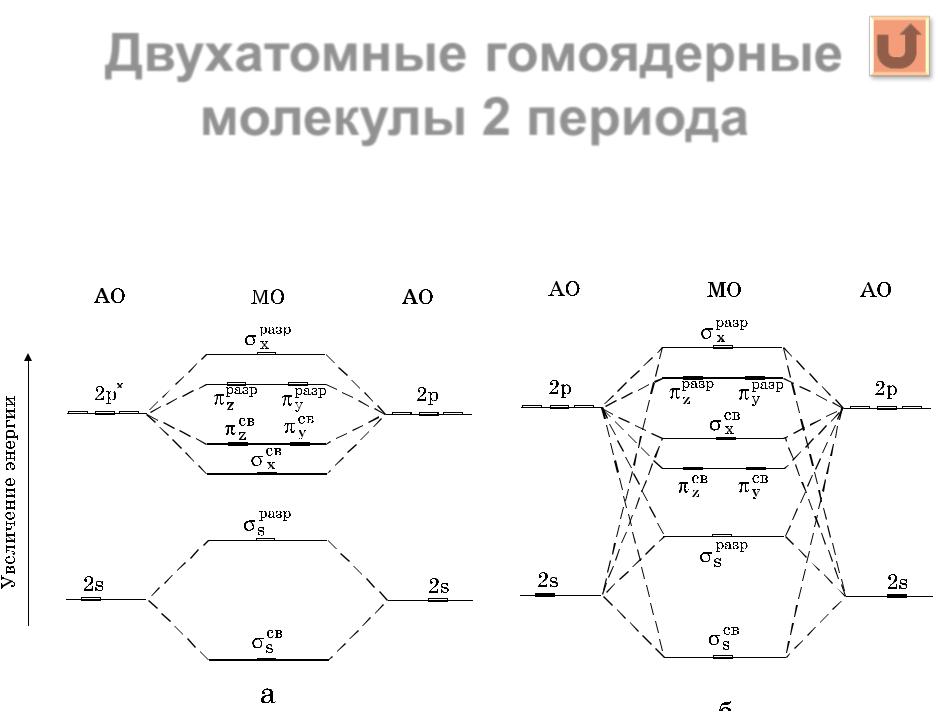
Двухатомные гомоядерные молекулы 2 периода
|
|
|
|
|
|
|
|
|
Конец периода |
|
|
|
|
Начало периода |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
(О2 – F2) |
|
|
|
|
(Li2 – N2) |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
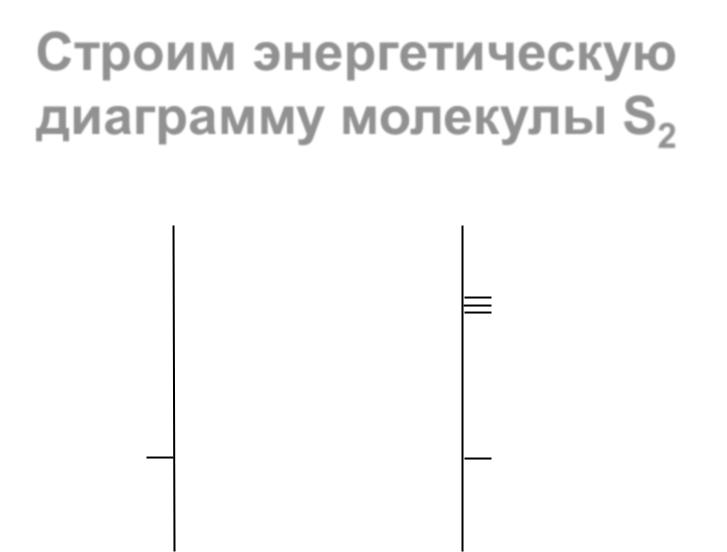
Строим энергетическую диаграмму молекулы S2
• 1. Строим АО внешнего уровня
АО S |
МО S2 |
АО S |
|
3p |
|
|
3р |
|
|
||
|
|
||
|
|
||
3s |
3s |
• 2. Определяем число МО: АО = МО 4АО S + 4АО S = 8МО
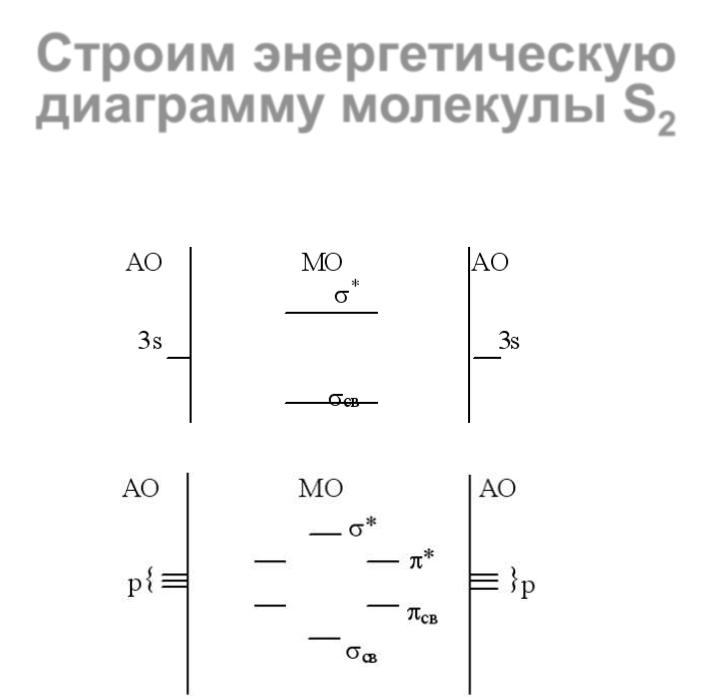
Строим энергетическую диаграмму молекулы S2
• 3. Определяем тип перекрывания АО
3s + 3s s
3p + 3p p и p
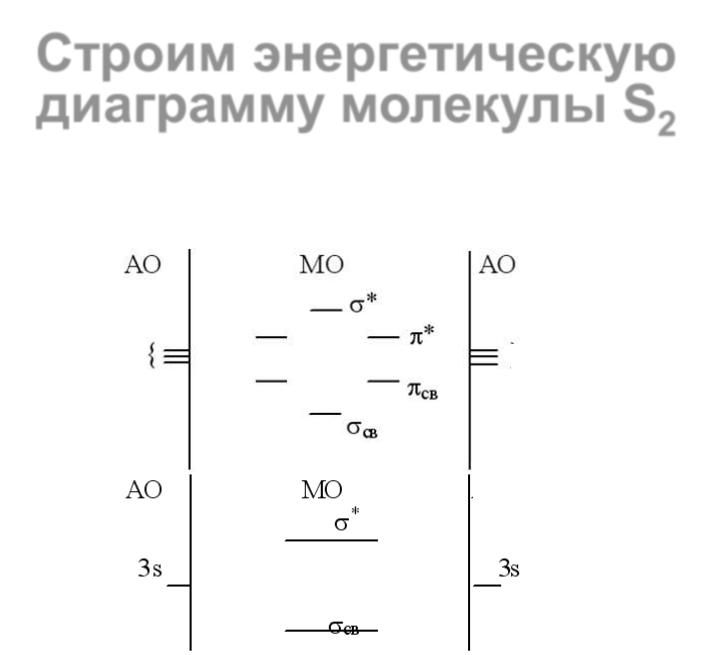
Строим энергетическую диаграмму молекулы S2
• 4. Общий вид МО
3р |
3р |
|
|
|
|
|
|
|
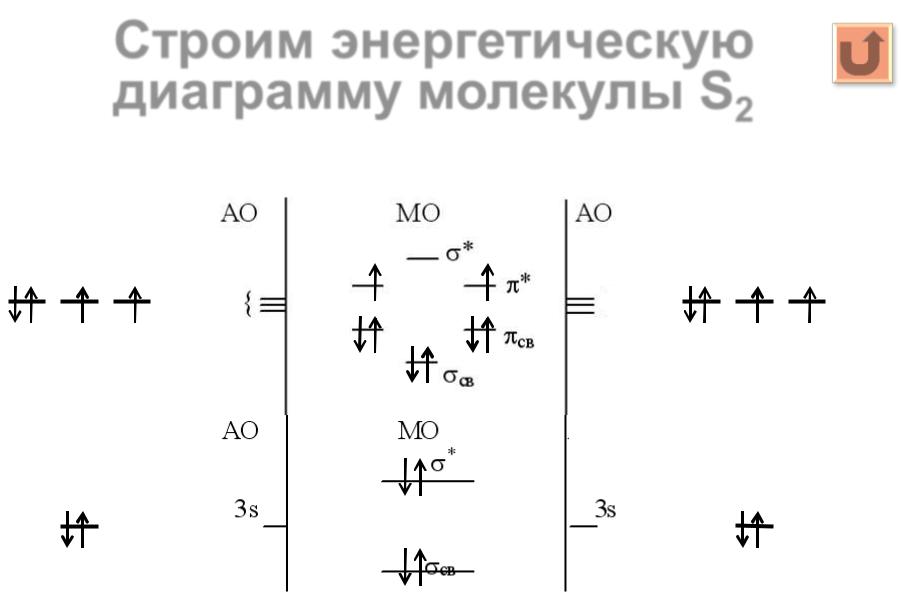
Строим энергетическую диаграмму молекулы S2
• 5. Заполняем орбитали электронами
3р |
3р |
|
|
|
|
|
|
|
• Кратность связи? Магнитные свойства?

Cтроим энергетическую диаграмму молекулы СО
• 1. Строим АО внешнего уровня
АО С |
МО СО |
АО О |
2p |
|
|
|
|
2р |
2s 2s
• 2. Определяем число МО: АО = МО 4АО С + 4АО О = 8МО
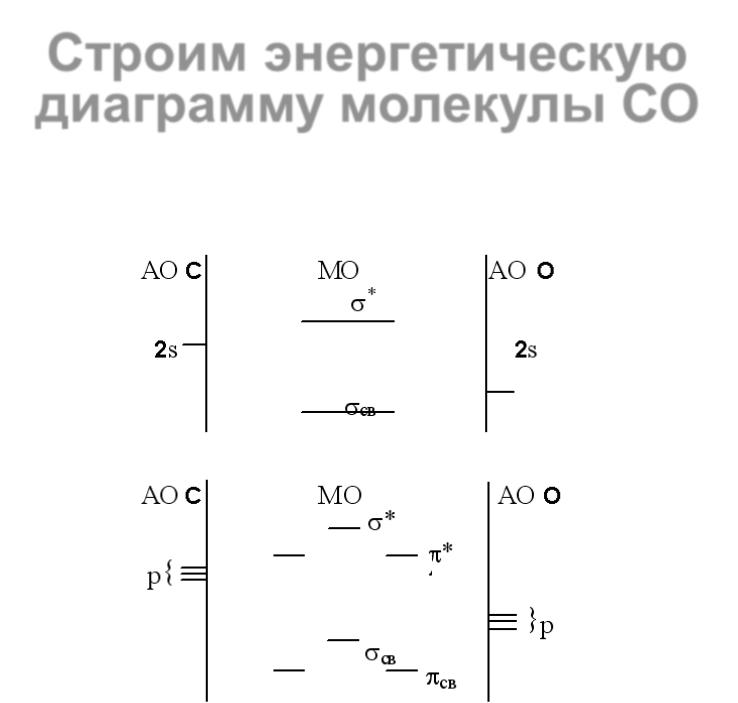
Строим энергетическую диаграмму молекулы СО
• 3. Определяем тип перекрывания АО
2s + 2s s
2p + 2p p и p
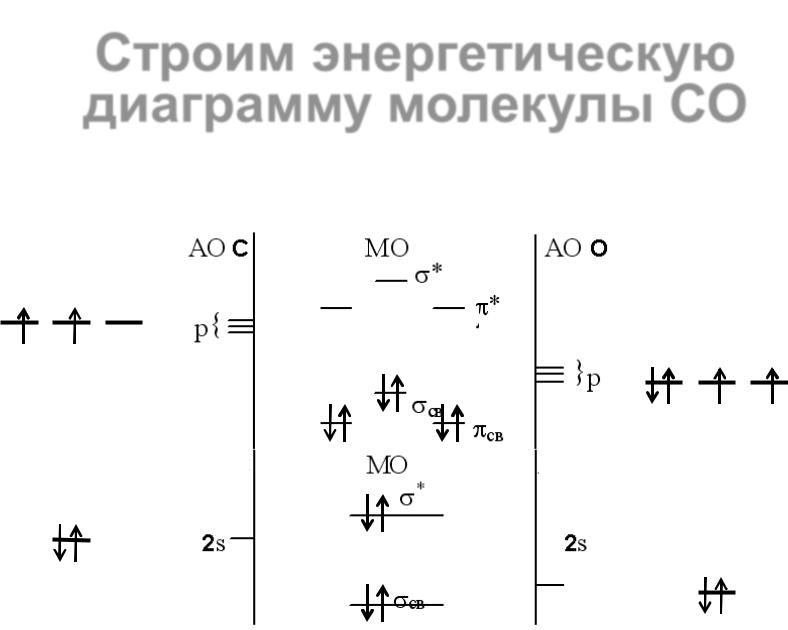
Строим энергетическую диаграмму молекулы СО
• Заполняем орбитали электронами
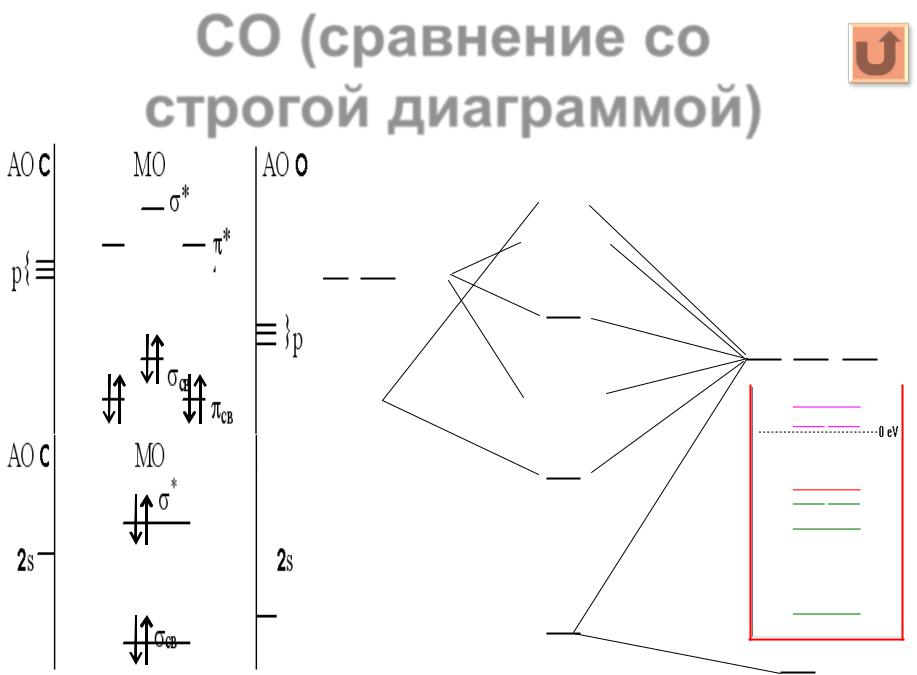
CO (сравнение со строгой диаграммой)
|
|
|
С |
|
|
|
|
|
|
|
|
|
|
|
|
О |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
разр |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
разр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2p |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
св |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
св |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
2s
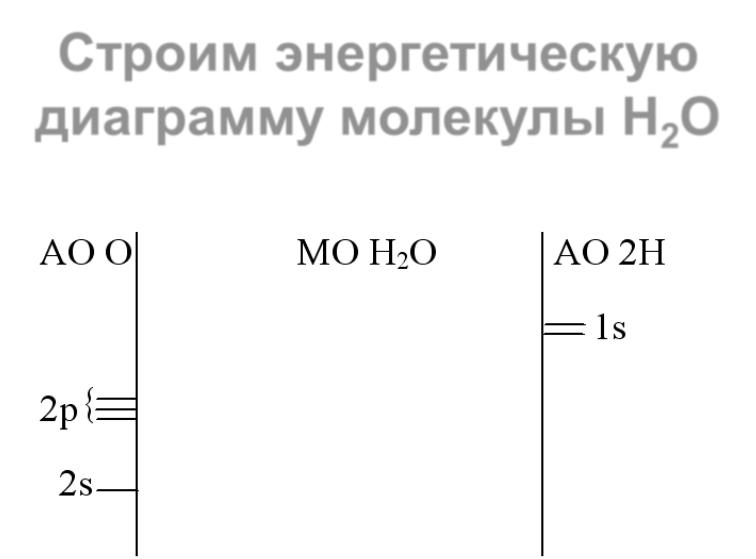
Строим энергетическую диаграмму молекулы Н2О
•1. Строим АО внешнего уровня
•2. Определяем число МО: АО = МО 4АО О + 2АО Н = 6МО

Строим энергетическую диаграмму молекулы Н2О
•3. Определяем тип перекрывания АО
2s + 1s s
2p + 1s p
•4. Определяем число связывающих, разрыхляющих, несвязывающих МО
МОсвязывающих = МОразрыхляющих = АОmin =
=2 * 1 АО Н = 2
МОнесвязывающих = МО – МОсвязывающих –
–МОразрыхляющих = 6 – 2 – 2 = 2
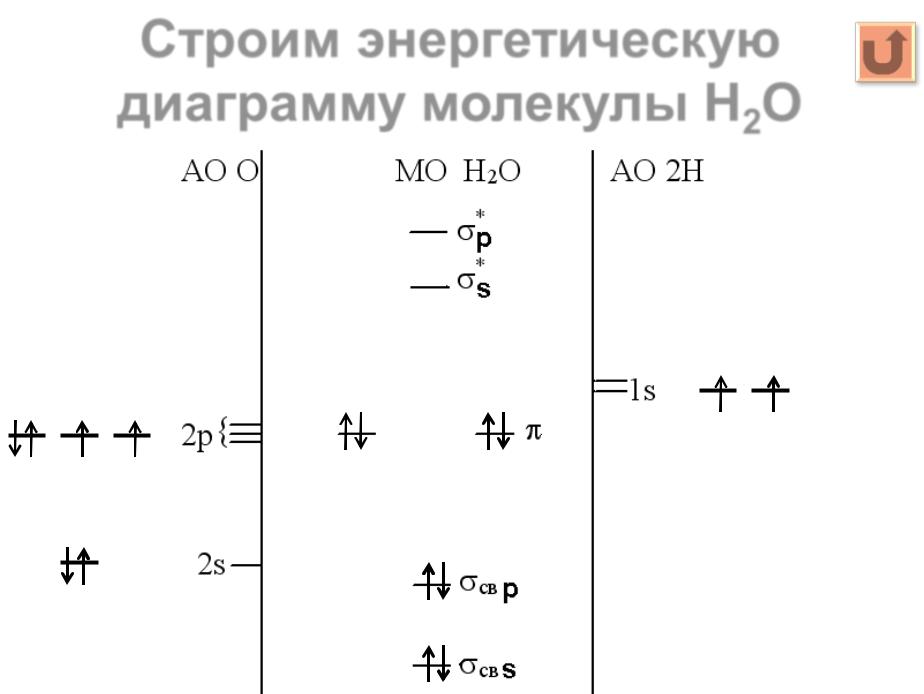
Строим энергетическую диаграмму молекулы Н2О
NH3
•МО = 4 АО N + 3 АО Н = 7
•МОсвяз = МОразр = 3 * 1 АО Н = 3
•МОнесв = 7 – 3 – 3 = 1
•2s + 1s s, 2p + 1s p
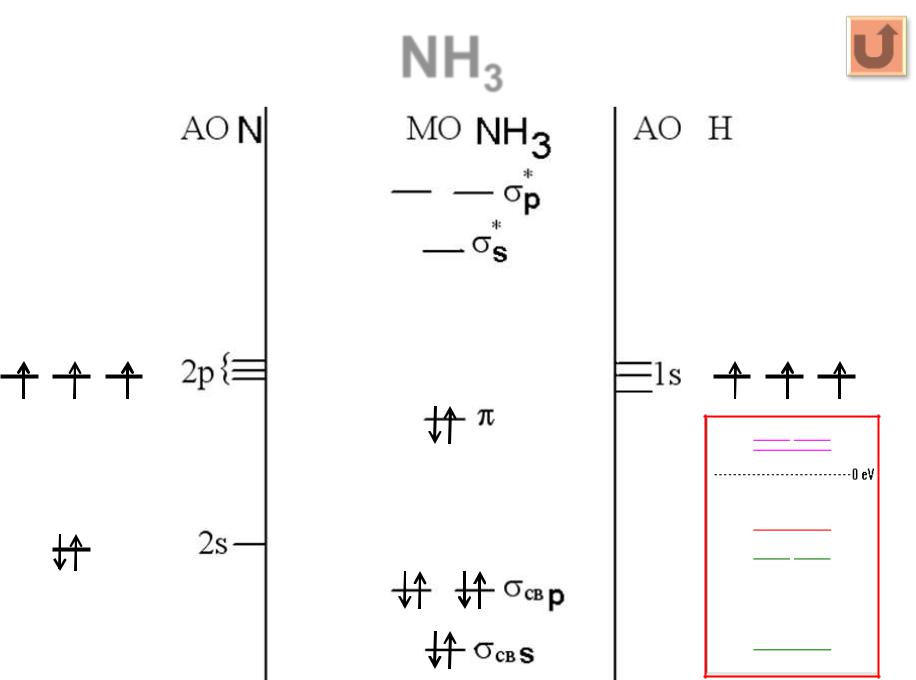
NH3
CH4
•МО = 4 АО C + 4 АО Н = 8
•МОсвяз = МОразр = 4 * 1 АО Н = 4
•МОнесв = 8 – 4 – 4 = 0
•2s + 1s s, 2p + 1s p
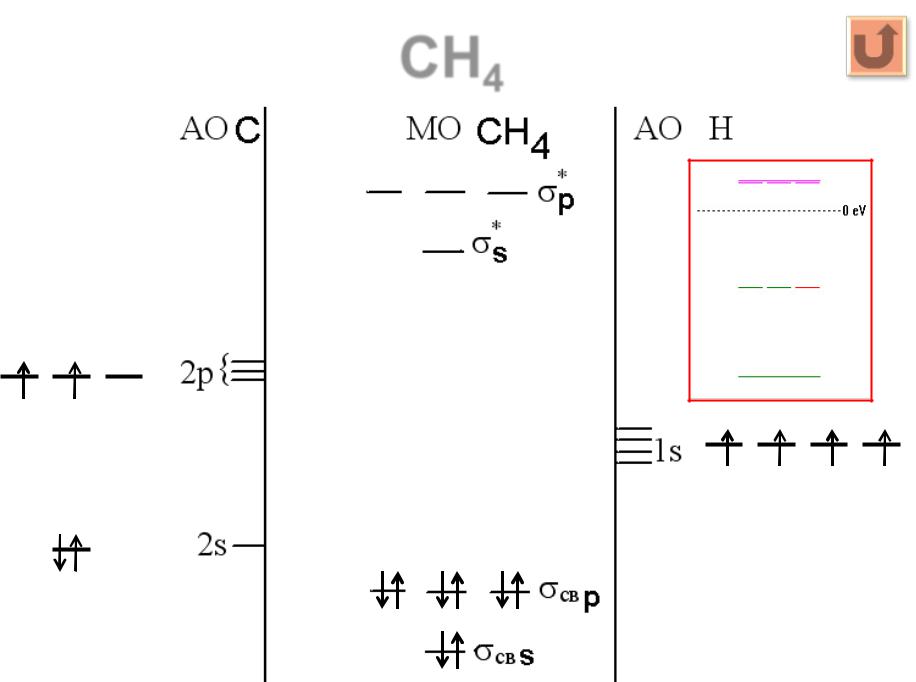
CH4
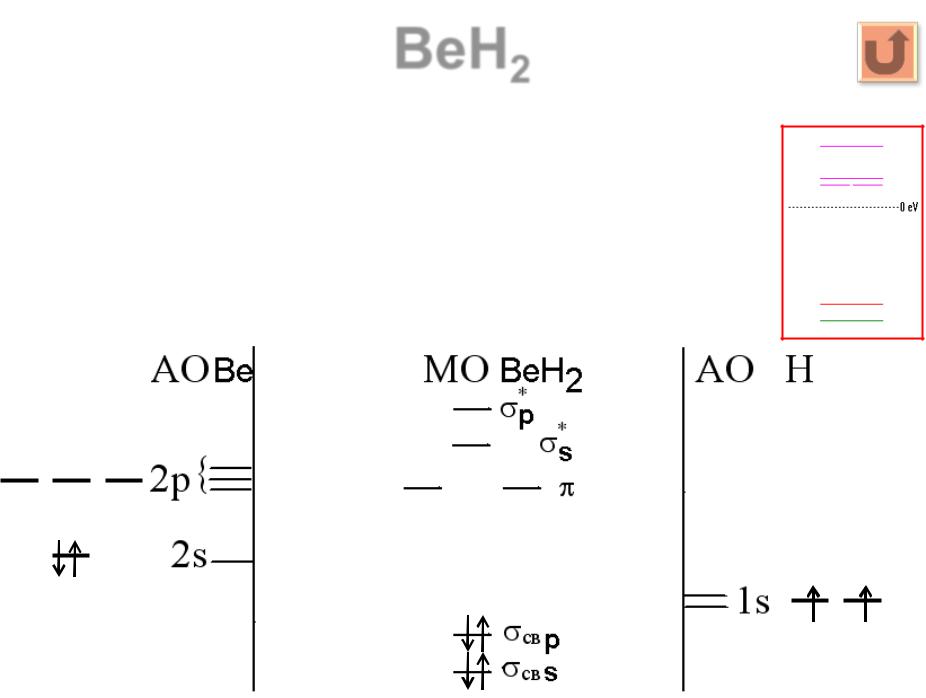
BeH2
•МО = 4 АО Be + 2 АО Н = 6
•МОсвяз = МОразр = 2 * 1 АО Н = 2
•МОнесв = 6 – 2 – 2 = 2
•2s + 1s s, 2p + 1s p
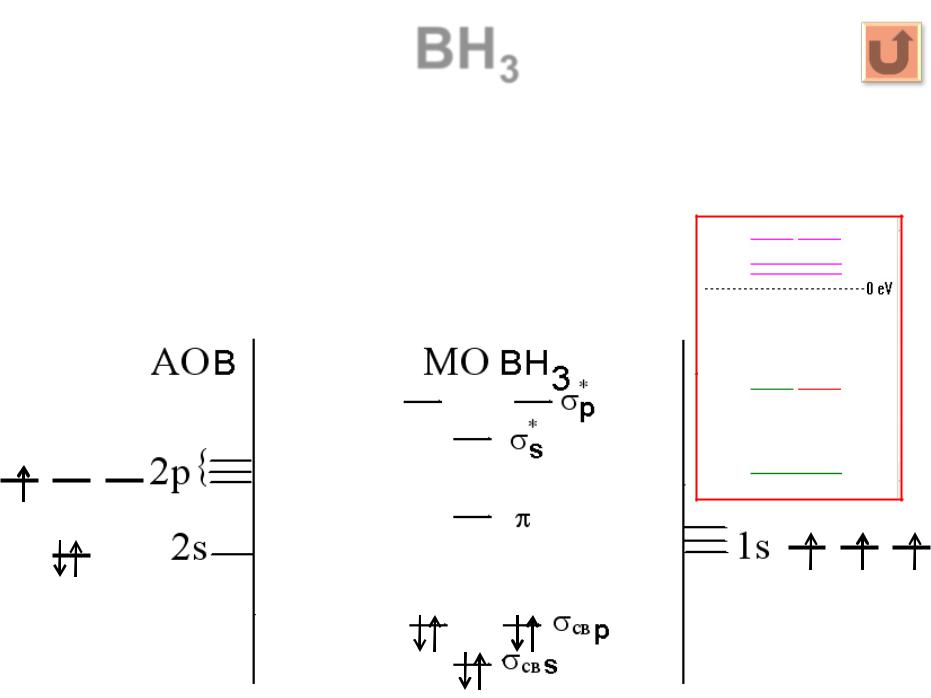
BH3
•МО = 4 АО B + 3 АО Н = 7
•МОсвяз = МОразр = 3 * 1 АО Н = 3
•МОнесв = 7 – 3 – 3 = 1
•2s + 1s s, 2p + 1s p

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Лекция 15
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Содержание
Основные определения
Окислительно-восстановительные реакции
Степень окисления. Расчет степени окисления
Возможные степени окисления элементов
Окислитель и восстановитель, окисление и восстановление
Типы окислительно-восстановительных реакций
Модуль 4. Лекция 15. Окислительно-восстановительные реакции

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Окислительно-восстановительные реакции
Две группы химических реакций
реакции, в которых степень окисления атомов, входящих в состав реагирующих веществ, не изменяется
3 1 |
1 2 1 |
3 |
2 1 |
1 1 |
FeCl |
3Na O H |
Fe(O H) |
3NaCl |
|
3 |
|
|
3 |
|
реакции, в которых степень окисления атомов изменяется
2 6 2 |
1 1 |
1 1 0 |
1 6 |
2Cu S O4 |
4 K I |
2Cu I I 2 |
2K 2 S |
Окислительно-восстановительные реакции
2
O
4в которых
изменяются степени окисления атомов, входящих в состав реагирующих веществ. Изменение с. о. связано с переходом электронов от одних атомов к другим
Модуль 4. Лекция 15. Окислительно-восстановительные реакции

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Степень окисления -
заряд, который имел бы атом при условии, что каждая общая электронная пара полностью смещена к более электроотрицательному атому
Степень окисления обозначают над символом элемента арабской цифрой со знаком (+) или ( ) перед цифрой или римской цифрой без указания знака заряда
2 6 2 Cu S O 4
I V II
K ClO3
Заряд простого иона в растворе, равный степени окисления, обозначают арабской цифрой, знак заряда принято ставить после цифры
Sn2+ Fe3+
Модуль 4. Лекция 15. Окислительно-восстановительные реакции

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Правила расчета степени окисления
Алгебраическая сумма степеней окисления атомов в молекуле равна нулю, в ионе – заряду иона
С. о. атомов в простых веществах равна нулю
С. о. в сложных веществах
–атомов элементов IA подгруппы +1, IIA подгруппы +2
–атомов кислорода равна 2, за исключением пероксидов, надпероксидов, озонидов и соединений
с фтором, в которых с. о. кислорода равна соответственно 1, 1/2, 1/3, +2
–атомов водорода в соединениях с неметаллами равна +1, в соединениях с металлами равна -1
–атомов фтора равна –1
Модуль 4. Лекция 15. Окислительно-восстановительные реакции

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Примеры расчета степени окисления
Расчет с. о. марганца в манганате калия K2MnO4
Степень окисления
калия равна +1 |
2(+1) + x + 4( 2) = 0 |
|
кислорода равна 2 |
x = 6 |
|
марганца равна х |
с.о. марганца +6 |
|
Расчет с. о. хрома в дихромат-ионе Cr O |
2 |
|
|
2 |
7 |
Степень окисления |
|
|
кислорода равна 2 |
2х + 7( 2) = 2 |
|
хрома равна х |
x = 6 |
|
|
с.о. хрома +6 |
|
Модуль 4. Лекция 15. Окислительно-восстановительные реакции

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Возможные высшая и низшая степени окисления металлов
Номер группы в периодической системе равен числу валентных электронов атома элемента (за исключением элементов IБ, VIIIБ подгрупп, кислорода и фтора)
Высшая степень окисления равна номеру группы, за исключением элементов I Б и VIII Б подгрупп (высшая с.о. Cu, Au +3, Ag +2, высшая с. о. элементов VIII Б подгруппы, равная номеру группы, известна для Os, высшая с. о. Fe +6)
Низшая степень окисления равна 0
Pb элемент IVА подгруппы, металл. Высшая с.о. = +4, низшая с.о. = 0 W элемент VIБ подгруппы, металл. Высшая с.о. = +6, низшая с.о. = 0
Модуль 4. Лекция 15. Окислительно-восстановительные реакции

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Возможные высшая и низшая степени окисления неметаллов
Высшая степень окисления равна номеру группы, за исключением кислорода и фтора
Низшая (отрицательная) степень окисления равна заряду электронов, недостающих до завершения внешнего энергетического уровня атома до восьми электронов  № группы 8
№ группы 8
Br элемент VIIА подгруппы, неметалл. Высшая с.о. = +7, низшая с.о. = 1
Модуль 4. Лекция 15. Окислительно-восстановительные реакции

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Окислитель и восстановитель, окисление и восстановление
Восстановитель частица (атом, молекула, ион), которая отдает электроны. Восстановитель в ходе реакции окисляется
Окислитель – частица (атом, молекула, ион), которая принимает электроны. Окислитель в ходе реакции восстанавливается
Окисление – отдача электронов и, следовательно, повышение степени окисления элемента
Восстановление – присоединение электронов и, следовательно, понижение степени окисления элемента
2 |
|
3 |
4 |
|
2 |
|
SnCl |
2 |
2FeCl SnCl |
4 |
2FeCl |
2 |
|
|
|
3 |
|
|||
восстановитель – ион Sn2+: |
Sn2+ 2 e = Sn4+ |
окисление |
||||
окислитель – ион Fe3+: |
Fe3+ + e = Fe2+ |
восстановление |
||||
Модуль 4. Лекция 15. Окислительно-восстановительные реакции

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Окислительно-восстановительные свойства соединений
Только окислителями являются:
простые вещества, атомы которых имеют самую большую электроотрицательность фтор и кислород простые катионы с высшей степенью окисления
Sn4+, Au3+ и др.
сложные анионы, в которых элемент проявляет высшую
степень окисления |
5 |
|
6 |
2- |
6 |
2 |
7 |
|
|
|
|
- |
и др. |
||||
N O3 |
, S O4 |
, Cr2 O7 |
, MnO4 |
|||||
Только восстановителями являются: простые вещества металлы
простые отрицательные ионы Cl , Br , I , S2 и др.
Модуль 4. Лекция 15. Окислительно-восстановительные реакции

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Окислительно-восстановительные свойства соединений
Иокислителями, и восстановителями могут быть:
–простые вещества неметаллы, кроме фтора и кислорода;
–сложные вещества, содержащие элемент в
промежуточной степени окисления |
2 |
4 |
4 |
|
и др. |
N O, MnO |
, S O |
2 |
|||
|
|
2 |
|
|
|
–простые ионы с промежуточной степенью окисления
Sn2+, Fe2+, Ti3+, Cr3+ и др.;
–сложные ионы, содержащие элемент в промежуточной
3 |
4 |
степени окисления – N O2, |
V O2 и др. |
Модуль 4. Лекция 15. Окислительно-восстановительные реакции

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Типы окислительновосстановительных реакций
Межмолекулярные реакции окисления восстановления протекают с изменением степени окисления атомов в разных веществах
|
|
1 |
0 |
|
|
1 |
0 |
|
|
|
2K Br |
Cl2 2K Cl Br2 |
|
|
|||||||
4 |
|
2H |
4 |
|
2H |
|
6 |
|
0 |
|
H Se O |
3 |
S O |
3 |
|
S O |
4 |
Se |
|||
2 |
|
2 |
|
2 |
|
|
||||
Внутримолекулярные реакции окисления восстановления протекают с изменением степени окисления атомов разных элементов в одном и том же веществе
3 |
6 |
0 |
3 |
|
( N H4 )2 Cr2 O7 |
N2 |
Cr2 O3 4H2O |
||
|
5 2 |
|
1 |
0 |
|
2K Cl O3 |
2K Cl |
3O2 |
|
Модуль 4. Лекция 15. Окислительно-восстановительные реакции

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Типы окислительновосстановительных реакций
Реакции диспропорционирования (самоокислениясамовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента, находящегося в промежуточной степени
окисления
0 3S
0 |
H O |
|
1 |
|
1 |
|
|
|
Cl |
HCl HClO |
|
||||||
2 |
2 |
|
2 |
|
|
4 |
|
|
6NaOH 2Na |
|
Na |
|
|
3H O |
|||
2 |
S |
2 |
S O |
3 |
||||
|
|
|
|
|
2 |
|||
Реакции дисмутации – это внутримолекулярные или межмолекулярные реакции окисления восстановления, которые протекают с выравниванием степеней окисления
атомов одного и того же элемента
|
3 |
5 |
1 |
|
|
|
N H4 N O3 |
N2 O 2H2O |
|
||
5 |
|
1 |
0 |
|
|
K I O3 |
5K I 3H2SO4 3 I 2 |
3K2SO4 |
3H2O |
||
Модуль 4. Лекция 15. Окислительно-восстановительные реакции

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Заключение
Окислительно-восстановительные реакции реакции, в которых изменяются степени окисления атомов, входящих в состав реагирующих веществ
В окислительно-восстановительных реакциях электроны переходят от восстановителя к окислителю
Окислитель частица (атом, молекула, ион), которая принимает
электроны; окислитель в ходе реакции восстанавливается. Восстановитель частица (атом, молекула, ион), которая отдает электроны; восстановитель в ходе реакции окисляется
Различают четыре типа окислительно-восстановительных реакций:
–межмолекулярные
–внутримолекулярные
–диспропорционирования (самоокисления самовосстановления)
–дисмутации
Модуль 4. Лекция 15. Окислительно-восстановительные реакции

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Рекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Высш. шк.,
1994
Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия,
2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 2007
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы неорганической химии. Под ред. Ю. Д. Третьякова. - М.: Академия, 2004
Лидин Р.А. Задачи по общей и неорганической химии. - М.: ВЛАДОС, 2004
Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах, формулах, химических реакциях. - СПб.: Лань, 2000
Модуль 4. Лекция 15. Окислительно-восстановительные реакции

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Лекция 16
СОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Содержание
Нахождение коэффициентов в уравнениях окислительно-восстановительных реакций методом электронного баланса
Составление уравнений окислительновосстановительных реакций методом электронноионного баланса
Составление уравнений реакций, протекающих в кислой среде
Составление уравнений реакций, протекающих в щелочной среде
Составление уравнений реакций, протекающих в нейтральной среде
Составление уравнений реакций с незаданной средой
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Нахождение коэффициентов в уравнении реакции
MnO |
KClO |
KOH K MnO |
KCl H O |
|
2 |
3 |
2 |
4 |
2 |
методом электронного баланса
По изменению с. о. атомов элементов  окислитель
окислитель
4 2 |
1 5 2 |
1 2 1 |
1 |
6 2 |
1 1 |
|
восстановитель |
||||
MnO |
2 |
K ClO |
3 |
K O H |
K |
2 |
MnO |
4 |
K Cl |
|
|
|
|
|
|
|
|
|
|
||||
вос-ль |
ок-ль |
|
4 |
|
|
6 |
|
|
|||
|
|
|
|
|
|
|
|
|
|||
Электронная схема |
Mn 2e Mn |
3 |
- окисление |
||||||||
|
|
|
|
|
5 |
|
|
|
1 |
|
|
|
|
|
|
|
Cl 6e Cl |
1 |
- восстановление |
||||
Коэффициенты в уравнении |
|
|
|
|
|
|
|||||
|
|
3 MnO2 + KClO3 + KOH 3 K2MnO4 + KCl + H2O |
|||||||||
Молекулярное уравнение |
|
|
|
|
|
|
|||||
|
|
3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O |
|||||||||
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Нахождение коэффициентов в уравнении реакции
Ca3(PO4 )2 C SiO2 CaSiO4 P4 CO
методом электронного баланса
По изменению с. о. атомов элементов  окислитель
окислитель
5 |
|
|
|
0 |
|
|
|
0 |
|
|
2 |
|
восстановитель |
Ca ( P O |
4 |
) |
2 |
C SiO |
2 |
CaSiO |
P |
4 |
C O |
|
|||
3 |
|
|
|
4 |
|
|
|
|
|
||||
ок-ль вос-ль |
|
|
|
|
|
|
|
|
|
||||
Электронная схема |
|
0 |
|
2 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
C |
2e C |
|
|
10 |
- окисление |
||
|
|
|
|
|
|
5 |
|
|
|
0 |
|
|
|
|
|
|
|
|
|
4P |
20e P |
4 |
1 |
- восстановление |
|||
|
|
|
|
|
|
|
|
|
|
|
|||
Молекулярное уравнение
2Ca3(PO4)2 + 10 C + 3SiO2 = 3CaSiO4 + P4 + 10 CO
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Составление уравнения реакции
KMnO |
NaNO |
|
H SO |
|
2 |
NO |
|
|
2 |
4 |
Mn |
3 |
|||||
4 |
|
2 |
|
|
|
методом электронно-ионного баланса
7 |
|
3 |
|
|
|
|
2 |
5 |
|
|
|
K MnO |
|
Na N O |
|
H |
SO |
|
N O |
|
|||
4 |
2 |
4 |
Mn |
|
3 |
||||||
|
|
2 |
|
|
|
|
|
||||
ок-ль |
|
вос-ль |
среда кислая |
|
|
|
|
||||
Ионная схема реакции |
|
|
|
|
|
|
|
|
|
||
K+ + MnO |
+ Na+ + NO |
+ 2H+ + SO |
2 Mn2+ + NO + … |
||||||||
|
4 |
|
|
2 |
|
|
4 |
|
|
3 |
|
Окислительно-восстановительные пары
MnO4 Mn2+
NO2 NO3
Установление материального баланса в уравнениях полуреакций
MnO |
+ 8H+ Mn2+ + 4H O |
[O2 ] + 2H+ = H O |
|
4 |
|
2 |
2 |
NO |
+ H O NO + 2H+ |
H O = [O2 ] + 2H+ |
|
2 |
2 |
3 |
2 |
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Составление уравнения реакции
KMnO |
NaNO |
|
H SO |
|
2 |
NO |
|
|
||||
2 |
4 |
Mn |
3 |
|||||||||
|
|
4 |
|
|
2 |
|
|
|
|
|||
Расчет числа отданных и принятых электронов в полуреакциях |
||||||||||||
|
+ |
|
e |
2+ |
|
|
|
|
|
|
|
|
MnO4 + 8H |
+ 5 |
|
|
электронно-ионное уравнение |
||||||||
|
|
= Mn + 4H2O |
||||||||||
баланс зарядов: -1 + 8 + 5 ( -1) = +2 |
полуреакции восстановления |
|||||||||||
NO2 + H2O – 2
e
= NO3 + 2H+
 электронно-ионное уравнение
электронно-ионное уравнение
баланс зарядов: -1 – |
2 ( -1) = -1 + 2 |
полуреакции окисления |
||||||||
|
Электронно-ионная схема реакции |
|
|
|
|
|
||||
|
|
MnO |
+ 8H+ + 5 e = Mn2+ + 4H O |
|
|
2 |
|
|||
|
|
|
|
|||||||
|
|
|
4 |
|
|
2 |
|
|
|
|
|
|
NO |
+ H O – 2 e |
= NO |
+ 2H+ |
|
|
5 |
|
|
|
|
|
2 |
2 |
3 |
|
|
|
|
|
|
2MnO |
+ 5NO |
|
+ 16H+ + 5H O= 2Mn2+ + 5NO |
|
+ 10H+ + 8H O |
||||
|
|
4 |
2 |
|
2 |
|
|
|
3 |
2 |
|
Ионное и молекулярное уравнения реакции |
|
|
|||||||
|
|
2MnO |
+ 5NO + 6H+ = 2Mn2+ + 5NO + 3H O |
|||||||
|
|
4 |
|
2 |
|
3 |
|
|
|
2 |
2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Составление уравнений полуреакций с заданной кислой средой
В электронно-ионные уравнения полуреакций с заданной кислой средой помимо окисленных и восстановленных форм включают ионы H+ и молекулы H2O
[O2-] + 2H+ = H2O
H2O = [O2-] + 2H+
Примеры электронно-ионных уравнений полуреакций
Cr2O72- Cr3+
Cr2O72- + 14H+
+ 6
e
= 2Cr3+ + 7H2O - полуреакция восстановления
PbS PbSO4
PbS + 4H O – 8 e = PbSO |
4 |
+ 8H+ |
- полуреакция окисления |
2 |
|
|
|
Малорастворимые PbS и PbSO4 |
записаны в молекулярной форме |
||
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Составление уравнений полуреакций по балансу зарядов
Число отданных и принятых электронов в полуреакциях с участием сложных частиц, содержащих атомы элемента в разных степенях окисления, определяют по балансу зарядов
Пример 1. Co3O4
Co3O4
баланс зарядов: 8 +
+H+ Co2+
+8H+ + х e = 3Co2+ + 4H2O
х( -1) = 6  х = 2
х = 2
Co3O4 + 8H |
+ |
+ |
2 |
e |
= 3Co |
2+ |
+ 4H2O |
полуреакция восстановления |
||||||
|
|
|||||||||||||
|
|
|
||||||||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|||||
Пример 2. |
|
|
Fe O |
4 |
+ H+ |
Fe3+ |
|
|
|
|||||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
e |
|
3+ |
|
|
|
|
|
|
Fe3O4 + 8H + х |
= 3Fe + 4H2O |
|||||||||
|
|
|
|
|
||||||||||
баланс зарядов: 8 + х( -1) = 9 |
|
|
х = -1 |
|||||||||||
+ |
|
|
e |
|
|
3+ |
|
|
|
|
|
|
|
|
Fe3O4 + 8H |
|
- |
|
= 3Fe + 4H2O |
|
полуреакция окисления |
||||||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Составление уравнения реакции
P + HNO3 (конц) H3PO4 + NO2
методом электронно-ионного баланса
0 |
5 |
|
|
5 |
|
|
4 |
|
P H N O |
3 (конц ) |
H |
P O |
4 |
|
N O |
2 |
|
|
|
3 |
|
|
|
|||
вос-ль ок-ль среда кислая
Ионная схема реакции
|
P + H+ + NO ¯ H PO |
4 |
+ NO |
2 |
||||||||||
|
|
|
|
3 |
|
|
3 |
|
|
|
|
|
||
Электронно-ионная схема и ионное уравнение |
||||||||||||||
|
P + 4H O – 5 e = H PO |
4 |
+ 5H+ |
|
|
1 |
|
|
окисление |
|||||
|
|
|
|
|
||||||||||
2 |
|
|
3 |
|
|
|
|
|
|
|
|
|
||
|
|
+ |
e |
|
|
|
|
|
|
|
|
|
|
|
|
NO3¯ + 2H + |
= NO2 |
+ H2O |
|
|
|
5 |
|
|
восстановление |
||||
|
|
|
|
|
|
|
||||||||
|
P + 5NO ¯ + 5H+ = H PO |
4 |
+ 5NO |
2 |
+ H O |
|
||||||||
3 |
|
|
3 |
|
|
|
2 |
|
||||||
Молекулярное уравнение
P + 5HNO3 (конц) = H3PO4 + 5NO2 + H2O
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Составление уравнений полуреакций
сзаданной щелочной средой
Вэлектронно-ионные уравнения полуреакций с заданной щелочной средой помимо окисленных и восстановленных форм включают
ионы ОH ¯ и молекулы H2O
[O2-] + H2О = 2ОH ¯
2ОН ¯ = [O2-] + H2О
Примеры электронно-ионных уравнений полуреакций
NO3¯ NO2¯
NO3¯ + H2O + 2
I2 IO3¯
e
= NO2¯ + 2ОН¯ - полуреакция восстановления
I2 + 12ОН¯ – 10 e = 2IO3¯ + 6H2O - полуреакция окисления
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Составление уравнения реакции
MnSO4 + KClO + NaOH MnO2 + Cl¯
методом электронно-ионного баланса
|
2 |
|
1 |
|
|
|
|
4 |
|
|
|
|
||
|
MnSO |
|
K ClO NaOH MnO |
|
|
|
||||||||
|
4 |
2 |
Cl |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
вос-ль |
|
ок-ль среда щелочная |
|
|
|
||||||||
Ионная схема реакции |
|
|
|
|
|
|
|
|
|
|
|
|||
|
Mn2+ + SO |
2- + K+ + ClO¯ + Na+ + OH¯ MnO |
2 |
+ Cl¯ |
||||||||||
4 |
|
|
|
|
|
|
|
|
|
|
|
|||
Электронно-ионная схема и ионное уравнение |
|
|
||||||||||||
|
Mn2+ + 4ОН¯ - 2 e = MnO |
2 |
+ 2H O |
|
|
|
окисление |
|||||||
|
1 |
|
|
|||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
||
|
ClO¯ + H2O + 2 e = Cl¯ + 2OH¯ |
|
1 |
|
|
восстановление |
||||||||
Mn2+ + ClO¯ + 2ОН¯ = MnO |
2 |
+ Cl¯ + H O |
|
|
|
|||||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|||
Молекулярное уравнение
MnSO4 + KClO + 2NaOH = MnO2 + KCl + Na2SO4 + H2O
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Составление уравнений полуреакций
сзаданной нейтральной средой
Внейтральной среде концентрация ионов H+ и ОН¯ мала, в левой части уравнений полуреакций, кроме окислителя и восстановителя, могут быть записаны только молекулы H2O
[O2-] + H2О = 2ОH ¯ H2O = [O2-] + 2H+
Примеры электронно-ионных уравнений полуреакций
MnO42 MnO2
2 |
|
|
e |
|
|
|
|
|
MnO4 + 2H2O + 2 |
= MnO2 + 4ОН¯ - полуреакция восстановления |
|||||||
|
||||||||
Mn2+ MnO2 |
|
|
|
|
|
|
||
Mn2+ + 2H O – 2 e |
= MnO |
2 |
+ 4H+ |
- полуреакция окисления |
||||
|
2 |
|
|
|
|
|
||
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Составление уравнения реакции
KMnO4 + Na2SO3 + H2O MnO2 + SO42-
методом электронно-ионного баланса
7 |
|
Na |
|
4 |
|
|
4 |
|
6 |
2 |
|
K MnO |
4 |
2 |
S O |
3 |
H |
O MnO |
|
S O |
|||
2 |
4 |
||||||||||
|
|
|
2 |
|
|
||||||
ок-ль |
|
вос-ль |
|
среда нейтральная |
|
||||||
Ионная схема реакции |
|
|
|
|
|
|
|
|
|
|||||
|
K+ + MnO + 2Na+ + SO 2- + H O MnO |
2 |
+ SO 2- |
|||||||||||
|
|
|
4 |
|
3 |
2 |
|
|
|
|
|
4 |
||
Электронно-ионная схема |
|
|
|
|
|
|
|
|
|
|||||
|
MnO4 + 2H2O + 3 e = MnO2 + 4ОН¯ |
2 |
|
|
|
восстановление |
||||||||
|
SO 2- + H O – 2 e |
= SO 2- + 2H+ |
|
|
|
3 |
|
|
|
окисление |
||||
|
3 |
|
2 |
|
4 |
|
|
|
|
|
|
|
|
|
|
2MnO + 3SO 2- + 7H O = 2MnO |
2 |
+ 3SO |
2- + 8OH¯ + 6H+ |
||||||||||
4 |
|
3 |
|
2 |
|
|
|
|
4 |
|
|
|
||
объединяют ионы H+ и ОН- в молекулы воды |
|
|
|
6H O + 2OH¯ |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
Ионное и молекулярное уравнения |
|
|
|
|
|
|
|
|
|
|||||
|
2MnO |
4 |
+ 3SO |
3 |
2- + H O = 2MnO |
2 |
+ 3SO |
2- + 2OH¯ |
||||||
|
|
|
2 |
|
|
|
|
|
4 |
|
|
|||
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Составление уравнения реакции
K2(S5) + O3 + H2O S + O2
методом электронно-ионного баланса
K2(S5) + O3 + H2O S + O2
вос-ль ок-ль среда нейтральная
Ионная схема реакции |
|
|
|
|
|
|
|
|
|
||||
|
2K+ + (S )2- + O |
3 |
+ H O S + O |
2 |
|||||||||
|
|
|
|
5 |
|
|
|
2 |
|
|
|||
Электронно-ионная схема и ионное уравнение |
|
||||||||||||
2- |
|
e |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
(S5) - 2 |
= 5S |
|
|
|
|
|
1 |
|
окисление |
||||
|
|
|
|
|
|
|
|||||||
O3 + H2O + 2 |
e |
= O2 |
+2OH |
|
|
1 |
|
восстановление |
|||||
|
|
|
|||||||||||
уравнение баланса зарядов: х( |
1) = 2; |
х = 2 |
|||||||||||
(S5)2- + O3 + H2O = 5S + O2 +2ОН
Молекулярное уравнение
K2(S5) + O3 + H2O = 5S + O2 + 2KOH
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Составление уравнения реакции
K |
2 |
Cr O + NaNO +… Cr3+ + NO |
|
||||||||||||||||||||||
|
|
2 |
7 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
||||||
методом электронно-ионного баланса |
|||||||||||||||||||||||||
|
|
|
|
|
|
6 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
3 |
|
5 |
|
|
|
|
|
|
K |
2 |
Cr |
2 |
O |
7 |
Na N O |
2 |
|
... Cr |
|
N O |
|
||||||||||
|
|
|
|
|
3 |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
ок-ль |
|
|
|
|
|
вос-ль |
|
|
|
среда не задана |
|
|
|
|
||||||
2K+ + Cr O |
2- + Na+ |
+ NO +… Cr3+ + NO |
|
|
|
|
|
||||||||||||||||||
|
|
2 |
7 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
||
Cr2O7 |
2- |
|
+ 14H |
+ |
+ 6 |
e |
= 2Cr |
3+ |
+ 7H2O |
|
1 |
|
|
|
восстановление |
||||||||||
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
NO |
+ 2OH ¯ - 2 e = NO |
+ H O |
|
3 |
|
|
|
окисление |
|||||||||||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
2 |
|
|
|
|
|
|
|
|
Cr O 2- + 3NO |
|
|
|
|
+ 10H O |
||||||||||||||||||||
+ 14H+ + 6OH¯ = 2Cr3+ + 3NO |
|||||||||||||||||||||||||
|
2 |
7 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
6H O + 8H+ |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
Ионное уравнение |
|
|
|
+ 8H+ = 2Cr3+ |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
Cr O 2- |
|
+ 3NO |
|
+ 3NO |
+ 4H O |
|
|||||||||||||||||
|
|
|
|
|
2 |
7 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
2 |
|
|
Среда кислая , для ее создания используют H2SO4 (разб)
K2Cr2O7 + 3NaNO2 + 4H2SO4 = Cr2(SO4)3 + 3NaNO3 + K2SO4 + 4H2O
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Заключение
Основными способами составления уравнений окислительновосстановительных реакций являются методы электронного и электронно-ионного баланса
Все способы составления уравнений окислительновосстановительных реакций основаны на равенстве числа электронов, отданных восстановителем, и принятых окислителем (электронном балансе)
Метод электронно-ионного баланса (или электронно-ионных полуреакций) используют при составлении уравнений реакций, протекающих в растворе
В электронно-ионные уравнения полуреакций помимо окислителя и восстановителя, в зависимости от среды, включают ионы H+, OH¯ и молекулы H2O
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций

ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Рекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Высш. шк.,
1994
Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия,
2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 2007
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы неорганической химии. Под ред. Ю. Д. Третьякова. - М.: Академия, 2004
Лидин Р.А. Задачи по общей и неорганической химии. - М.: ВЛАДОС, 2004
Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах, формулах, химических реакциях. - СПб.: Лань, 2000
Модуль 4. Лекция 16. Составление уравнений окислительно-восстановительных реакций

Строение
атома



Основные определения
Атом – наименьшая частица химического элемента, способная к самостоятельному существованию и являющаяся носителем его свойств.
Атом – система взаимодействующих элементарных частиц, состоящая из ядра, образованного протонами и нейтронами, и электронов. В ядре сосредоточена основная масса атома.
Название |
масса, кг |
масса, |
заряд, |
заряд, Кл |
частицы |
|
а.е.м. |
усл.ед |
|
|
|
|
|
|
Протон |
1,6726·10-27 |
1,00728 |
+1 |
1,6·10-19 |
Нейтрон |
1,6749·10-27 |
1,00867 |
0 |
0 |
Электрон |
9,109·10-31 |
5,468·10-4 |
-1 |
-1,6·10-19 |
А.е.м. – атомная единица массы – 1/12 часть массы наиболее распространенного естественного стабильного изотопа углерода 12С.

Основные определения
Химический элемент – совокупность атомов с одинаковым зарядом ядра.
A |
|
Z |
Э |
|
|
А – массовое число
Z – заряд ядра атома (число протонов в ядре), соответствует порядковому номеру элемента в периодической системе
А = Z + N, где N – число нейтронов.
Изотопы – атомы с одинаковым зарядом ядра, но разным массовым числом (разное число нейтронов). В химическом отношении изотопы являются неразличимыми атомами. Например, 1735Cl, 1736Cl, 1737Cl
Изобары – атомы с одинаковым массовым числом, но разным зарядом. Например, 1840 Ar, 1940 K , 2040Ca


Модель атома Бора
Постулаты Бора
1.Электрон может вращаться вокруг ядра не по любым орбитам, а только по некоторым круговым орбитам. Эти орбиты получили название стационарных. Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии.
2.Излучение происходит при скачкообразном
переходе электрона с одной стационарной  h
h
орбиты на другую. |
При этом испускается |
+ |
||||
или поглощается квант электромагнитного |
||||||
|
||||||
излучения, |
энергия |
которого |
равна |
Eni |
||
разности энергий |
атома |
в конечном и |
||||
исходном состояниях. |
|
|
Enj |
|||
Enj – Eni = h

Модель атома Бора
Достоинства модели
1.Бор вычислил уровни энергии электрона в атоме водорода. En = -13,6/n2, где n – номер орбиты.
Энергия электрона возрастает по мере удаленности орбиты от ядра. Отрицательный знак энергии означает устойчивость системы, которая тем более устойчива, чем ниже ее энергия.
2.Бор вычислил радиусы «дозволенных орбит».
r1 |
= 0,529 Å, |
1 Å (1 ангстрем) = 10-10 м. |
rn = 0,529n2. |
|
|
3.Рассчитанные частоты из соотношения E = h совпали с данными полученными из атомных спектров атома водорода и некоторых других частиц с одним электроном, например, Не+.

Модель атома Бора
Недостатки модели
1.Модель не может объяснить, почему происходит квантование и почему электрон на орбите не излучает энергию, как того требует электродинамика. Оба эти свойства были постулированы.
2.Теоретические и экспериментальные данные совпадали для частиц, содержащих один электрон, но теория не могла объяснить спектральные характеристики многоэлектронных атомов, даже для самого простого случая – атома Не.
3.Теорию оказалось невозможным применить для объяснения химической связи.

Квантово-механическая модель атома
Основные предпосылки
1.Энергия в микромире поглощается или излучается дискретно в виде квантов (М. Планк)
2.Все микрочастицы имеют двойственный характер.
Электрон подобно фотону можно рассматривать и как частицу и как волну.
Уравнение де Бройля = h/mv, где m и v – масса и скорость частицы.
3. Принцип неопределенности (Гейзенберг).
Согласно этому соотношению невозможно одновременно точно определить местоположение частицы и ее импульс. Соотношение неопределенностей имеет вид:
x p h/2 , где x – неопределенность координаты,p – неопределенность импульса.

Квантово-механическая модель атома
Уравнение Шредингера:
(x, y, z) |
2m |
(E U )(x, y, z) 0 |
||
|
2 |
|||
|
|
|||
|
|
|
||
где
|
|
2 |
|
|
2 |
|
|
2 |
|||
|
|
|
|
|
|
||||||
|
x |
2 |
|
y |
2 |
|
z |
2 |
|||
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||
– оператор Лапласа,
– волновая функция (пси-функция), m – масса частицы,
U – потенциальная энергия, Е – полная энергия,
ħ = h/2 .
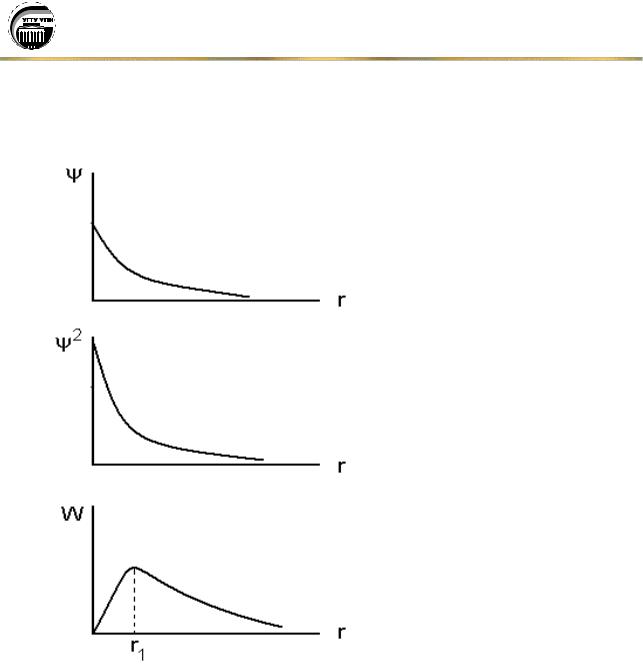
Квантово-механическая модель атома
Атом водорода
Ψ2 – плотность вероятности обнаружения электрона вблизи заданной точки
W= Ψ24 r2dr – вероятность нахождения электрона в объеме dV (сферический слой толщиной dr на расстоянии r от ядра)
r1 = 0,529 Å

Квантово-механическая модель атома
Выводы из решения уравнения Шредингера
1.Из решения уравнения Шредингера автоматически вытекает существование дискретных уровней энергии, то есть квантованность энергетических состояний оказывается следствием присущих электрону волновых свойств.
2.Электрон может находиться в любой части пространства, окружающего ядро, но вероятность его пребывания в той или иной части неодинакова. Область пространства, в которой с вероятностью 90–95 % можно обнаружить электрон получила название атомной орбитали.
3.Решение уравнения Шредингера приводит непосредственно к трем квантовым числам, которые характеризуют энергетическое состояние и поведение электрона в атоме.

Квантовые числа
n – главное квантовое число
l – орбитальное квантовое число ml – магнитное квантовое число ms – спиновое квантовое число.
Первые три квантовых числа (n, l, ml) следуют из решения уравнения Шредингера и полностью описывают атомную орбиталь.
Энергетическое состояние электрона в атоме полностью описывается набором из четырех квантовых чисел

Квантовые числа
Главное квантовое число
Принимает целочисленные значения: n = 1, 2, 3… .
Характеризует основной уровень энергии электрона и размер электронного облака.
В многоэлектронных атомах совокупность электронов с одинаковым значением главного квантового числа называется электронным слоем.
Главное квантовое число n |
1 |
2 |
3 |
4 |
5 |
6 |
… |
|
|||||||
(номер энергетического уровня) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Буквенное обозначение |
K |
L |
M |
N |
O |
P |
… |
|
|||||||
электронного слоя |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Квантовые числа
Орбитальное квантовое число
принимеат целочисленные значения от 0 до (n – 1):
l = 0, 1, …, (n-1).
В многоэлектронных атомах совокупность электронов с одинаковым значением орбитального квантового числа называется электронной оболочкой.
Орбитальное квантовое |
0 |
1 |
2 |
3 |
4 |
5 |
… |
число l |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Буквенное обозначение |
s |
p |
d |
f |
g |
h |
… |
подуровня |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Квантовые числа
Орбитальное квантовое число
Определяет форму атомной орбитали
l=0 |
l=1 |
l=2 |
s-орбиталь |
р-орбиталь |
d-орбиталь |

Квантовые числа
Магнитное квантовое число
Характеризует результат взаимодействия магнитного поля движущегося электрона с наложенным внешним магнитным полем
Принимает целочисленные значения от –l до +l: ml = –l, …, 0, …, +l
Определяет дискретные возможные ориентации атомных орбиталей в пространстве.
Число возможных значений ml при данном значении l соответствует числу способов ориентации орбиталей в пространстве

Квантовые числа
Магнитное квантовое число
l = 0, ml = 0
l = 1, ml =-1, 0, 1
z |
pz |
y |
py |
px |
x |
l = 2, |
ml =-2, -1, |
0, 1, 2 |
y |
|
z |
|
x |
x |
|
d xy |
d xz |
z |
y |
|
|
|
|
y |
x |
|
d yz |
d x2 – y2 |
z |
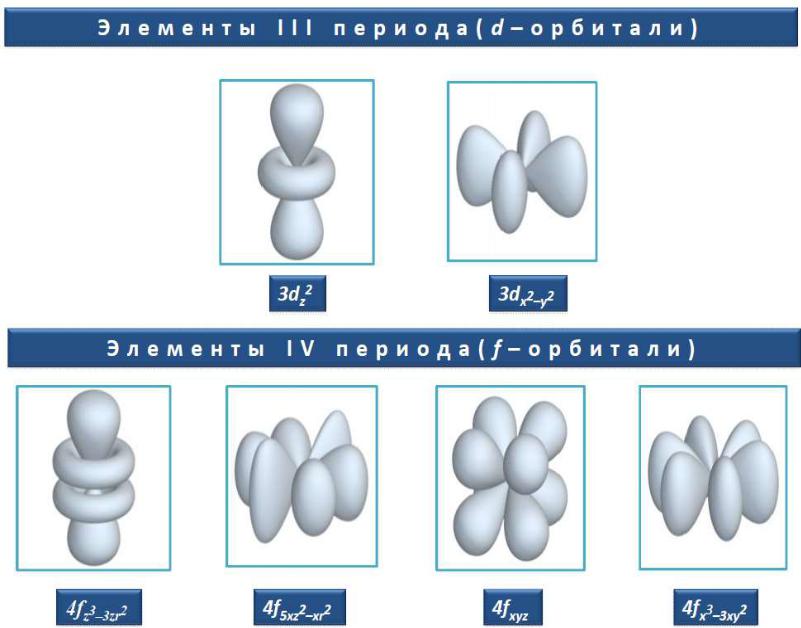

Квантовые числа
Спиновое квантовое число
Характеризует собственный момент количества движения электрона
ms = +1/2 Если направление спина электрона совпадает с направлением орбитального магнитного момента
ms = -1/2 Если противонаправлен

Строение многоэлектронных атомов
1. Принцип минимума энергии
Правило Клечковского: Увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел (n+l), а при равной сумме (n+l) в порядке возрастания числа n.
2.Принцип Паули
Ватоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел
На одной атомной орбитали могут размещаться только два электрона, отличающиеся спиновыми характеристиками:

Строение многоэлектронных атомов
1. Правило Гунда
Электроны в пределах одного подуровня распределяются таким образом, чтобы их суммарный спиновый момент был максимален (стремятся остаться неспаренными)
|
|
|
|
р2 |
|
|
|
|
|
||
р3 |
|
|
|
|
|
|
|
р4 |
|
|
|
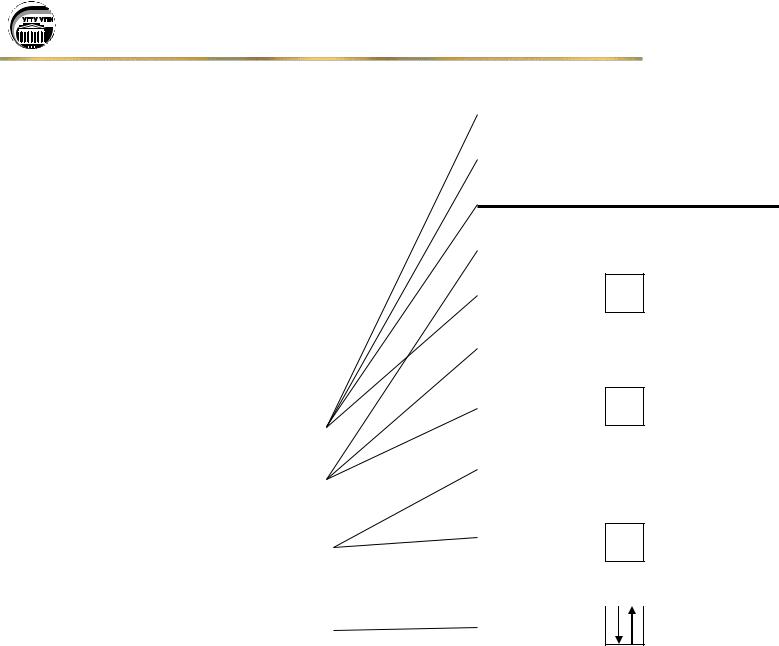
Строение многоэлектронных атомов
|
|
|
ml= |
-3 -2 -1 |
0 |
+1+2 +3 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
n=4, l=3 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n=4, l=2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n=4, l=1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n=3, l=2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n=4, l=0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n=3, l=1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n=4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
n=3, l=0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
n=2, l=1 |
||
n=3 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
ml= |
|
|
|
|
|
|
|
||||
|
||||||||||||||
|
|
|
|
|
-1 |
0 |
+1 |
|
|
|
||||
n=2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
n=2, l=0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|||||||||||||
n=1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
n=1, l=0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
ml=0

Строение многоэлектронных атомов
I период
H |
1s1 |
s-элементы |
|
He |
1s2 |
||
|
II период |
|
||
Li |
1s22s1 |
s-элементы |
|
Be |
1s22s2 |
||
|
|||
B 1s22s22p1
С 1s22s22p2 p-элементы
…………………
Ne 1s22s22p6

Строение многоэлектронных атомов
III период
Na |
1s22s22p63s1 |
s-элементы |
|
Mg |
1s22s22p63s2 |
||
|
Al 1s22s22p63s23p1
……………………… p-элементы
Ar 1s22s22p63s23p6
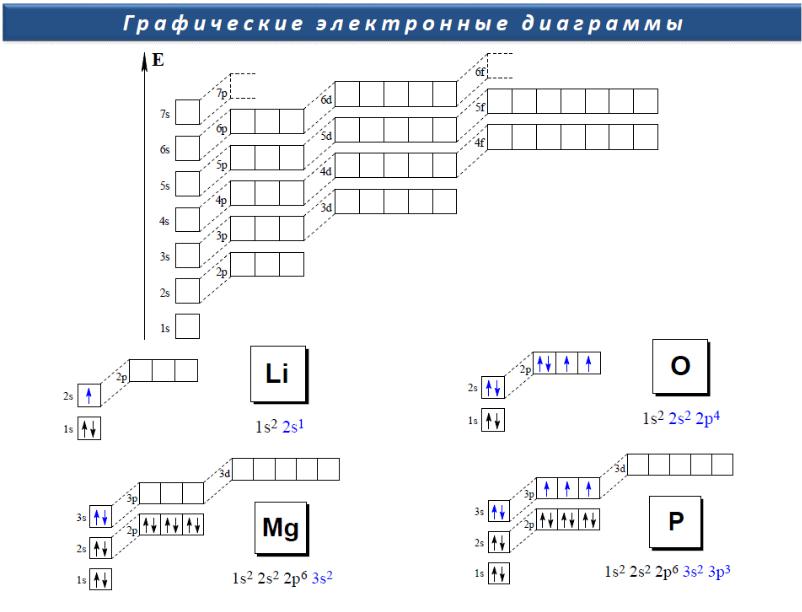

Строение многоэлектронных атомов
IV период
K |
…..4s1 |
s-элементы |
|
Ca |
…..4s2 |
||
|
Sc ….3s23p63d14s2
……………………….
Cr ….3s23p63d54s1 Mn ….3s23p63d54s2
……………………….
Cu ….3s23p63d104s1 Zn ….3s23p63d104s2
Ga ….3s23p63d104s14p1
……………………….
Kr ….3s23p63d104s14p6
d-элементы
p-элементы

Строение многоэлектронных атомов
VI период
Cs |
….4d105s25p66s1 |
s-элементы |
|
Ba |
….4d105s25p66s2 |
||
|
|||
La |
….4d105s25p65d16s2 d-элемент |
||
Сe |
….4d104f25s25p65d06s2 |
||
Pr |
….4d104f35s25p65d06s2 |
||
………………………………
Gd ….4d104f75s25p65d16s2 f-элементы Tb …. 4d104f95s25p65d06s2
………………………………
Lu ….4d104f145s25p65d16s2
Hf ….4d104f145s25p65d26s2
………………………………
Hg |
………………...5d106s2 |
Tl |
………………...5d106s26p1 |
…………………………………. |
|
Rn |
…..…………….5d106s26p6 |
d-элементы
 p-элементы
p-элементы

Строение многоэлектронных атомов
1.Каждый новый период начинается с заполнения нового слоя.
2.Каждый период начинается с s-элементов, они находятся в
I, II группах, а заканчивается р-элементами, которые находятся в III – VIII группах (кроме 1 периода). Последний из р-элементов каждого периода – инертный газ с устойчивой восьмиэлектронной конфигурацией внешнего слоя ns2p6. Инертные газы характеризуются наивысшими энергиями ионизации.
3. s- и p- элементы образуют главные подгруппы ПСЭ (подгруппы А). d-элементы – побочные подгруппы (подгруппы Б)

Строение многоэлектронных атомов
4.У s- и p- элементов заполняется внешний слой. Число электронов на внешнем слое равно номеру группы.
5.У d-элементов заполняется d-подуровень предвнешнего слоя – …(n-1) s2p6d1 10ns2.
•У f-элементов заполняется f-подуровень предпредвнешнего слоя – …(n-2)s2p2d10f2 14(n-1)s2p6d1(0)ns2.
•Элементы VII все радиоактивны, начиная с Np, все изотопы элементов получены искусственным путем в ходе ядерных реакций.
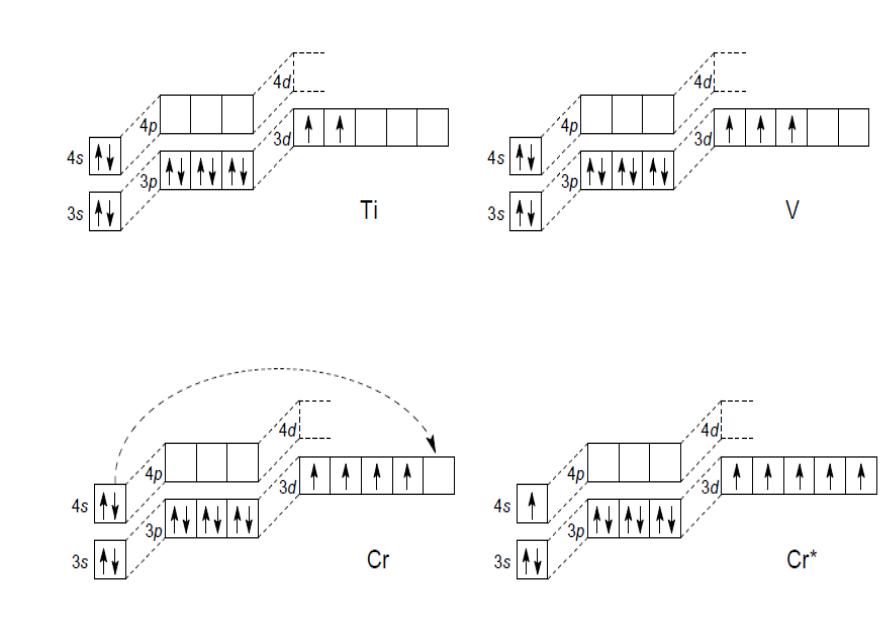
Изменение свойств элементов в
свете Периодического закона
Современная формулировка периодического закона:
Свойства элементов, а так же состав и свойства их соединений находятся в периодической зависимости от заряда ядра.
С увеличением заряда ядра атомов наблюдается закономерное изменение в их электронной структуре.
Происходит закономерное изменение химических и тех физических свойств атомов элементов, которые зависят от электронного строения:
•радиус атома или иона
•энергия ионизации
•температуры плавления, кипения
•и др
Изменение свойств элементов в
свете Периодического закона
Изменение атомных радиусов
Орбитальный радиус атома – расстояние от ядра до наиболее удаленного максимума электронной плотности.
Эффективный радиус – 1/2 межъядерного расстояния для рассматриваемого элемента в кристалле.
r, нм |
|
|
Cs |
Fr |
0,26 |
|
Rb |
|
|
K |
|
|
||
|
|
|
|
0,22
Na 0,18 Li 
0,14
0,10
0,06
0,02
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Z |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
|||||||||||
|
|||||||||||||||||||

Изменение свойств элементов в
свете Периодического закона
Изменение энергии ионизации
Энергия ионизации (I) – это та энергия, которую необходимо затратить, чтобы отделить электрон от атома (нейтрального, невозбужденного, газообразного) и увести его в бесконечность.
Э – е Э+ |
I |
Э+ – е Э2+ |
1 |
I |
|
|
2 |
…………………
I1 < I2 < ………
По периоду (слева направо) потенциал ионизации растет, что связано с уменьшением радиуса атомов.
В главных подгруппах потенциал уменьшается сверху вниз, что связано с возрастанием радиуса и эффектом экранирования ядра внутренними устойчивыми оболочками s2p6.

Изменение свойств элементов в
свете Периодического закона
Изменение энергии сродства к электрону
Энергия сродства к электрону (Е) – это та энергия, которая выделяется при присоединении электрона к нейтральному невозбужденному атому с образованием отрицательно заряженного иона.
По периоду (слева направо) сродство к электрону элементов возрастает.
В главных подгруппах сродство к электрону уменьшается сверху вниз.

Изменение свойств элементов в
свете Периодического закона
Изменение электроотрицательности
Электроотрицательность позволяет оценить способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения.
Неметаллы – имеют наибольшие значения ОЭО (прочно удерживают свои электроны и легко принимают чужие)
Металлы имеют малые значения ОЭО и легко отдают свои электроны
По периоду ЭО увеличивается По главным подгруппам – уменьшается

Изменение свойств элементов в
свете Периодического закона
Изменение химических свойств
F |
2s22p5 |
|
|
Cl |
2s22p63s23p5 |
электронные |
|
Br |
3s23p63d104s24p5 |
аналоги |
|
полные аналоги |
|||
I |
4s24p64d105s25p5 |
||
|
Неполные электронные аналоги |
|
|
|
|
|
|
|
|
|||
Cl |
2s22p63s23p5 |
Cl (+7) |
2s22p6 |
Cl |
O |
|
HClO |
|
КClO |
4 |
|
|
|
|
|
2 |
|
7 |
|
4 |
|
|
|
Mn |
3s23p63d54s2 |
Mn(+7) |
3s23p6 |
Mn |
O |
7 |
HMnO |
4 |
КMnO4 |
||
|
|
|
|
|
2 |
|
|
|
|
||

Изменение свойств элементов в
свете Периодического закона
Изменение химических свойств
Нарастание неметаллических свойств
Элемент |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
|
типичный |
|
|
|
|
|
типичный |
|
металл |
|
|
|
|
|
неметалл |
|
|
|
|
|
|
|
|
Высший |
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
Cl2O7 |
оксид: |
основн. |
основн. |
амфотерн |
кислотн. |
кислотн |
кислотн. |
кислотн. |
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
Гидрат |
NaOH |
Mg(OH)2 |
Al(OH)3 |
H2SiO3 |
H3PO4 |
H2SO4 |
HClO4 |
оксида: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Литература
1.Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н. Л. Глинка ; под ред. А. И. Ермакова. - Изд. 30-е, испр. - М.: Интеграл-Пресс, 2004. - 728 с.: ил.
2.Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах, формулах, химических реакциях: Учеб. пособие / А.П. Гаршин. - 2-е изд., испр. и доп. - СПб.: Лань, 2000. - 288 с.
3.Карапетьянц М.Х. Общая и неорганическая химия: Учебник для студентов вузов / М.Х. Карапетьянц, С.И. Дракин. - 4-е изд., стер. - М.:
Химия, 2000. - 592 с.: ил.
4.Угай Я.А. Общая и неорганическая химия: Учебник для студентов вузов, обучающихся по направлению и специальности "Химия" / Я.А. Угай. - 2-е изд., испр. - М.: Высшая школа, 2000. - 527 с.: ил.
5.Неорганическая химия: учебник для студентов вузов, обучающихся по направлению 510500 "Химия" и специальности 011000 "Химия" : в 3 т. Т. 1: Физико-химические основы неорганической химии / М. Е. Тамм, Ю. Д. Третьяков / под ред. Ю. Д. Третьякова. - М.: Академия, 2004. -
240 с.: ил.

Литература
6.Неорганическая химия: учебник для студентов вузов, обучающихся по направлению 510500 "Химия" и специальности 011000 "Химия" : в 3 т. Т. 2: Химия непереходных элементов / А. А. Дроздов, В. П. Зломанов, Г. Н. Мазо, Ф. М. Спиридонов / под ред. Ю. Д. Третьякова. - М.:
Академия, 2004. - 368 с.: ил.
7.Заградник Р., Полак Р. Основы квантовой химии. Пер с чешс. – М.:
Мир, 1979. – 504 с.
8.Хабердитцл В. Строение материи и химическая связь. Пер. с нем. – М.:
Мир, 1974. – 296 с.
9.Гиллеспи Р., Харгиттаи И. Модель отталкивания электронных пар валентной оболочки и строение молекул: Пер. с. англ. – М.: Мир, 1992.
– 296 с.
Химическая
связь

УМК «ХИМИЯ»
Тема лекции: Химическая связь
Лектор – Иванов М.Г.
Разработчик – Данилова Д.А.

Цель лекции:
изложение проблемы химической связи и
строения молекул в рамках современной
химической теории
Компетенции, формируемые у студента:
Умения:
прогнозировать на основе положения элементов в Периодической системе, а также современных представлений о строении атомов и химической связи, свойства s-, p-, d –элементов и их соединений.

СОДЕРЖАНИЕ
Виды химической связи Ковалентная связь
квантово-механическое описание строения молекул метод валентных схем механизмы образования ковалентной связи свойства связи
энергия связи длина связи
направленность связи геометрия простейших молекул гибридизация
кратность связи насыщаемость связи
валентные возможности элементов правила составления валентных схем
полярность связи полярность молекул степень окисления
Ионная связь Металлическая связь Водородная связь
Силы межмолекулярного взаимодействия

Химическая связь |
содержание |
|
Химическая связь – это различные виды взаимодействия, обуславливающие устойчивое существование многоатомных соединений (молекул, ионов, кристаллических веществ и т.д.)
Виды химической связи
Ковалентная
Ионная
Металлическая
Водородная
Силы межмолекулярного взаимодействия
(Силы Ван-дер-ваальса)
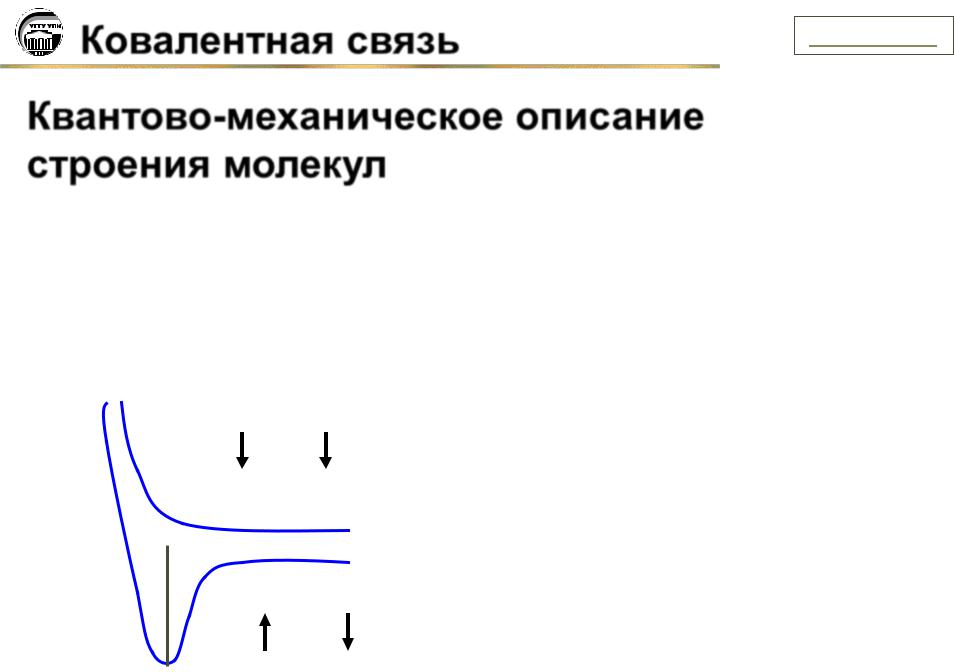
Ковалентная связь |
содержание |
|
Квантово-механическое описание
строения молекул
Воснове лежит решение волнового уравнения Шредингера для соответствующей системы.
В1927 году В. Гейтлер и Ф. Лондон впервые провели расчет потенциальной энергии системы, состоящей из двух атомов водорода, в зависимости от расстояния между ядрами.
Е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
+ |
|
|
Н |
Е – потенциальная энергия системы |
|||
|
|
|
|
|
|
|
|
|
|
|
|
Е0 – энергия системы, состоящей из двух |
Е0 |
|
r0 |
|
|
|
|
|
|
|
невзаимодействующих атомов |
||
|
|
|
|
|
|
|
|
|
r |
r – расстояние между ядрами |
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Н |
|
|
+ |
|
|
Н |
r0 – длина связи |
|||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|

Ковалентная связь |
|
содержание |
|
|
|
Квантово-механическое описание
строения молекул
Образование химической связи между атомами в молекуле Н2 обусловлено тем, что движение электронов с антипараллельными спинами около обоих ядер приводит к перекрыванию электронных орбиталей и росту электронной плотности в межъядерном пространстве.
Н2 |
Орбитальная диаграмма |
Валентная схема |
|
||
Н 1s1 |
|
Н - Н |
Н 1s1 |
|
Такая связь называется ковалентной

Ковалентная связь |
содержание |
|
Метод валентных связей (ВС)
В основе метода ВС лежат следующие допущения
Ковалентная химическая связь образуется двумя электронами (общая электронная пара)
Каждая электронная пара находится в поле действия двух ядер взаимодействующих атомов
Ковалентная связь образуется путем перекрывания валентных электронных орбиталей взаимодействующих атомов. Между ядрами появляется область повышенной электронной плотности, которая стягивает положительно заряженные ядра

Ковалентная связь |
содержание |
|
Механизмы образования ковалентной
связи
1. Обменный механизм
Атомы предоставляют на образование химической связи одноэлектронные орбитали, которые перекрываются
А |
+ |
В |
А В |
А |
|
В |
А : В |
|
2. Донорно-акцепторный механизм
Один атом предоставляет двухэлектронную орбиталь (донор) Другой атом предоставляет свободную орбиталь (акцептор)
А |
+ |
В |
А В |
А В |
А : В |
донор |
|
акцептор |
|
|
|

Ковалентная связь |
содержание |
|
Свойства связи
Энергия связи
Длина связи
Направленность химической связи
Кратность связи
Насыщаемость связи
Полярность связи

Ковалентная связь |
содержание |
|
1. Энергия связи
Энергия связи – энергия, которая выделяется при образовании химической связи из нейтральных газообразных атомов
H0 |
хим. св. |
< 0 |
[кДж/моль] |
|||
|
|
|
|
|
||
H + H = H |
2 |
H0 |
хим. св. |
= - 435 кДж/моль |
||
|
|
|
|
|||
2. Длина связи
Длина связи – расстояние между ядрами атомов в молекуле
длина связи < ra1 + ra2

Ковалентная связь |
содержание |
|
3. Направленность химической связи
Поскольку электронные орбитали направлены в пространстве определенным образом, то и химические связи в молекулах, образуемых с их участием тоже направлены друг относительно друга под определенными углами, которые называются валентными
углами
Таким образом, в соединениях, содержащих более двух атомов, важной характеристикой является валентный угол, образуемый химическими связями в молекуле и отражающий ее геометрию.

Ковалентная связь |
содержание |
|
|
Геометрия простейших молекул |
|
|
SF2
S ... 3s2 3p4
F ... 2s2 2p5
F ... 2s2 2p5
S
F
F
 2 одноэлектронные орбитали 2 связи по обменному механизму
2 одноэлектронные орбитали 2 связи по обменному механизму
1 одноэлектронная орбиталь
1 связь по обменному механизму
S F
валентный угол 900
F
Геометрическая форма молекулы – угол
Ковалентная связь |
содержание |
|
|
Геометрия простейших молекул |
|
|
РН3
Р ... 3s2 3p3 Н 1s1
Н 1s1 Н 1s1
|
|
|
|
|
валентный угол 900 |
|
|
|
|
|
|
|
Р |
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
Н |
|
Н |
|
Геометрическая форма молекулы – |
|
|
|
треугольная пирамида |
|||
|
|
|
|
||

Ковалентная связь |
содержание |
|
|
Теория гибридизация |
|
|
Гибридизация – это представление о выравнивании валентных атомных орбиталей по форме и по энергии
Основные положения теории гибридизации
В процессе гибридизации могут участвовать любые орбитали: свободные, одноэлектронные, двухэлектронные
Гибридных орбиталей образуется столько же, сколько атомных орбиталей участвует в процессе гибридизации
Гибридные орбитали имеют форму несимметричной гантели
Гибридные орбитали располагаются в пространстве симметрично, отталкиваясь на максимально возможные равные углы
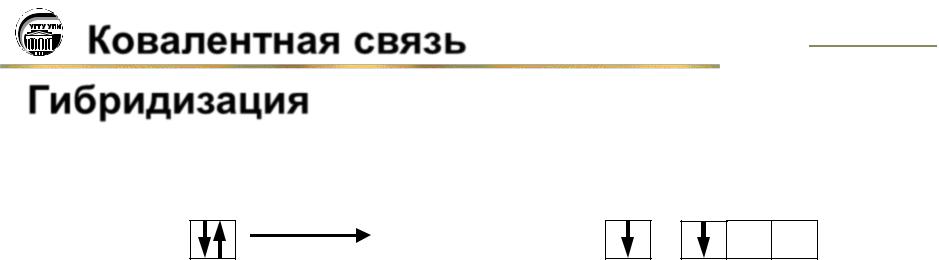
Ковалентная связь |
содержание |
|
|
Гибридизация |
|
|
BeCl2
Be ...2s2 |
Be* ...2s1 2p1 |
Be* - может образовать две связи по обменному механизму
BeCl2
обе связи абсолютно равноценные, следовательно и орбитали бериллия, образующие эти связи должны быть равноценны
валентный угол равен 1800 (молекула линейная)
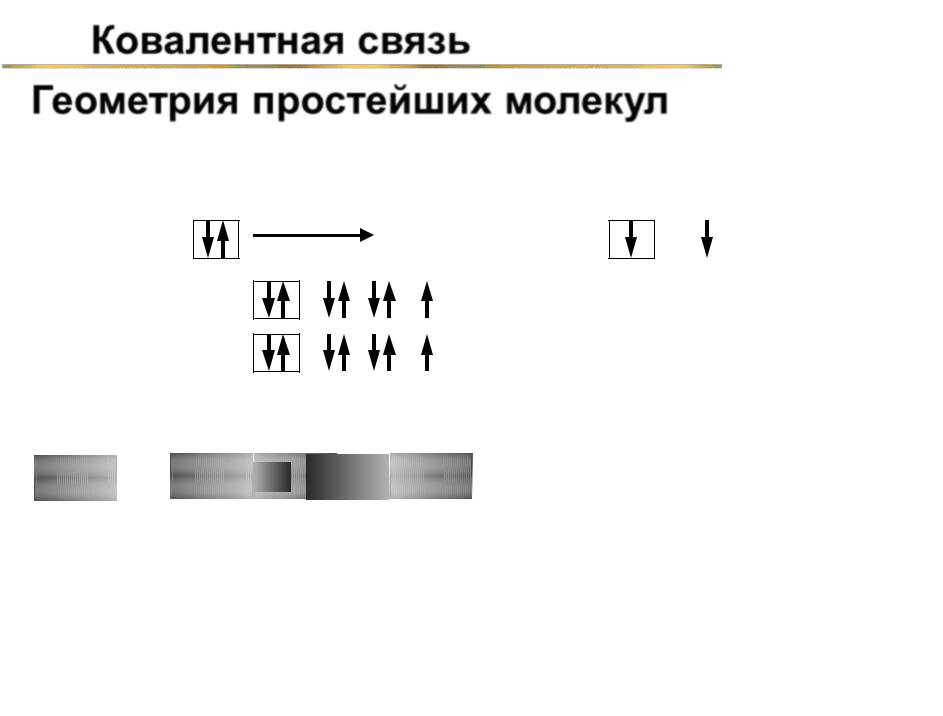
Ковалентная связь |
содержание |
|
|
Геометрия простейших молекул |
|
|
BeCl2 |
|
|
|
|
sp – гибридизация q2 |
||||
|
|
|
|
|
|
|
|
||
Be ...2s2 |
Be* ...2s1 2p1 |
|
|
|
|
||||
Сl ... 3s2 |
3p5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Cl ... 3s2 |
3p5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Cl |
Ве |
Cl |
|
Cl |
|
Be |
|
Cl |
|
|
валентный угол 1800
Геометрическая форма молекулы – линия
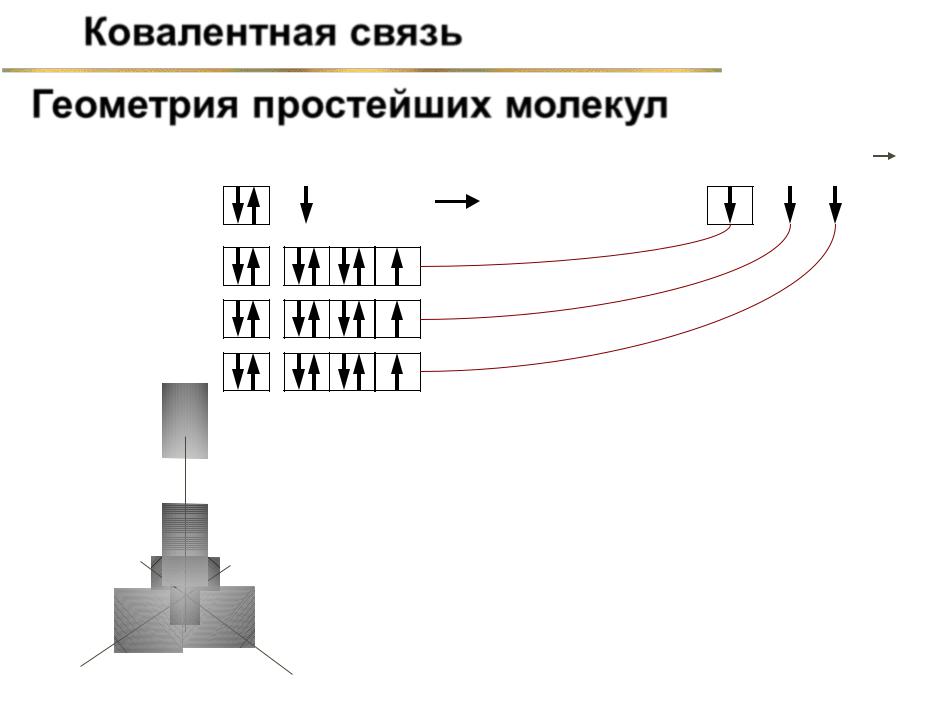
Ковалентная связь |
|
|
|
|
||||||
|
|
|
содержание |
|||||||
|
|
|||||||||
Геометрия простейших молекул |
||||||||||
BF3 |
sp2 – гибридизация q3 |
|||||||||
|
|
|
|
|
|
|||||
B ...2s2 2p1 |
|
|
|
|
B* ...2s1 2p2 |
|
|
|
|
|
F ... 2s2 2p5
F ... 2s2 2p5
F ... 2s2 2p5
F
F
валентный угол 1200
B
B F 
 F
F
F |
F |
Геометрическая форма молекулы – |
|
|
плоский треугольник
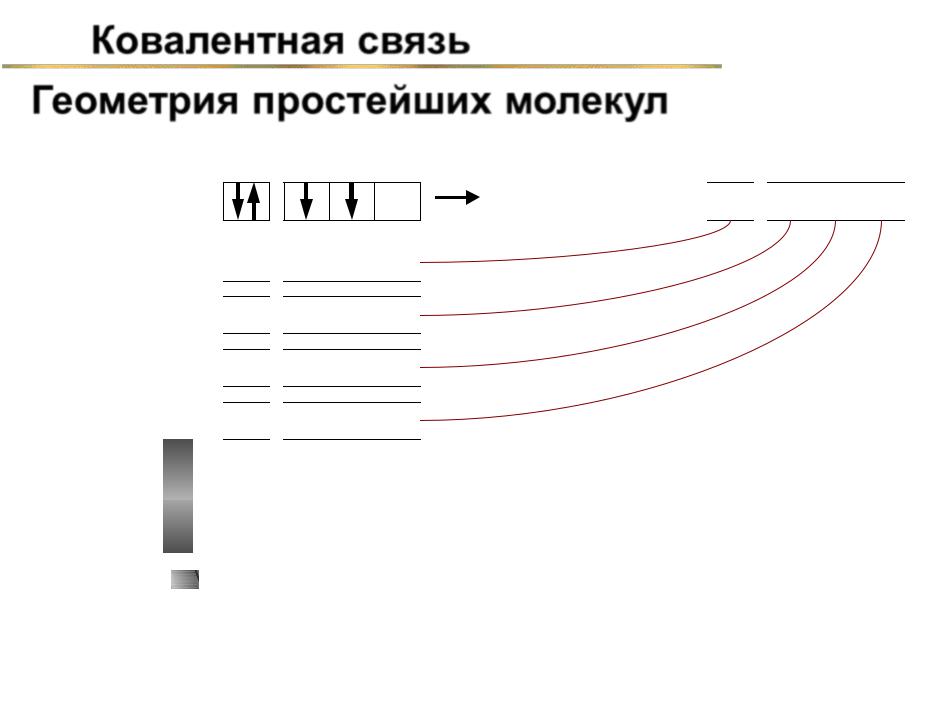
Ковалентная связь |
содержание |
|
|
Геометрия простейших молекул |
|
|
SiCl4
Si ...3s2 3p2
Cl ... 3s2 3p5 



Cl ... 3s2 3p5 









Cl ... 3s2 3p5 









Cl ... 3s2 3p5 









Cl
Si
Cl
Cl 
 Cl
Cl
sp3 – гибридизация  q4
q4
Si* ...3s1 3p3 









Cl
валентный угол 109,50
Si
Cl 
Cl
Cl
Геометрическая форма молекулы – тетраэдр
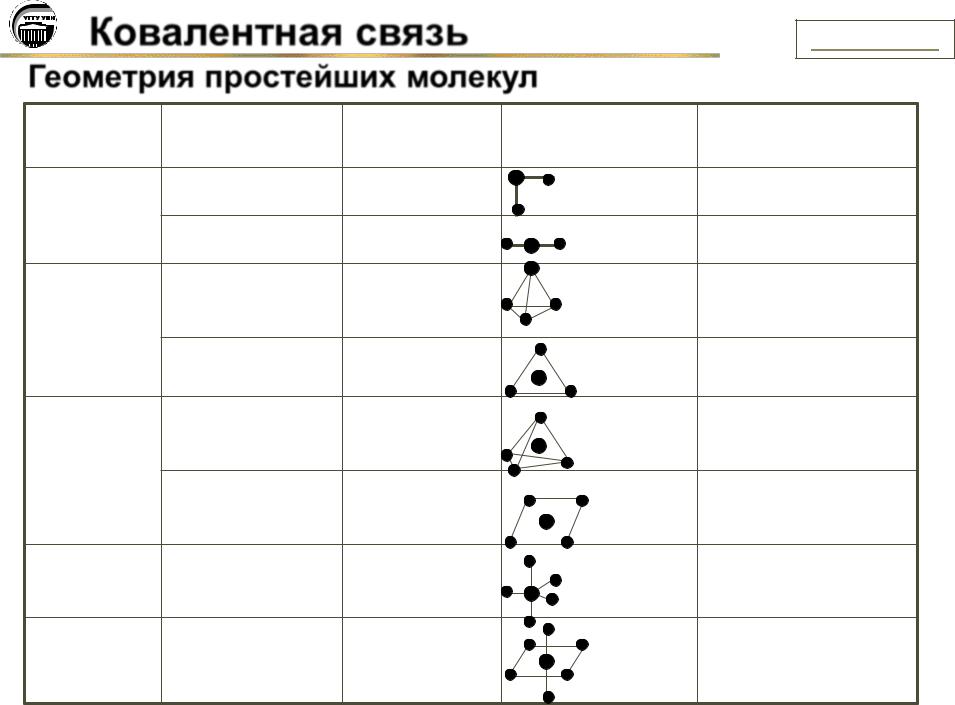
Ковалентная связь |
|
|
содержание |
||||
Геометрия простейших молекул |
|
|
|
|
|||
Тип |
Тип |
Тип |
Геом. форма |
Примеры |
|
|
|
молекулы гибридизации |
орбиталей |
|
|
|
|
|
|
АВ2 |
нет |
р2 |
уголковая |
SF2, SCl2, H2S |
|
|
|
|
sp |
q2 |
линейная |
BeCl2, ZnCl2 |
|
|
|
АВ |
нет |
р3 |
треуг. |
PCl , PH , NCl , |
|
||
3 |
|
|
|
3 |
3 |
3 |
|
|
|
|
пирамида |
AsH3 |
|
|
|
|
sp2 |
q3 |
плоский треуг. |
AlCl3, BF3 |
|
|
|
АВ4 |
sp3 |
q4 |
тетраэдр |
SiCl4, CH4, CF4, |
|
||
|
|
|
CCl , NH +, AlCl |
- |
|||
|
|
|
|
4 |
4 |
4 |
|
|
dsp2 |
q4 |
плоский |
Ni(CN)42- |
|
|
|
|
|
|
квадрат |
|
|
|
|
АВ5 |
sp3d |
q5 |
треуг. би- |
PCl5 |
|
|
|
|
|
|
пирамида |
|
|
|
|
АВ6 |
sp3d2 |
q6 |
октаэдр |
SF6, AlF63- |
|
|
|
|
d2sp3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Ковалентная связь |
|
содержание |
|
|
|
4. Кратность связи
В зависимости от способа перекрывания электронных облаков различают -, -, -связи
-связь – осуществляется при перекрывании облаков вдоль линии соединения атомов. Образуется при перекрывании любых орбиталей.
-связь – возникает при перекрывании облаков по обе стороны от линии соединения атомов. В образовании - связи не могут участвовать s-орбитали и гибридные орбитали.

Ковалентная связь |
содержание |
|
– связь
р - р d - р d - d
Условное обозначение -связи на орбитальных диаграммах

Ковалентная связь |
содержание |
|
|
– связь |
|
|
N2 |
|
|
|
|||||||||||
N |
...2s2 2p3 |
|
|
|
|
|
|
|
|
|
|
|
||
N |
...2s2 2p3 |
|
|
|
|
|
|
|
|
N |
|
N |
||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
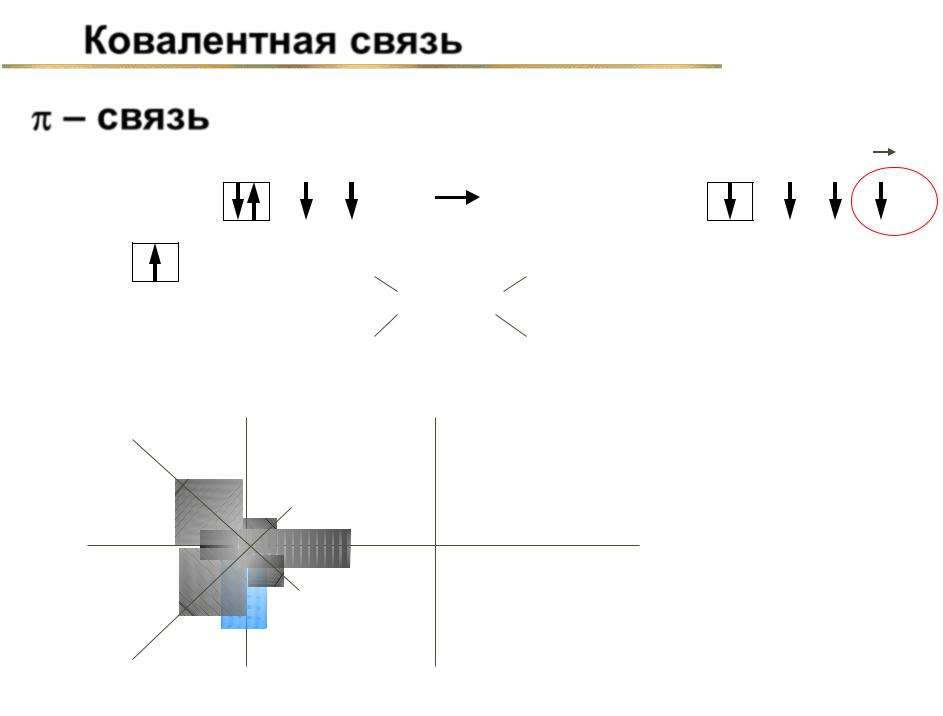
Ковалентная связь |
содержание |
|
|
– связь |
|
|
C2H4 |
sp2 |
– гибридизация q3 |
|
|
C ...2s2 2p2 |
|
|
|
|
|
|
C* ...2s1 2p3 |
|
|
|
|
H 1s1 |
|
H |
|
|
|
H |
на -связь |
||||
|
|
|
|
|
|
|
|||||
|
|
C |
|
C |
|
|
|
|
|||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
H |
|
C |
|
C |
|
|
|
|
||
|
|
|
|
|
|
|
|
||
H |
|
|
|
H |

Ковалентная связь |
содержание |
|
5. Насыщаемость связи. Валентность.
Насыщаемость – способность атома взаимодействовать только с определенным числом атомов других элементов.
Валентность – число ковалентных связей, которые элемент образует или потенциально может образовать.
Валентность определяется:
Числом валентных орбиталей. В первую очередь реализуются одноэлектронные орбитали, затем свободные и двуэлектронные
Доступностью валентных орбиталей для образования химических связей. Конечными размерами взаимодействующих атомов

Ковалентная связь |
содержание |
|
Валентные возможности элементов
I период
H 1s1 |
1 ковалентная связь |
В = 1 |
обменный механизм
H+ 1s0 |
1 ковалентная связь |
В = 1 |
акцептор |
донорно-акцепторный механизм |
|
H- 1s2 |
1 ковалентная связь |
В = 1 |
донор |
донорно-акцепторный механизм |
|

Ковалентная связь |
содержание |
|
Валентные возможности элементов
II период |
Вmax=4 |
|||
|
||||
Be ...2s2 |
Be* ...2s1 2p1 |
|
|
|
2 ковалентные связи по обменному механизму
2 ковалентные связи по донорно-акцепторному механизму
BeCl2 (газ) Be – Cl – Be |
B = 2 |
BeCl2 (крист.) |
Сl |
|
Сl Be |
Сl |
|
Сl |
|
… |
Be |
Сl |
Сl |
Be |
… n |
||
|
|||||||
|
|
|
|
|
Вmax=4
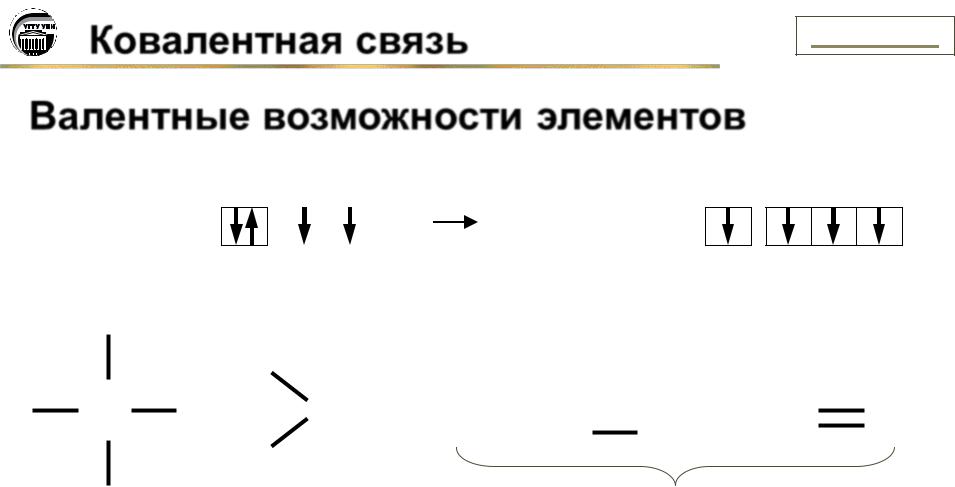
Ковалентная связь |
содержание |
|
Валентные возможности элементов
II период
C ...2s2 2p2 |
|
|
|
C* ...2s1 2p3 |
Вmax=4
C C 
 C
C 
 C
C
sp3 – гибр. |
sp2 – гибр. |
sp – гибр. |
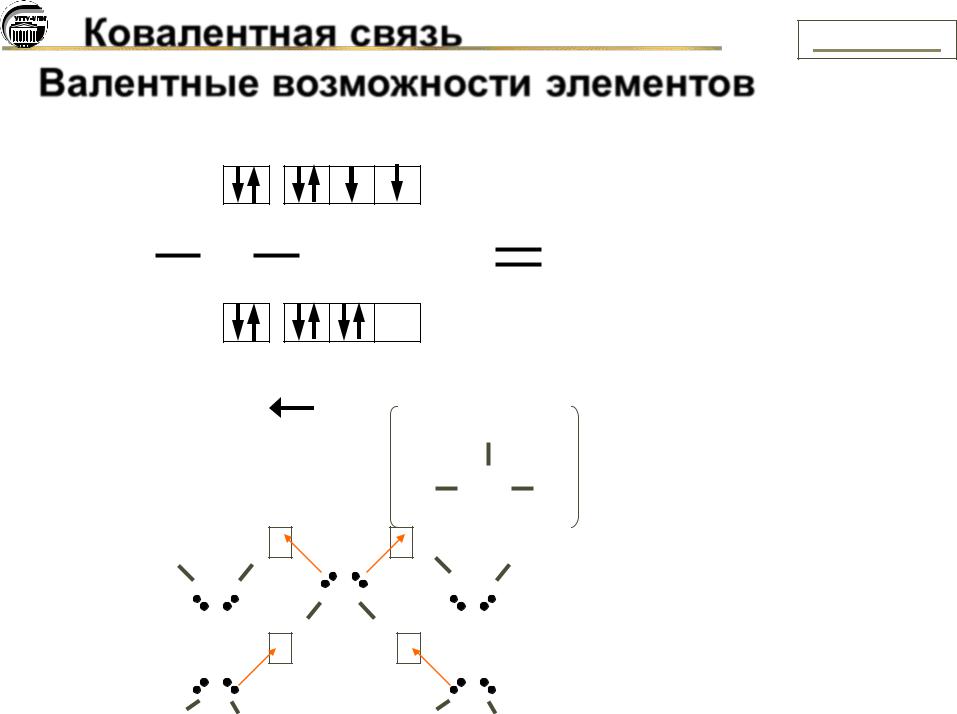
Ковалентная связь |
содержание |
|||||
Валентные возможности элементов |
||||||
II период |
Вmax= 4 |
|
|
|
||
|
|
|
|
|
||
О ...2s2 2p4 |
|
|
|
B = 2 |
обменный механизм |
|
B = 2 |
О |
|
или |
О |
|
|
О* ...2s2 |
2p4 |
|
|
|
B = 1 |
дон. – акц. механизм |
акцептор |
|
|
|
|
|
|
B = 1 |
О* |
|
|
H |
+ |
|
|
|
|
|
|
|
|
B = 3 |
H2O + □H+ → |
H |
O H |
– ион гидроксония |
||
|
|
|
|
|
||
|
H H |
|
H |
H |
|
|
B = 4 |
O |
|
O |
|
O |
|
|
|
|
– лед |
|||
|
|
H |
H |
|
|
|
|
|
|
|
|
||
|
O |
|
|
|
O |
|

Ковалентная связь |
содержание |
|
Валентные возможности элементов
III период |
|
|
|
|
|
|
|
|||
s |
|
p |
|
|
|
d |
– 9 валентных орбиталей |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Практически В = 9 не достигается, и образуется не более шести связей. Вmax ≤ 6
[AlF6]3-, [SiF6]2-, PCl5, SF6
IV период
Вmax ≤ 4
AsO43-, SeO42-, BrO4-
IV период
Вmax ≤ 6
Sb(OH)6-, TeO66-, IO65-

Ковалентная связь |
содержание |
|
Валентные возможности элементов
Координационное число – число атомов соседей данного элемента
max к.ч. = Вmax
CH4 B = 4 – max
к.ч. = 4 – max
C2H4 B = 4 – max
к.ч. = 3
NH3 B = 3
к.ч. = 3
валентно насыщенное
координационно насыщенное
валентно насыщенное
координационно ненасыщенное
валентно ненасыщенное
координационно ненасыщенное
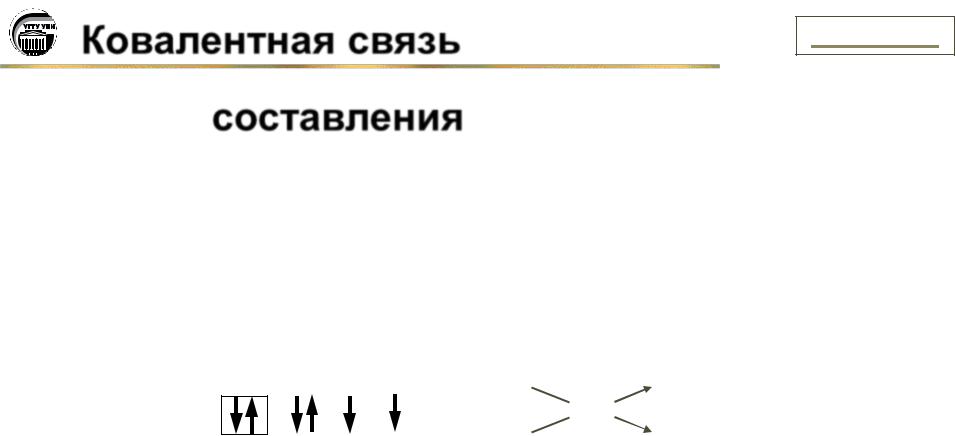
Ковалентная связь |
содержание |
|
Правила составления валентных схем
1.Оценить валентные возможности всех атомов в данном соединении в невозбужденном состоянии
2. При составлении схемы учесть, что наиболее энергетически выгодна восьми электронная конфигурация (правило октета)
S ...3s2 3p4 |
|
|
|
S |
8 ē |
|
|
|
3. В молекулах оксидов атомы кислорода соединяются друг с другом через кислотообразующий элемент
Исключение: пероксиды Н2О2
– О – О – пероксидная цепочка
Ковалентная связь |
содержание |
|
Правила составления валентных схем
4. В молекулах кислот водород всегда присоединяется к кислотообразующему элементу через атом кислорода
Исключение: H3PO3 – фосфористая кислота
НО  Р
Р  О*
О*
НО 
Н
5. Атом углерода образует четыре связи
C* ...2s1 2p3
6.Атом кислорода образует две ковалентные связи по обменному механизму или одну по донорноакцепторному механизму, если он находится в возбужденном состоянии
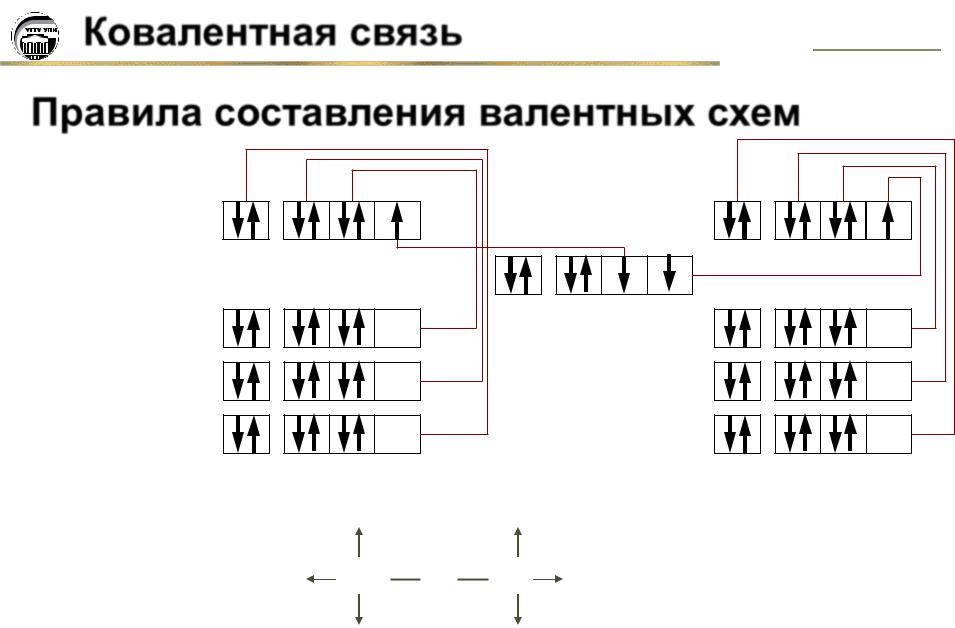
Ковалентная связь |
|
содержание |
|
|
|
Правила составления валентных схем
Cl2O7
Cl ... 3s2
О* ...2s2 О* ...2s2 О* ...2s2
3p5 |
|
|
Cl ... 3s2 3p5 |
|
О ...2s2 2p4 |
|
|
||
2p4 |
|
|
О* ...2s2 2p4 |
|
2p4 |
|
|
О* ...2s2 2p4 |
|
2p4 |
|
|
О* ...2s2 2p4 |
|
|
O* |
|
O* |
|
O* |
Cl |
O |
Cl |
O* |
|
O* |
|
O* |
|

Ковалентная связь |
содержание |
|
|
|
|
6. Полярность связи. Полярность молекул. |
|
Степень окисления элементов. |
|
Неполярная ковалентная связь – связь, образованная атомами одного элемента. Область повышенной электронной плотности находится на одинаковом расстоянии от ядер атомов.
Н – Н |
Cl – Cl |
F – F |
N |
|
N |
|
|||||
|
|||||
|
Полярная ковалентная связь – связь, образованная атомами различных элементов. Область повышенной электронной плотности смещена к атому с наибольшей электроотрицательностью. Один из атомов приобретает некоторый отрицательный заряд, а другой – положительный.
Н – Cl
+ -
Ковалентная связь |
содержание |
|
|
Полярность молекул. |
|
|
Если молекула обладает собственным постоянным дипольным моментом, то такая молекула полярна.
Для двух атомных молекул полярность связи определяет полярность молекулы в целом.
Н – Cl молекула полярна
+ -
Для молекул с числом атомов больше трех полярность зависит как от полярности каждой связи, так и от их взаимной направленности в пространстве.
|
|
|
|
|
|
|
F |
|
||
Sе |
|
|
Н |
|
|
|
|
= 0 |
||
|
|
|
|
|||||||
|
|
|||||||||
|
|
|||||||||
|
|
|
неполярная |
|||||||
|
|
|
|
|
||||||
|
|
|
|
полярная |
|
B |
||||
|
|
|
|
молекула |
||||||
Н |
|
молекула |
F |
|
|
F |
||||
|
|
|
|
|||||||
Ковалентная связь |
содержание |
|
|
Степень окисления |
|
|
Степень окисления – это условный заряд, который получил бы атом, если бы все электронные пары полностью переместились к более электроотрицательному атому.
HNO |
Элемент |
Валентность |
Степень |
||||||
|
|
окисления |
|||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
O |
|
N |
|
O |
N |
4 |
+5 |
|
|
|
|||||||
|
|||||||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O* |
O |
2 |
-2 |
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
O |
2 |
-2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O* |
1 |
-2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
1 |
+1 |
|
|
|
|
|
|
|
|
|
|
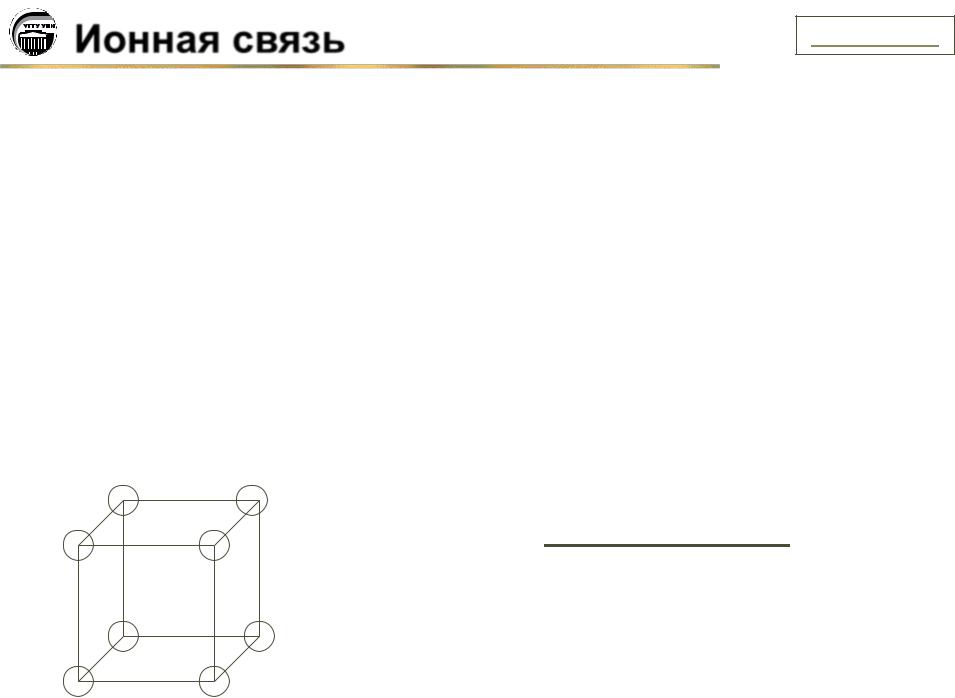
Ионная связь |
содержание |
|
Осуществляется путем электростатического взаимодействия между ионами.
Ионная связь предельный случай ковалентной полярной связи, когда электронная пара на 90 % принадлежит атому с наибольшей электроотрицательностью
( ОЭО > 1,8)
Na – ē = Na+ |
|
|
|
[Na+] [Cl-] |
|||||||||||||
Cl + ē = Cl- |
|
|
|
||||||||||||||
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
к.ч. = 6 |
Ионная связь: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
•ненаправленная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
•ненасыщаемая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
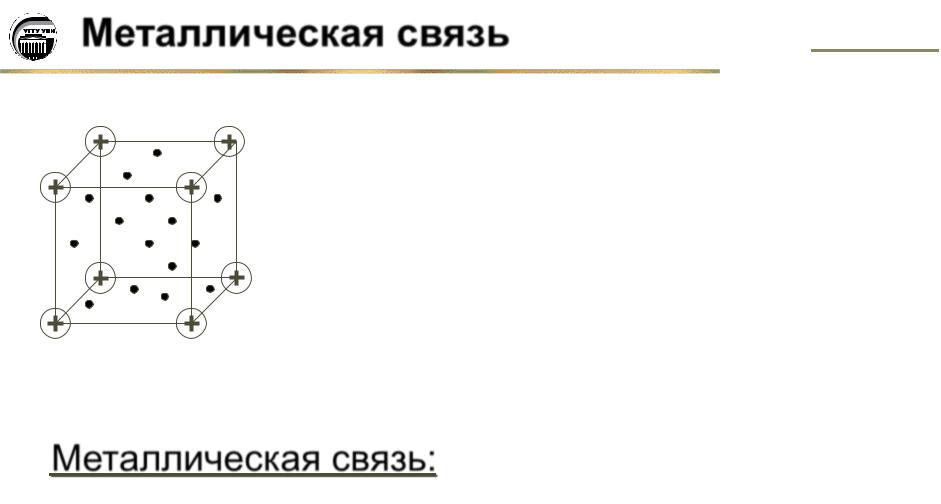
Металлическая связь |
|
содержание |
|
|
|
Связь между положительно заряженными остовами атомов осуществляется коллективом валентных электронов, относительно свободно перемещающихся по кристаллу.
Связь обуславливает высокую электро- и теплопроводность
Металлическая связь:
•ненаправленная
•ненасыщаемая
•нелокализованная

Водородная связь |
содержание |
|
Связь через атом водорода сильно электроотрицательных атомов, имеющих очень малые радиусы (F, O, N).
Механизмы образования:
•электростатическое взаимодействие
•донорно-акцепторное взаимодействие
Водородная связь:
•направленная
•насыщаемая
(HF)n |
|
HF ... HF ... HF ... HF |
|||||
|
|
|
|
H |
O |
||
|
|
|
|
|
|
|
|
NH ·H O |
H |
|
N ... H |
H |
|||
|
|||||||
|
|||||||
3 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
||
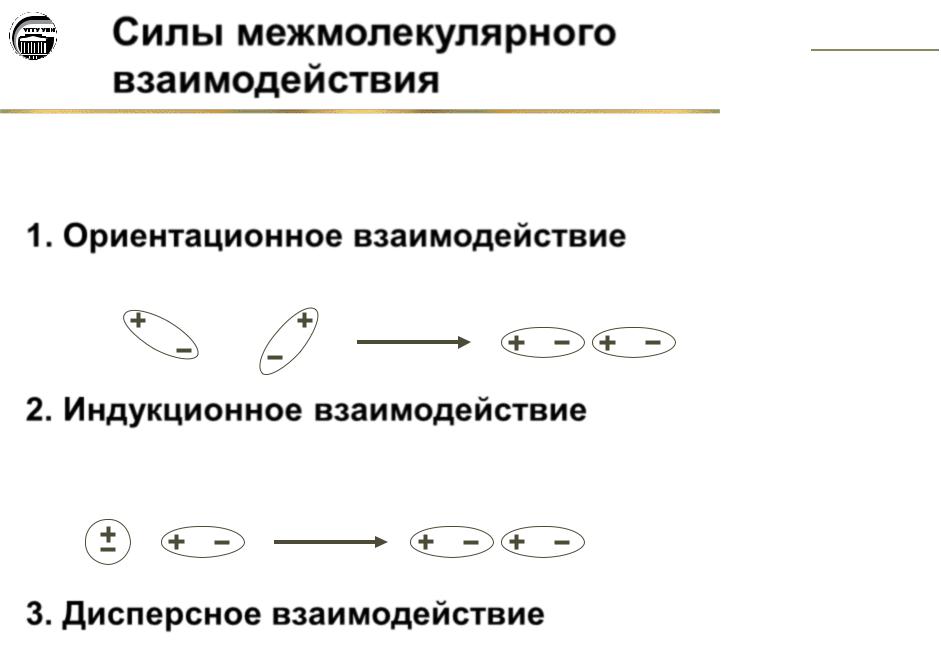
Силы межмолекулярного |
|
содержание |
|
взаимодействия |
|
|
Природа этих сил определяется электростатическим взаимодействием диполей
1.Ориентационное взаимодействие
взаимодействие между полярными молекулами
2.Индукционное взаимодействие
взаимодействие между неполярными и полярными молекулами
Индуцированный диполь
3.Дисперсное взаимодействие
взаимодействие между неполярными молекулами за счет возникновения мгновенных диполей

Выводы и заключения
Учение о химической связи – основополагающая проблема современной химии.
Знание о природе взаимодействия атомов в веществе, позволяет представить механизм образования, строение и реакционную способность химических соединений.

Список литературы
Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н. Л. Глинка ; под ред. А. И. Ермакова. - Изд. 30-е, испр. - М.: Интеграл-Пресс,
2004. - 728 с.: ил.
Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах, формулах, химических реакциях: Учеб. пособие / А.П. Гаршин. - 2-е изд., испр. и доп. - СПб.: Лань, 2000. - 288 с.
Карапетьянц М.Х. Общая и неорганическая химия: Учебник для студентов вузов / М.Х. Карапетьянц, С.И. Дракин. - 4-е изд., стер.
- М.: Химия, 2000. - 592 с.: ил.
Угай Я.А. Общая и неорганическая химия: Учебник для студентов вузов, обучающихся по направлению и специальности "Химия" / Я.А. Угай. - 2-е изд., испр. - М.: Высшая школа, 2000. - 527 с.: ил.
Неорганическая химия: учебник для студентов вузов, обучающихся по направлению 510500 "Химия" и специальности 011000 "Химия" : в 3 т. Т. 1: Физико-химические основы неорганической химии / М. Е. Тамм, Ю. Д. Третьяков / под ред. Ю. Д. Третьякова. - М.: Академия, 2004. - 240 с.: ил.
Неорганическая химия: учебник для студентов вузов, обучающихся по направлению 510500 "Химия" и специальности 011000 "Химия" : в 3 т. Т. 2: Химия непереходных элементов / А. А. Дроздов, В. П. Зломанов, Г. Н. Мазо, Ф. М. Спиридонов / под ред. Ю. Д. Третьякова. - М.: Академия, 2004. - 368 с.: ил.

Список литературы для углубленного изучения теории химической связи
Заградник Р., Полак Р. Основы квантовой химии. Пер с чешс.
– М.: Мир, 1979. – 504 с.
Хабердитцл В. Строение материи и химическая связь. Пер.
с нем. – М.: Мир, 1974. – 296 с.
Гиллеспи Р., Харгиттаи И. Модель отталкивания электронных пар валентной оболочки и строение молекул:
Пер. с. англ. – М.: Мир, 1992. – 296 с.

Электролиз

УМК «ХИМИЯ»
Тема лекции: Электролиз
Лектор – Иванов М.Г.

Цель лекции:
изложение основных понятий электролиза
водных растворов и расплав электролитовий в рамках современной химической теории
Компетенции, формируемые у студента:
Умения:
прогнозировать на основе современных
представлений о строении атомов и
химической связи, реакции, протекающие при
электролизе в расплавах и растворах
электролитов.

СОДЕРЖАНИЕ
Основные понятия Электролиз расплавов электролитов
Электролиз водных растворов электролитов Катодные процессы
Поведение ионов металлов Перенапряжение
Анодные процессы Перенапряжение Поведение анионов
Электролиз с растворимым анодом Законы электролиза Литература

Основные понятия |
содержание |
|
Электролиз – это совокупность окислительно-восстановительных процессов, которые протекают на электродах, помещенных в раствор или расплав электролита, под действием постоянного электрического тока, приложенного от внешнего источника.
Основные понятия:
Отрицательный полюс источника постоянного тока присоединяют к электроду, который называют
катодом; положительный полюс к электроду, который называют анодом.
Основные понятия |
содержание |
|
- |
+ |
Катод |
Анод |
Схема простейшего электролизера

Основные понятия |
содержание |
|
Е = -nF/ G
E > 0, ΔG < 0 - самопроизвольный процесс протекает в прямом направлении (гальванический элемент).
Если ЭДС будет отрицательной, то самопроизвольное протекание ОВР становится невозможным.
E < 0, ΔG > 0 - для проведения реакции в прямом направлении необходимо приложить внешнюю ЭДС (электролиз).

Электролиз расплавов |
содержание |
|
электролитов
В простейших бинарных электролитах типа MeHal , MeHal2 (Me
– металл IA или IIA группы Пеpиодической системы, Hal – галоген) на катоде выделяется свободный металл, а на аноде – (галоген)
При этом на катоде протекает полуреакция восстановления катиона металла:
Men+ + ne = Me
на аноде - полуреакция окисления галогенид-аниона:
2Cl- - 2e = Cl2

Электролиз расплавов |
содержание |
|
электролитов
При электролизе расплава гидродифторида калия (анод
– угольный, катод – никелевый) протекает следующие реакции
На катоде: |
На аноде: |
2НF - + 2е = Н |
2 |
+ 4F- |
2НF |
- - 2е = F + 2HF |
2 |
|
2 |
2 |
2НF + 2е = Н |
2 |
+ 2F- |
2F |
- - 2е = F |
|
|
2 |
2 |

Электролиз водных растворов |
содержание |
|
При электролизе растворов необходимо учитывать присутствие ионов растворителя, которые при определенных условиях могут разряжаться на электродах. Так, при электролизе водных растворов, следует учитывать присутствие ионов воды:
Н2О ↔ Н+ + ОН-
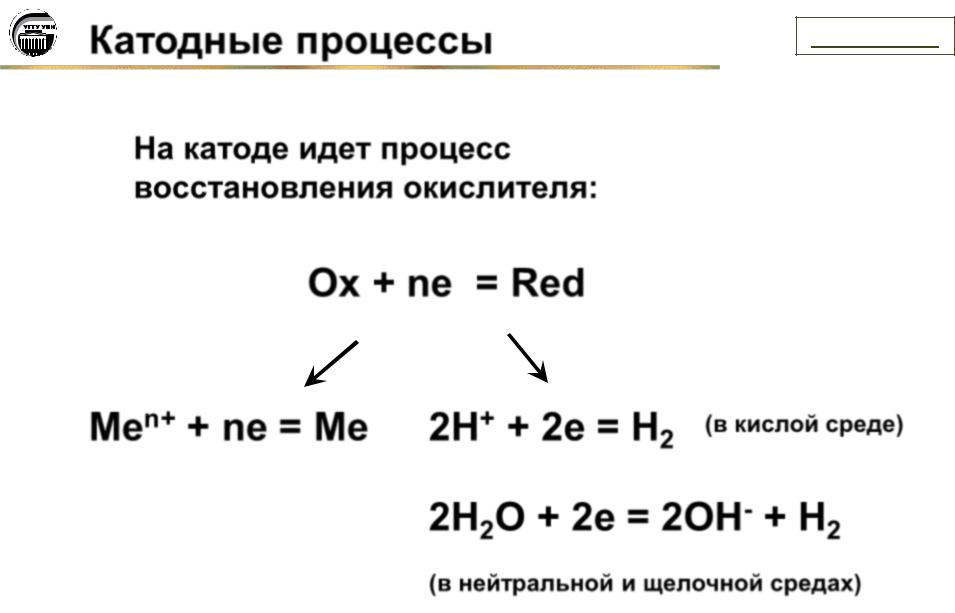
Катодные процессы |
содержание |
|
На катоде идет процесс восстановления окислителя:
Ox + ne = Red
Me |
|
+ ne = Me 2Н + 2е = Н2 |
|
|
n+ |
+ |
(в кислой среде) |
2Н2О + 2е = 2ОН- + Н2
(в нейтральной и щелочной средах)

Катодные процессы |
содержание |
|
При электролизе водных растворов все металлы можно разделить на три группы:
1. Металлы, осаждение которых на катоде не сопровождается выделением водорода. К ним относятся металлы, стоящие в ряду стандартных потенциалов за водородом (медь, серебро, золото и др.).
2. Металлы, осаждение которых на катоде сопровождается выделением водорода. В ряду стандартных потенциалов эти металлы находятся между марганцем и водородом
(-1,0 ЕОМеn+/Ме 0).
3. Металлы, которые в водных растворах не могут быть получены. В эту группу входят щелочные, щелочноземельные металлы, а также магний и алюминий.
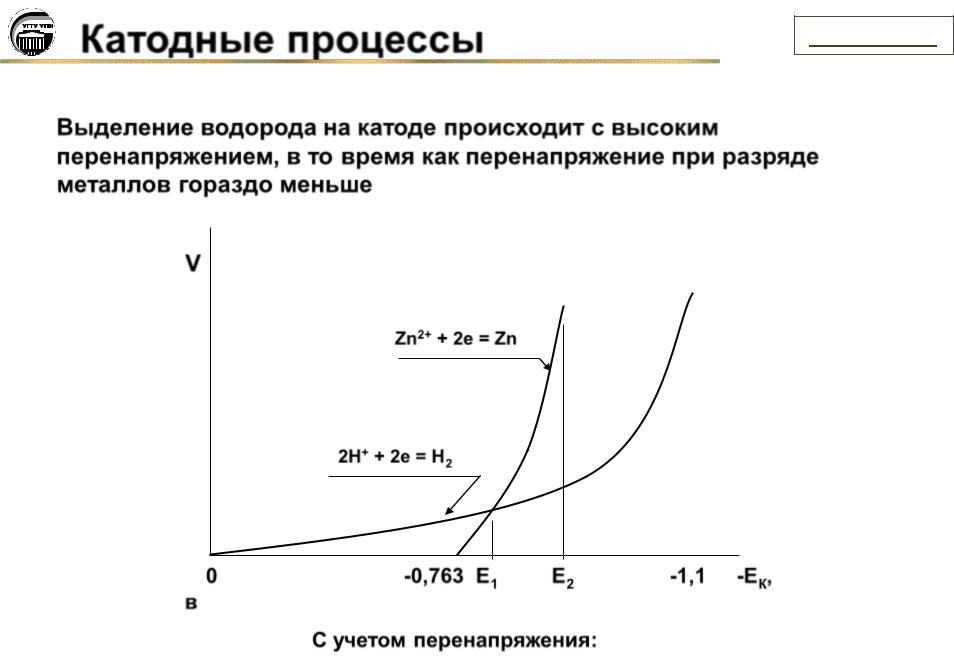
Катодные процессы |
содержание |
|
Выделение водорода на катоде происходит с высоким перенапряжением, в то время как перенапряжение при разряде металлов гораздо меньше.
V
Zn2+ + 2e = Zn
2H+ + 2e = H2
0 |
-0,763 Е1 |
Е2 |
-1,1 -ЕК, |
в
С учетом перенапряжения: E2H /H2 -1,1
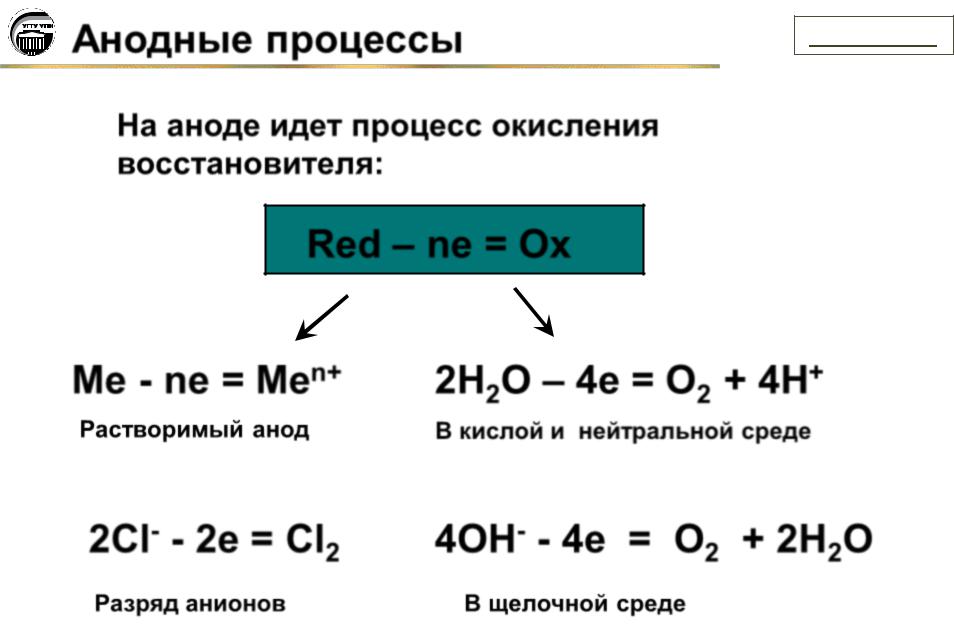
Анодные процессы |
содержание |
|
На аноде идет процесс окисления восстановителя:
Red – ne = Ох
Me - ne = Men+ |
2Н О – 4е = О + 4Н+ |
|
|
2 |
2 |
Растворимый анод |
В кислой и нейтральной среде |
|
2Cl- - 2e = Cl |
2 |
4ОН- - 4е = О |
2 |
+ 2Н О |
|
|
2 |
Разряд анионов |
В щелочной среде |
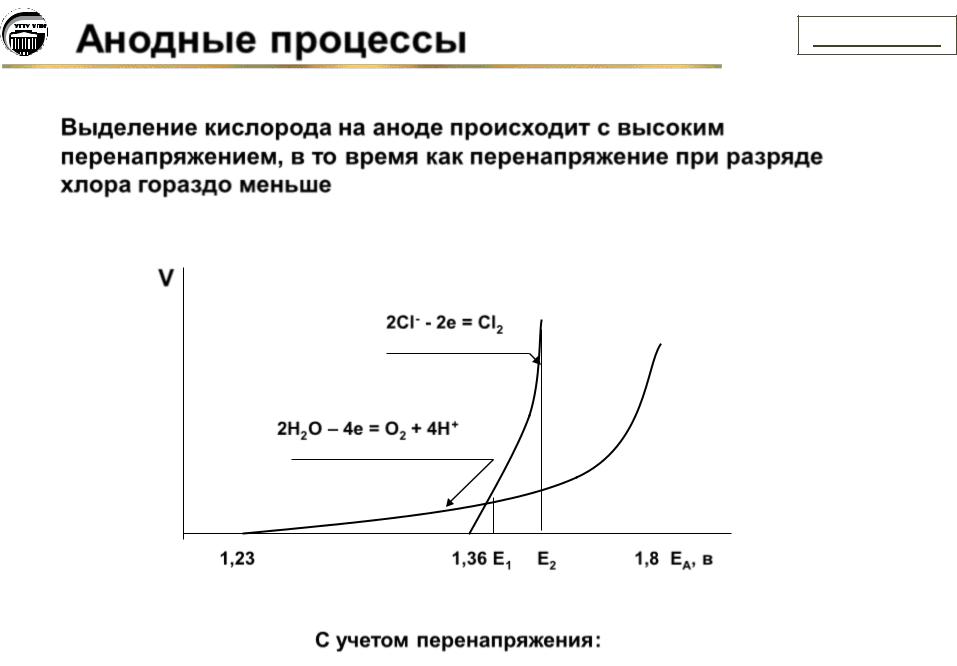
Анодные процессы |
содержание |
|
Выделение кислорода на аноде происходит с высоким перенапряжением, в то время как перенапряжение при разряде хлора гораздо меньше.
V
2Cl- - 2e = Cl2
2H2O – 4e = O2 + 4H+
1,23 |
1,36 E1 E2 |
1,8 EA, в |
С учетом перенапряжения: EO2/2H2O 1,8B.

Анодные процессы |
содержание |
|
Анионы кислородсодержащих кислот SO42-, PO43-, NO3- и др., в которых центральный атом имеет высшую степень окисления, при электролизе водных растворов не разряжаются.
Ионы галогенов: Cl-, Br-, I- в водном растворе легко разряжаются:
2Hal- - 2e = Hal2
Фтор электролизом водных |
0 |
2,87B. |
растворов получить невозможно: |
EF2 /2F |

Анодные процессы |
содержание |
|
Пpи высоких анодных плотностях тока
некотоpые анионы могут окисляться до
пеpоксоанионов, напpимеp:
2SO42− − 2e = S2O82−
H2PO4− + 2OH−−2e = H2PO5− +H2O

Электролиз с растворимым |
содержание |
|
|
анодом |
|
|
Электролиз с растворимым анодом используют для рафинирования некоторых металлов – меди, никеля, серебра, золота, свинца, олова и других, для нанесения защитных и декоративных покрытий на поверхность металлических изделий.
Процесс электролитического рафинирования состоит в анодном растворении загрязненного примесями (чернового) металла и последующем его катодном осаждении.
Me - ne = Men+
Законы электролиза |
содержание |
|
Установил (1833-1834) законы электролиза, названные его именем.
Фарадей (Faraday) Майкл
(1791-1867).

Законы электролиза |
содержание |
|
I закон. Масса вещества, окисленного на аноде или восстановленного на катоде, пропорциональна количеству прошедшего через раствор или расплав электричества.
m = kQ
II закон. Массы окисляющихся или восстанавливающихся на электродах веществ при пропускании одного и того же количества электричества пропорциональны их химическим эквивалентам.
M(г) = MIT/nF V(л) = 22,4IT/nF

Законы электролиза |
содержание |
|
Число Фарадея F
- это фундаментальная постоянная, равная
заряду одного моля электронов.
F = e·NA = 1,60218·10-19Кл·6,022045·1023моль-1 = 96484,6 Кл/моль ≈ ≈ 96500 Кл/моль
e – заряд одного электрона
NA – число Авогадро

Выводы и заключения |
содержание |
|
|
|
Электролиз является важнейшей является
частью неорганической химии.
Знание законов электролиза, определяющих
зависимость между количеством прошедшего электричества и количеством вещества,
выделяющимся на электроде позволяет, а
также понятие электродного потенциала
позволяет охарактеризовать электрохимические процессы.

Список литературы |
содержание |
|
1. Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа. 2002.
2. О.М. Полторак, Л.М. Ковба. «Физико-химические основы неорганической химии». М.: МГУ, 1994.
3. В.И. Горшков, И.А. Кузнецов. «Физическая химия». М.:
МГУ, 1993.
4. А. Джонсон. Термодинамические аспекты в курсе неорганической химии. М.: Мир. 1985.
5. Анорганикум. Под ред. Л. Кольдица. М. Мир. 1984. Т.1. 6.
Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность. М., Химия, 1987.
7. Фичини Ж., Ламброзо-Бадер Н., Депезе Ж.-К. Основы физической химии. М. Мир. 1972. стр.276-283.
8. Дж. Кемпбел. Современная общая химия. М.:Мир. 1975г.
Т.2. стр.90. гл.20., Т3.
9. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии.
М.: Мир,1982. Т. 2.
10. Б.Б.Дамаскин, О.А.Петрий. Электрохимия. М: Высшая школа, 1987.
11. CRC Hand book of Chemistry and Physics. 82 издание.
2001-2002.
