

1
ЭЛЕКТРОЛИЗ
СОДЕРЖАНИЕ ........................ |
ОШИБКА! ЗАКЛАДКА НЕ ОПРЕДЕЛЕНА. |
|
Общие положения ................................................................................................... |
|
2 |
ПОСЛЕДОВАТЕЛЬНОСТЬ РАЗРЯДА ИОНОВ ПРИ ЭЛЕКТРОЛИЗЕ |
........... 2 |
|
ЭЛЕКТРОЛИЗ РАСПЛАВОВ ЭЛЕКТРОЛИТОВ............................................... |
4 |
|
Катодные процессы ........................................................................................... |
|
4 |
Анодные процессы ............................................................................................ |
|
4 |
ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ .............................................................. |
5 |
|
Катодные процессы ........................................................................................... |
|
5 |
Анодные процессы .......................................................................................... |
|
12 |
Электролиз раствора соли, образованной металлом и |
|
|
бескислородсодержащей кислотой................................................................ |
15 |
|
Электролиз раствора соли, образованной металлом и |
|
|
кислородсодержащей кислотой ..................................................................... |
17 |
|
ЭЛЕКТРОЛИЗ С РАСТВОРИМЫМ АНОДОМ ................................................ |
18 |
|
ЗАКОНЫ ЭЛЕКТРОЛИЗА .................................................................................. |
|
19 |
I закон .................................................................................................................. |
|
20 |
II закон................................................................................................................. |
|
20 |
Выход по току .................................................................................................... |
|
21 |
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

2
ЭЛЕКТРОЛИЗ
Общие положения
Электролиз – это совокупность окислительно-восстановительных процессов, которые протекают на электродах, помещенных в раствор или расплав электролита, под действием постоянного электрического тока, приложенного от внешнего источника.
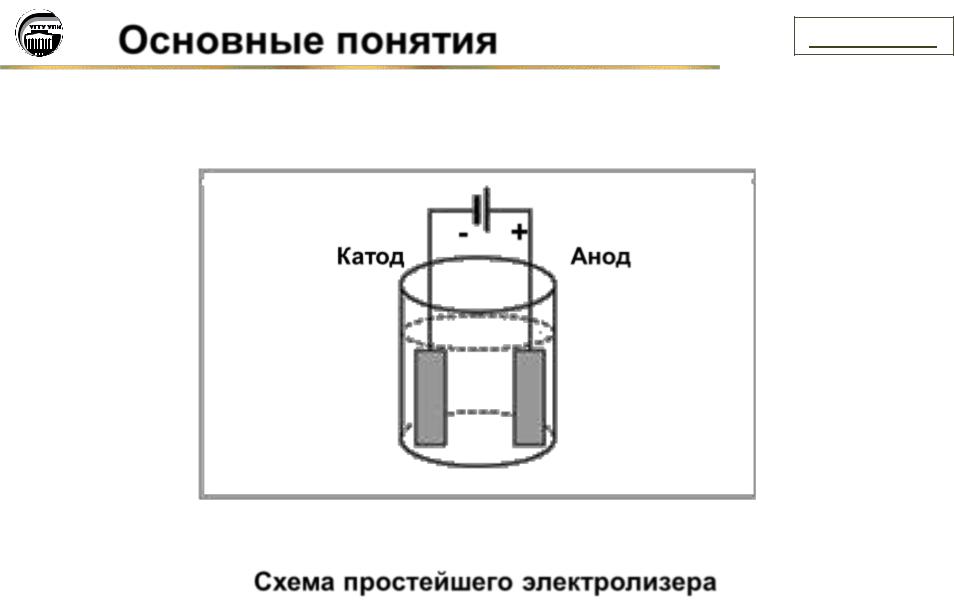
Схема простейшего электролизера
Отрицательный полюс источника постоянного тока присоединяют к электроду, который называют катодом; положительный полюс к электроду, который называют анодом. При включении внешнего источника постоянного тока движение ионов в растворе или расплаве становится направленным. Отрицательно заряженные ионы (анионы) перемещаются к аноду, положительно заряженные ионы (катионы) направляются к катоду.
С увеличением напряжения, подаваемого от внешнего источника постоянного тока, потенциал катода смещается в область отрицательных, а потенциал анода – в область положительных значений.
Когда потенциалы катода и анода достигают вполне определенных значений, на них становится возможным разряд ионов или молекул из раствора или расплава электролита – начинается электролиз. Сущность электролиза состоит в осуществлении за счет электрической энергии химических реакций
– восстановление частиц на катоде и окисление на аноде. Причем восстановительное и окислительное действие тока во много раз сильнее действия химических восстановителей и окислителей.
ПОСЛЕДОВАТЕЛЬНОСТЬ РАЗРЯДА ИОНОВ ПРИ ЭЛЕКТРОЛИЗЕ
При электролизе электролитов, содержащих различные катионы и анионы, разряд последних происходит в определенной последовательности. Последовательность разряда ионов на катоде зависит от положения металла в ряду
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

3
напряжений (от значения стандартного окислительно-восстановительного потенциала), от концентрации ионов в растворе и от перенапряжения. Чем более отрицателен стандартный потенциал металла и чем меньше концентрация его ионов в растворе, тем при большем сдвиге потенциала катода в отрицательную сторону происходит разряд его ионов. Катодное перенапряжение при выделении металлов имеет небольшое значение и обычно не учитывается в приближенных расчетах потенциалов выделения металлов. Если в растворе одновременно находятся ионы двух и более металлов, то в первую очередь разряжаются ионы того металла, у которого более положительный потенциал. Например, при электролизе раствора, содержащего ионы меди и цинка, в начале на катоде выделится вся медь, а затем уже цинк
( Eo |
2 |
/Zn |
0,76B, |
E0 |
2 |
/Cu |
0,34B.). Если потенциалы двух металлов |
Zn |
|
|
Cu |
|
|
очень близки, то наблюдается совместное выделение двух металлов, с обра-
зованием |
сплава, например, сплава олова и свинца ( Eo |
2 |
/Sn |
0,136B |
, |
||
|
|
|
Sn |
|
|
|
|
Eo |
2 |
/Pb |
0,126B. ). |
|
|
|
|
Pb |
|
|
|
|
|
|
|
В водных растворах электролитов на катоде возможен процесс восстановления ионов водорода. Исходя из положения водорода в ряду стандартных потенциалов, можно было бы полагать, что все металлы, имеющие стандартные потенциалы отрицательнее водорода, восстанавливались бы на катоде после водорода. Но поскольку концентрация ионов водорода в слабокислых, ней-
тральных и щелочных растворах достаточно мала ( К |
H |
O |
1,8 10 16 ) а катод- |
|
2 |
|
|
ное перенапряжение водорода имеет большие значения, то потенциал выделения водорода имеет более отрицательное значение по сравнению с потенциалом многих металлов, стоящих в ряду напряжений до водорода. Вследствие этого такие металлы как олово, свинец, никель, железо, кобальт, кадмий из нейтральных растворов выделяются раньше водорода. В нейтральных и слабокислых растворах водород может выделяться совместно с такими активными металлами, как цинк, хром, марганец. В водных растворах, содержащих ионы щелочных и щелочноземельных металлов, имеющих очень отрицательные стандартные потенциалы (по ряду напряжений, включительно до циркония, стандартный потенциал которого равен -1,58В), на катоде при электролизе выделяется только водород.
В процессе электролиза водных растворов с нерастворимым анодом отрицательные ионы разряжаются также в определенной последовательности. Раньше начинают разряжаться те ионы, которые имеют более отрицательное значение потенциала. Наиболее легко окисляются остатки бескислородсодержащих кислот, затем гидроксидионы (или вода) и наиболее трудно, то есть при более высоких положительных значениях потенциала, разряжаются кислотные остатки кислородсодержащих кислот в высших степенях окисле-
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

4
ния. По активности к окислению на аноде анионы можно расположить в ряд: S2-, I-, Br-, Cl-, OH-, SO4 2- , NO3 - , ClO4 - .
В случае растворимого анода, состоящего из нескольких металлов (или металла, содержащего примеси), растворяется в первую очередь металл, имеющий более отрицательное значение электродного потенциала.
ЭЛЕКТРОЛИЗ РАСПЛАВОВ ЭЛЕКТРОЛИТОВ
При плавлении солей типа MeHal2 или MeHal (где Hal –галоген) происходит диссоциация:
MgCl2 = Mg2+ + 2Cl– или NaCl = Na+ + Cl–
В более сложных случаях:
К3[AlF6] = [AlF6]3– + К+ или КHF2 = К+ + 2HF2–
Протекание электролиза не осложнено влиянием растворителя, однако катодные и анодные процессы в расплаве имеют свои особенности.
Катодные процессы
На катоде протекает полуреакция восстановления окислителя:
Ox + ne = Red
функцию окислителей могут выполнять не только катионы металлов:
Men+ + ne = Me
но так же анионы:
[AlF6]3– + 3e = Al + 6F–
2HF2– + 2e = H2 + 4F–
Анодные процессы
От анода электроны отводятся внешним источником тока, анод выполняет роль окислителя. Окислению на аноде могут подвергаться анионы, которые подходят к аноду, а также сам материал анода. Вещества, которые окисляются на аноде, выполняют роль восстановителей.
Red – ne = Ох
Это может быть полуреакция окисления галогенидиона:
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

5
2Cl– − 2e = Cl2
или другого аниона:
2HF2– – 2e = F2 + 2HF
При проведении электролиз расплавов солеей как правило используют инертные электроды (платина, графит), а электролиз ведут отделяя с помощью мембраны катодное и анодное пространство.
ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ
В отличие от электролиза расплавов, когда на катоде выделяется металл, а на аноде – продукт разряда аниона соли, при электролизе растворов необходимо учитывать присутствие ионов растворителя, которые при определенных условиях могут разряжаться на электродах. Так, при электролизе водных растворов, следует учитывать присутствие ионов воды:
Н2О ↔ Н+ + ОН-
Для того чтобы определить, какие катионы будут окисляться на аноде, необходимо сравнить потенциалы их разряда с учетом перенапряжения.
Рассмотрим более подробно отдельно катодные и анодные процессы, протекающие при электролизе водных растворов.
Катодные процессы
С катода происходит передача электронов веществам, находящимися в растворе. Катод выступает по отношению к разряжающимся на нем частицам в роли восстановителя. Функцию окислителей могут выполнять катионы металлов или нейтральные молекулы. Следовательно, на катоде идет процесс восстановления окислителя:
Ox + ne = Red
Любой окислительно-восстановительный процесс может идти в прямом направлении только в том случае, если ЕВОССТ  Е ОКИСЛ .
Е ОКИСЛ .
Поэтому восстановление окислителя на катоде будет происходить лишь в том случае, если потенциал катода – восстановителя - (ЕК) по алгебраической величине станет меньше потенциала окислителя (ЕОх/Red).
От того, насколько смещен потенциал катода (ЕК) от равновесного потенциала окислителя (ЕОх/Red) зависит скорость катодного процесса. Чем сильнее смещен потенциал катода в сторону отрицательных значений, тем выше скорость восстановления окислителя.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

6
Величина смещения потенциала катода (∆Е = ЕК - ЕOx/Red), необходимая для протекания данного процесса с определенной скоростью, называется,
катодным перенапряжением данного электродного процесса. Катодное перенапряжение складывается из затрат на преодоление сопротивления переносу ионов, разряду ионов на катоде, включению атомов в кристаллическую решетку металла. Катодное перенапряжение означает смещение потенциала катода в отрицательную сторону, то есть оно имеет отрицательное значение. Величина перенапряжения при разряде частиц на катоде определяется природой разряжающихся частиц (их положением в ряду стандартных электродных потенциалов), зависит от плотности тока, температуры, материала электрода-катода и состояния его поверхности, состава и концентрации раствора и других факторов.
Катионы металлов в растворах простых солей разряжаются на катоде с небольшим перенапряжением, то есть при потенциалах близких к
равновесным значениям EoMen /Me . Для ионов таких металлов как Zn, Cd, Cu, Ag, Au, Hg катодное перенапряжение близко к нулю.
Особенностью электролиза растворов является наличие в них наряду с ионами электролита ионов водорода, которые присутствуют в водных растворах за счет диссоциации воды или кислот, вводимых в электролит для создания кислой среды. При электролизе водных растворов на катоде могут разряжаться не только катионы металлов, но и молекулы воды:
2Н2О + 2е = Н2 + 2ОН- в нейтральной и щелочной средах |
|
|||
или ионы водорода: |
|
|
|
|
2Н + + 2е = Н2 |
в кислой среде |
|
|
|
Эти процессы, при потенциалах близких к равновесному |
E0 |
0 |
В), идут |
|
|
|
2H /H |
|
|
|
|
2 |
|
|
с очень малой скоростью вследствие высокого перенапряжения выделения водорода.
Более высокое значение перенапряжения характерно для выделения водорода на катоде и кислорода на аноде. Перенапряжение водорода зависит от плотности тока, от материала электрода, от состояния поверхности электрода, от температуры, от состава и природы электролита. В одних случаях (в аккумуляторах, коррозия металлов) восстановление водорода - нежелательное явление, в других (электролитическое получение водорода) важно предельно снизить перенапряжение водорода.
Причина высокого перенапряжения водорода связана с задержкой его выделения на катоде. Термин водородное перенапряжение обычно означает катодную поляризацию, сопровождающую разряд ионов водорода из кислого раствора
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

7
2Н+ + 2е = Н2
или же электролиз нейтральных и щелочных растворов с выделением водо-
рода:
2Н2О + 2е = 2ОН- + Н2.
Поскольку ион водорода в водных растворах гидратирован и существует в виде иона гидроксония Н3О+, то в процессах выделения водорода следует учитывать затраты энергии и на десольватацию.
Разряд ионов водорода протекает в несколько стадий. К их числу прежде всего относится диффузия ионов гидроксония из глубины раствора к катоду. Поскольку ионы гидроксония обладают самой высокой подвижностью, то предельный диффузионный ток достигается при настолько больших плотностях тока, что в широкой области значений плотности поляризующего тока можно полностью пренебречь перенапряжением диффузии. Далее следует собственно электрохимический акт разряда ионов водорода одновременно с их дегидратацией. Образовавшийся в результате этого атомарный водород, адсорбированный на поверхности катода, превращается в молекулярный водород (реакция рекомбинации или молизации). Из этого следует, что водородное перенапряжение определяется перенапряжением перехода, связанного с торможением электрохимической стадии ассимиляции электрона водородным ионом, перенапряжением реакции, возникающего вследствие задержки рекомбинации. В настоящее время различают три стадии при разряде ионов водорода:
1. Собственно сама стадия разряда ионов водорода (Фольмера) Н3О+ + е = Н2О + Н
2.Стадия рекомбинации (Тафеля)
Н+ Н = Н2
3.Стадия электрохимической десорбции, когда стадия разряда и молизации совмещены (Гейровского)
Н+ + Н + е = Н2
На величину перенапряжения водорода влияют как материал электрода, так и плотность тока.
Используя величины равновесных электродных потенциалов и перенапряжений, можно решать такие важные задачи, как последовательность и возможность протекания на электродах нескольких реакций.
Для оценки последовательности и возможности совместного протекания на катоде при заданной плотности тока нескольких реакций находят сумму равновесного потенциала и перенапряжения для каждой из возможных реакций.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

8
На катоде при заданной плотности тока в первую очередь будет происходить та реакция, которая имеет более положительный потенциал, то есть сумма ЕОх/Red + ∆Е имеет наибольшее значение.
Для грубой оценки последовательности электродных реакций при разряде ионом металла на катоде можно пользоваться величинами стандартных электродных потенциалов.
Как показывают опыты, при электролизе водных растворов все металлы можно разделить на три группы:
1.Металлы, осаждение которых на катоде не сопровождается выделением водорода. К ним относятся металлы, стоящие в ряду стандартных потенциалов за водородом (медь, серебро, золото и др.). Катионы этих металлов обладают более высокой окислительной способностью, чем ионы водорода.
2.Металлы, осаждение которых на катоде сопровождается выделением водорода. В ряду стандартных потенциалов эти металлы находятся между марганцем и водородом (-1,0 ЕОМеn+/Ме 0).
3. Металлы, которые в водных растворах не могут быть получены. В эту группу входят щелочные, щелочноземельные металлы, а также магний и алюминий. Катионы этих металлов обладают очень низкой окислительной способностью.
Если же водный раствор содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения алгебраической суммы равновесного электродного потенциала и перенапряжения
для соответствующего металла. |
Так, из смеси катионов Ag+, Cu2+, Zn2+ в |
|||||||
водном растворе |
сначала |
будут восстанавливаться катионы |
серебра |
|||||
( Eo |
0,8B ), |
так как они обладают наибольшей окислительной способ- |
||||||
Ag /Ag |
|
|
|
|
|
|
|
|
ностью, затем катионы меди ( E |
0 2 |
/Cu |
0,34B. ) и последними – |
катионы |
||||
|
|
|
|
|
Cu |
|
|
|
цинка ( Eo |
2 |
/Zn |
0,76B). |
(Перенапряжение для данных металлов, |
как ука- |
|||
Zn |
|
|
|
|
|
|
|
|
зывалось выше, близко к нулю). |
|
|
|
|
||||
В интервале потенциалов катода |
0,397В ЕК +0,799В могут восстанавли- |
|||||||
ваться только ионы серебра: |
|
|
|
|
||||
|
|
|
|
Ag+ |
+ е = Ag. |
|
||
После выделения всего серебра из раствора потенциал катода можно сместить в область более отрицательных значений. При потенциале катода 0 
ЕК 0,34В происходит выделение меди на катоде:
Cu2+ + 2e = Cu.
При смещении потенциала катода в область отрицательных значений при ЕК
0 на катоде начинается разряд ионов водорода ( E0 |
0 В). При срав- |
2H /H |
|
2 |
|
нении стандартных потенциалов цинка и водорода можно сделать вывод о
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

9
невозможности выделения цинка на катоде. Однако следует учесть, что, вопервых, стандартный потенциал водородного электрода относится к активностям ионов Н+ равной 1, то есть рН = 0. С увеличением рН потенциал водорордного электрода становится отрицательнее. В тоже время потенциалы металлов в области, где не происходит выпадение их нерастворимых гидроксидов, от рН не зависят. Потенциал водородного электрода становится отрицательнее стандартных потенциалов некоторых металлов. Во-вторых, выделение водорода на катоде происходит с высоким перенапряжением, в то время как перенапряжение при разряде металлов гораздо меньше. На многих металлах разряд ионов водорода происходит с очень большим перенапряжением (см. табл. 1). Таким образом, при некоторой плотности тока потенциал выделения водорода становится отрицательнее, чем потенциал выделения металла.
Так, равновесный потенциал цинкового электрода (рис.) отрицательнее потенциала водородного электрода и при малых плотностях тока на катоде выделяется лишь один водород. Скорость выделения водорода остается незначительной. Но водородное перенапряжение на цинке больше, чем перенапряжение разряда ионов цинка, поэтому при повышении плотности тока становится возможным выделение на электроде и цинка. Когда потенциал катода достигает значения –0,76В, на катоде начинают разряжаться ионы цинка:
Zn2+ + 2e = Zn
V
Zn2+ + 2e = Zn
2H+ + 2e = H2
0 |
-0,763 Е1 |
Е2 |
-1 -ЕК, в |
Поляризационные кривые катодного выделения водорода и цинка
При потенциале Е1 плотности токов выделения водорода и цинка одинаковы, а при потенциале Е2 плотность тока для выделения цинка много больше плотности выделения на катоде водорода, то есть на электроде выделяется в
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

10
основном цинк. Для данного случая высокое водородное перенапряжение – явление положительное. Благодаря этому из водных растворов удается выделять на катоде марганец, цинк, хром, железо, кадмий, кобальт, никель и другие металлы.
После осаждения из раствора всего цинка потенциал катода можно сместить в область более отрицательных значений и на катоде начинает выделяться преимущественно водород. Скорость выделения водорода на катоде заметно увеличивается, когда потенциал катода достигает значений –1,0 … -1,2 В. (Более точно величину перенапряжения водорода на различных металлах смотри в табл. 1). При этих значениях потенциала катода все электроны, поступающие на катод от внешнего источника тока, расходуется на восстановление ионов водорода или молекул воды:
2H2O + 2e = H2 + 2OH.
По этой причине дальнейшее смещение потенциала катода в область больше отрицательных значений в водных растворах становится невозможным, что обуславливает также невозможность восстановления ионов щелочных и щелочноземельных металлов, для разряда которых требуется очень отрицательный потенциал.
Пример. Определить, какой процесс будет происходить на свинцовом катоде, опущенном в электролит, содержащий ионы свинца Pb2+ и ионы водорода Н+ с активной концентрацией каждого 1 моль ионов/л. Перенапряжение восстановления ионов Pb2+ на свинцовом катоде принять равным нулю.
Решение. Записываем схемы возможных на свинцовом катоде реакций восстановления:
2Н+ + 2е = Н2 |
(1) |
Рb2+ + 2e = Pb |
(2) |
Поскольку активности ионов в растворе равны единице, то воспользуемся стандартными значениями электродных потенциалов. Из таблиц стандартных потенциалов находим:
E0 |
0 . |
Eo |
2 |
/Pb |
0,126B. |
2H /H 2 |
|
Pb |
|
|
Перенапряжение восстановления ионов водорода на свинце составляет
-1,05В (см. табл 1). Перенапряжение восстановления ионов свинца на свинцовом катоде близко к нулю.
Вычисляем значение (Е |
о |
+ ∆Ек). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исполнитель: |
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

11
Для схемы 1 E02H /H 2 + ∆ЕН2 = 0 + (-1,05) = -1,05В.
Для схемы 2 EoPb2 /Pb + ∆ЕPb = -0,13 + 0 = -0,13В.
Так как во втором случае сумма (Е + ∆Е) имеет более положительное значение, то на свинцовом катоде будет в первую очередь проходить реакция восстановления ионов Pb2+ .
Если же сравнивать между собой только стандартные потенциалы свинцового (-0,13В) и водородного (0,0В) электродов, то в первую очередь должен бы происходить процесс восстановления ионов водорода Н+ , что противоречит действительности.
Таким образом, характер реакций, протекающих на катоде в водных растворах, обусловлен положением металла в ряду стандартных потенциалов и катодным перенапряжением.
Для грубой оценки последовательности электродных реакций при разряде ионов металлов на катоде можно пользоваться величинами стандартных электродных потенциалов.
Как показывают опыты, при электролизе водных растворов все металлы можно разделить на три группы:
Металлы, осаждение которых на катоде не сопровождается выделением
водорода. К ним относятся металлы, стоящие в ряду стандартных потенциалов за водородом (медь, серебро, золото и др.). Катионы этих металлов обладают более высокой окислительной способностью, чем ионы водорода.
Металлы, осаждение которых на катоде сопровождается выделением водорода. В ряду стандартных потенциалов эти металлы находятся между
марганцем и водородом (-1,0 |
Eo |
n |
/Me |
0). |
|
Me |
|
|
Металлы, которые в водных растворах не могут быть получены. В эту
группу входят щелочные, щелочноземельные металлы, а также магний и алюминий. Катионы этих металлов обладают очень низкой окислительной способностью.
Если же водный раствор содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения алгебраической суммы равновесного электродного потенциала и перенапряжения для соответствующего металла. Так, из смеси катионов
Ag+, Cu2+, Zn2+ |
в |
водном растворе сначала будут восстанавливаться |
||||||||||||||||||
катионы серебра |
( Eo |
|
|
0,8B ), |
|
так как они обладают наибольшей |
||||||||||||||
|
|
Ag /Ag |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исполнитель: |
|
|
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
|
|
|
|
|
|
12 |
окислительной способностью, затем |
катионы меди |
( E0 |
2 |
/Cu |
0,34B. ) и |
||
|
|
|
|
Cu |
|
|
|
последними – катионы цинка ( Eo |
2 |
/Zn |
0,76B). |
(Перенапряжение для |
|||
Zn |
|
|
|
|
|
|
|
данных металлов, как указывалось выше, близко к нулю).
В интервале потенциалов катода |
+0,34В |
ЕК |
+0,80В могут |
восстанавливаться только ионы серебра: |
|
|
|
Ag+ + е |
= Ag. |
|
|
После выделения всего серебра из раствора потенциал катода можно сместить в область более отрицательных значений. При 0В  ЕК
ЕК  0,34В происходит выделение меди на катоде:
0,34В происходит выделение меди на катоде:
Cu2+ + 2e = Cu.
При смещении потенциала катода в область отрицательных значений ЕК  0
0
на катоде начинается разряд ионов водорода ( E0 |
0 B). Однако на |
2H /H |
|
2 |
|
многих металлах разряд ионов водорода происходит с очень большим перенапряжением (см. табл. 1). Поэтому скорость выделения водорода остается незначительной. Когда же потенциал катода достигает значения – 0,763В, на катоде с большой скоростью начинают разряжаться ионы цинка:
Zn2+ + 2e = Zn.
Скорость выделения водорода на катоде заметно увеличивается, когда потенциал катода достигает значений –1,0 … -1,2 В. (Более точно величину перенапряжения водорода на различных металлах см. в табл. 1). При этих значениях потенциала катода все электроны, поступающие на катод от внешнего источника тока, расходуются на восстановление ионов водорода или молекул воды:
2H2O + 2e = H2 + 2OH–.
По этой причине дальнейшее смещение потенциала катода в область более отрицательных значений в водных растворах становится невозможным, что обуславливает также невозможность восстановления ионов щелочных и щелочноземельных металлов, для разряда которых требуется очень низкий потенциал.
Анодные процессы
От анода электроны отводятся внешним источником тока, анод выполняет роль окислителя. Окислению на аноде могут подвергаться анионы, которые подходят к аноду, молекулы воды, а также сам материал анода. Вещества, которые окисляются на аноде, выполняют роль восстановителей.
Red – ne = Ох.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

13
Чтобы процесс на аноде протекал в указанном направлении, потенциал восстановителя (ЕОх/Red) должен быть меньше потенциала анода-окислителя
(ЕА):
ЕА ЕОх/Red .
Чем выше восстановительная способность частиц, (чем электроотрицательнее потенциал), тем легче это вещество окисляется на аноде. Скорость анодного процесса тем больше, чем сильнее смещен потенциал анода в область положительных значений.
Величина смещение потенциала анода (∆Е = ЕА – ЕОх/Red), необходимая для достижения определенной скорости окисления, называется анодным перенапряжением. Анодное перенапряжение означает смещение потенциала анода в положительную сторону, то есть оно имеет положительное значение. Анионы бескислородсодержащих кислот (Cl-, Br-, I -, S2- и др., кроме F-) окисляются на аноде с небольшим перенапряжением, то есть при потенциалах близких к равновесным значениям.
Особенностью электролиза растворов является наличие в них наряду с ионами электролита молекул воды, а также гидроксид-ионов, которые присутствуют в водных растворах за счет диссоциации воды или вводимых в
электролит для создания щелочной среды растворимых оснований. Поэтому при электролизе водных растворов следует учитывать также возможность окисления на аноде молекул воды или гидроксид-ионов с образованием кислорода:
2Н2О – 4е = О2 |
+ 4Н+ |
в кислой и нейтральной среде |
4ОН- - 4е = О2 |
+ 2Н2О |
в щелочной среде |
V
2Cl- - 2e = Cl2
2H2O – 4e = O2 + 4H+
1,23 |
1,36 E |
E |
1,75 E , в |
Поляризационные кривые анодного1 |
выделения2 |
A |
|
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

14
Эти процессы при потенциалах близких к равновесному значению потенциала кислорода ( E0O2 /2H2O  1,22B. ), идут с очень малой скоростью вследствие высокого перенапряжения кислорода.
1,22B. ), идут с очень малой скоростью вследствие высокого перенапряжения кислорода.
Используя величины равновесных |
электродных |
потенциалов |
и |
перенапряжений, можно решать |
такие важные |
задачи, |
как |
последовательность и возможность протекания на электродах нескольких реакций.
Для оценки последовательности и возможности совместного протекания на аноде при заданной плотности тока нескольких реакций находят сумму равновесного потенциала и перенапряжения для каждой из возможных реакций. На аноде при заданной плотности тока в первую очередь будет происходить та реакция, которая имеет более отрицательный потенциал, то есть сумма (ЕОх/Red + ∆ЕА) имеет наименьшее значение.
Если водный раствор содержит различные анионы, то при электролизе они разряжаются на аноде в порядке возрастания алгебраической суммы равновесного потенциала и перенапряжения для соответствующего иона. Так, из смеси анионов бескислородсодержащих кислот I- , Cl-, Br- в водном
растворе в первую очередь будут разряжаться ионы йода ( E0 |
/2I |
0,54B. ), |
I |
|
|
2 |
|
|
поскольку, судя по потенциалам, они являются наиболее сильным восстановителем:
2I- - 2e = I2 .
После выделения из раствора всего йода потенциал анода можно сместить, прилагая большее напряжение от внешнего источника тока, в более положительную сторону. При потенциале анода ЕА  1,23В начинается процесс окисления воды:
1,23В начинается процесс окисления воды:
2Н2О – 4е = О2 + 4Н+
с выделением на аноде кислорода ( E0O2 /2H2O  1,22B. ). Однако этот процесс
1,22B. ). Однако этот процесс
происходит с большим перенапряжением (см. табл. 1) и его скорость будет весьма мала даже тогда, когда потенциал анода достигнет значения 1,36В. При этом потенциале анода вследствие малой величины перенапряжения
хлора ( E0CI 2 /2CI 
 1,36B. ) начинают с большой скоростью разряжаться ионы хлора:
1,36B. ) начинают с большой скоростью разряжаться ионы хлора:
2Cl- - 2e = Cl2 .
При увеличении анодного потенциала до 1,7 – 1,9В происходит окисление воды с интенсивным выделением на аноде кислорода. Процесс выделения
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

15
кислорода происходит с большим перенапряжением (∆ЕО2 = 0,5-0,7В), вот почему скорость образования кислорода резко возрастает только при достижении величины потенциала анода 1,7 – 1,9В. (Более точно величина перенапряжения кислорода на различных металлах приведена в табл. 1).
Окисление воды требует значительно меньших энергетических затрат, чем разряд ионов фтора, для выделения которого требуется очень высокий
анодный потенциал ( E0 |
2,87B. ). Повышение напряжения |
на |
F /2F |
|
|
2 |
|
|
электролизере приводит лишь |
к дальнейшему окислению воды |
без |
дальнейшего увеличения анодного потенциала. Поэтому, фтор электролизом водных растворов получить невозможно.
Анионы кислородсодержащих кислот SO42-, PO43-, NO3- и др., в которых центральный атом имеет высшую степень окисления, при электролизе водных растворов обычно не разряжаются. (Ионы SO42- могут окисляться до S2O82- при высоком анодном потенциале, который обычно не достигается). Поэтому в их присутствии в растворе на нерастворимом аноде окисляются молекулы воды с образованием кислорода.
Характер реакций, протекающих на аноде, зависит как от присутствия молекул воды, так и от материала, из которого изготовлен анод.
Электролиз раствора соли, образованной металлом и бескислородсодержащей кислотой
Рассмотрим электролиз 1М раствора хлорида кадмия с платиновым анодом при рН = 3. (Кислая среда взята для предотвращения гидролиза соли). Хлорид кадмия диссоциирует в водном растворе на ионы:
CdCl2 = Cd2+ + 2Cl - .
При пропускании постоянного электрического тока через данный раствор в результате направленного движения ионов в растворе у катода будут накапливаться катионы Cd2+, Н+ и полярные молекулы воды, у анода – анионы Cl- и ОН - (последние имеются в незначительном количестве в результате ничтожно малой диссоциации воды), а также полярные молекулы воды.
Катодный процесс. В кислой среде на катоде возможны следующие процессы:
Cd2+ + 2e = Cd
2H+ + 2e = H2
Потенциал выделения кадмия равен равновесному потенциалу кадмия в данных условиях (перенапряжением можно пренебречь из-за малой величины):
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

16
ЕCd = ЕРCd + ЕCd . ∆ЕCd = 0. ЕРCd = Eo |
2 |
/Cd |
0,402B. |
Cd |
|
|
Потенциал выделения водорода с учетом рН среды и перенапряжения водорода на кадмиевом катоде (см. табл. 1) при плотности тока 0,1 А/см2:
ЕН2 = Eр2H /H2 + ∆ЕН2 = -0,059рН + ∆ЕН2 = -0,059•3 + (-0,93) = - 1,107В.
Потенциал выделения кадмия значительно больше потенциала выделения водорода, поэтому на катоде основным процессом будет выделение кадмия.
Cd2+ + 2e = Cd |
(быстро) |
Побочным – выделение водорода. |
|
2Н+ + 2е = Н2 |
(медленно) |
Анодный процесс. В указанном |
растворе на нерастворимом аноде |
возможны реакции окисления ионов Сl- и ОН- . 2Cl- - 2е = Сl2
4ОН- - 4е =O2 + Н2О
Рассчитаем равновесные потенциалы данных анодных реакций:
ЕРCl2 = |
E0 |
|
+ 0,059/2 lgРCl2/[Cl-]. |
|
|
CI 2 /2CI |
|
|
|
При парциальном |
давлении газообразного хлора (РСl2) |
равным 1 атм |
||
равновесный потенциал реакции окисления ионов хлора будет:
ЕСl2 = 1,36 + 0,059/2 lg1/22 = +1,342В.
(Для данного случая и для всех других для упрощения расчетов коэффициент активности солей будем брать равным единице).
При парциальном давлении кислорода РО2 = 1 атм. и концентрации гидроксид-ионов в растворе [ОН-] = 10-11 г-ион/л (рН = 3) равновесный потенциал реакции окисления гидроксильных ионов до газообразного кислорода будет равен :
ЕРО2 |
= E0 |
+ 0,059/4 lgРО2/[OH-] = 0,401 + 0,059/4 lg1/(10-11) = 1,05В |
|
O2 /4OH |
|
Как видно, равновесный потенциал кислородного электрода более отрицателен, чем равновесный потенциал хлорного электрода. Из сравнения равновесных потенциалов хлорного и кислородного электродов в данных условиях можно было бы заключить, что кислород будет выделяться на аноде раньше, чем хлор. Однако если учесть, что кислород имеет очень большое перенапряжение (даже на платине оно равно 0,39В), а хлор очень
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

17
малое (около 0,1В), то в действительности потенциал выделения хлора будет более отрицательным по сравнению с потенциалом выделения кислорода.
ЕРО2 + ∆ЕО2 = 1,05 + 0,39 = 1,44В.
На аноде, судя по потенциалам, основным процессом будет выделение хлора.
2Сl- - 2е = Cl2 |
(быстро) |
Побочным - окисление гидроксид-ионов или молекул воды:
4ОН- - 4е = О2 + 2Н2О (медленно) 2Н2О – 4е = О2 + 4Н+
Таким образом, при электролизе раствора хлорида кадмия происходит выделение на катоде кадмия и на аноде хлора. Суммарная реакция электролиза водного раствора хлорида кадмия будет:
CdCl2 = Cd + Cl2
В процессе электролиза концентрация хлорида кадмия в растворе будет уменьшаться.
Электролиз раствора соли, образованной металлом и кислородсодержащей кислотой
Рассмотрим электролиз водного раствора нитрата калия с нерастворимыми платиновыми электродами (среда нейтральная). Концентрация нитрата калия
– 1 моль/л. Из положительных ионов в растворе содержатся ионы К+ и Н+ , из отрицательных – ОН- и NO3-. Калий имеет очень отрицательный стандартный потенциал
(ЕК+/К = - 2,92В). Перенапряжением для калия ввиду его малой величины можно пренебречь.
Равновесный потенциал водородного электрода в нейтральной среде (рН=7) при РН2 = 1 атм. и Т = 298 К равен
E02H2O/H 2 = -0,059рН = 0,059٠7 = -0,414В.
Перенапряжение выделения водорода на платине равно нулю. Поэтому потенциал выделения водорода на платиновом катоде будет равен равновесному потенциалу водорода в нейтральной среде.
ЕН2 = Eр2H /H2 = -0,414 + (-0) = -0,414В.
Как видно, потенциал калия значительно отрицательнее потенциала выделения водорода. Катион К+ на катоде разряжаться не будет. На катоде будет выделяться водород:
2Н2О + 2е = Н2 |
+ 2ОН- |
|
(в нейтральной среде). |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исполнитель: |
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

18
В процессе электролиза в электролите в близи катода накапливаются ионы ОН- (это обуславливает увеличение щелочности и возрастание рН раствора у катода).
Платиновый анод в данном растворе является нерастворимым, поэтому на аноде будут окисляться отрицательно заряженные ионы. Равновесный потенциал кислородного электрода в нейтральной среде равен
EOр 2 /4OH = 1,23 – 0,059рН = +0,814В.
= 1,23 – 0,059рН = +0,814В.
Перенапряжение выделения кислорода на платиновом электроде равно 0,39В. Поэтому потенциал выделения кислорода на платиновом аноде будет равен
ЕО2 = EOр 2 /4OH + ∆ЕО2 = +0,814 + 0,39 = 1,204В.
+ ∆ЕО2 = +0,814 + 0,39 = 1,204В.
В ионе NO3- азот имеет высшую степень окисления. Поэтому нитрат-ион на аноде не разряжается. Единственно возможной реакцией окисления на аноде в данном случае является окисление ионов ОН- (или воды) до О2 :
4ОН- - 4е = О2 + 2Н20.
Ввиду малой концентрации ионов ОН-, в нейтральном растворе [H+] = [OH-] = 10-7 г-ион/л, можно считать, что на аноде идет окисление воды по реакции
2Н2О – 4е = О2 + 4Н+ .
Электролиз с растворимым анодом
В зависимости от окисляемости материала анода различают процессы с растворимым и нерастворимым (инертным) анодом. Если электродный потенциал металлического анода имеет более отрицательное значение, чем потенциал ионов ОН- или других веществ, присутствующих в растворе, то происходит растворение металла.
При этом протекает электролиз с растворимым анодом. Растворимые аноды в процессе электролиза растворяются и переходят в раствор в виде ионов металла:
Ме – nе = Меn+.
Если потенциал металлического анода близок к потенциалу других электродных процессов, то наряду с растворением металла на аноде протекают также другие процессы, например, разряд ионов ОН-. В этом случае также говорят об электролизе с растворимым анодом, но учитывают и другие анодные процессы. Если потенциал металла используемого в качестве анода, имеет более положительное значение, то протекает электролиз с нерастворимым анодом. В качестве нерастворимых (инертных) анодов применяют графит, золото, платиновые металлы, диоксид свинца, оксид рутения и другие вещества, имеющие положительные значения равновесных
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

19
электродных потенциалов. Инертные аноды при электролизе окислению не подвергаются. В случае электролиза с нерастворимым анодом в водных растворах на аноде происходит окисление анионов или молекул воды.
Процесс электролитического рафинирования состоит в анодном растворении загрязненного примесями (чернового) металла и последующем его катодном осаждении. Например, при рафинировании меди аноды, изготовленные из черновой меди, растворяются с образованием катионов меди:
Сu –2e = Cu2+. |
|
При этом все примеси металлов, имеющие электродный потенциал |
более |
положительный, чем потенциал меди, не окисляются и выпадают в |
виде |
осадка (шлама) на дно электролитической ванны. Среди примесей в меди нередко содержатся золото, серебро, селен, теллур, платина, представляющие большую ценность как драгоценные металлы и полупроводники. В шламе содержится от 12 до 30% меди, от 30 до 50% серебра, от 1 до 4% золота, от 5 до 14% селена, от О,3 до 1,1% теллура. Извлечение их из шлама в значительной степени компенсирует затраты электроэнергии на рафинирование меди. Цинк, никель, железо легко окисляются на аноде, но практически не восстанавливаются на катоде при потенциале восстановления ионов меди.
На катоде, изготовленном из листа чистой меди, происходит разряд катионов
меди:
Cu2+ + 2e = Cu
с образованием чистой рафинированной меди. Примеси металлов, имеющие более отрицательный, чем медь электродный потенциал, остаются в растворе. После электрорафинирования медь содержит не более 0,01% других металлов.
ЗАКОНЫ ЭЛЕКТРОЛИЗА
Количественная сторона электролиза основывается на законах Фарадея.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

20
Фарадей (Faraday) Майкл (1791-1867). Установил (1833-1834) законы электролиза, названные его именем.
I закон
Масса вещества, окисленного на аноде или восстановленного на катоде, пропорциональна количеству прошедшего через раствор или расплав электричества.
m = kQ
II закон
Массы окисляющихся или восстанавливающихся на электродах веществ при пропускании одного и того же количества электричества пропорциональны их химическим эквивалентам.
m = ЭQ/F или m = MIτ/nF
где m - масса окисленного или восстановленного вещества, г. Э - его химический эквивалент, г/моль
Q - количество кулонов электричества, прошедшего через электролит,
Кл. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
- число Фарадея, 96500 Кл (суммарный заряд одного моля |
|||||||||||||||||
электронов). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
I |
- |
сила тока, А. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
τ |
- |
продолжительность электролиза, с. |
|
|
|
|
|
|
|
|
|
||||||||
М - мольная масса вещества, г/моль. |
|
|
|
|
|
|
|
|
|
||||||||||
n |
- |
число моль электронов, которые требуются для образования одного |
|||||||||||||||||
моль вещества. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

21
При электролизе во многих случаях выделяется меньше вещества, чем должно получиться по законам Фарадея. Это объясняется тем, что наряду с основными электродными процессами окисления и восстановления при техническом электролизе практически всегда протекают побочные реакции (взаимодействие образовавшихся при электролизе веществ с электролитом, выделение наряду с металлом на катоде водорода и др.). Поэтому, для экономической оценки процесса электролиза вводят такие понятия, как выход по току и расход энергии на получение единицы продукции.
Выход по току
Выход по току (ВТ), являющийся одним из показателей эффективности использования электроэнергии в процессе электролиза, равен отношению теоретически необходимого количества электричества – QТЕОР. (по закону Фарадея) к практически затраченному при получении продукта – QПРАКТ.
|
Q ТЕОР |
|
ВТ = |
|
100% |
|
||
QПРАКТ
Выход по току можно определить также как отношение массы вещества, полученной в данных условиях электролиза (mпракт) к массе вещества, теоретически вычисленной на основании закона Фарадея (mтеор).
|
mпракт |
|
ВТ = |
--------- |
100% |
|
||
|
mтеор |
|
Величина выхода по току есть не что иное, как коэффициент “использования тока“. Его принято выражать в процентах.
Теоретически возможная масса вещества, выделяемая на электроде, определяется по количеству кулонов пропущенного электрического тока. По закону Фарадея при пропускании через электролит 96500 Кл электричества окисляется на аноде или восстанавливается на катоде 1 г-экв любого вещества.
Э |
Э |
mТЕОР = ---- Iτ |
= ---------- Iτ. |
F |
96500 |
где mТЕОР – теоретически рассчитанная масса вещества, г. Э - химический эквивалент металла, г/моль.
F |
- число Фарадея (96500 Кл). |
I |
- сила тока,А |
τ |
- продолжительность электролиза, с. |
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

22
На практике часто используют более крупную единицу измерения количества электричества - ампер-час. Поэтому число Фарадея (F = 96500Кл) заменяют равноценной величиной 26,8 ампер – часа (А-ч).
96500
F = ---------- = 26,8 А-ч. 3600
Тогда теоретически возможная масса вещества определяется по числу амперчасов пропущенного электрического тока.
|
|
|
Э |
Э |
|
|
|
mТЕОР = ----- Iτ |
= ---------- Iτ, |
|
|
|
F |
26,8 |
где |
τ |
- |
продолжительность электролиза, час. |
|
Выход по току рассчитывается по формуле |
||||
|
|
|
mПРАКТ ·F |
|
|
|
|
ВТ = --------------- 100, |
|
|
|
|
Э I τ |
|
где |
ВТ - |
выход по току, %; |
|
|
|
mПРАКТ - масса фактически выделившегося вещества, г; |
|||
|
I |
- сила тока, А; |
|
|
Э - химический эквивалент вещества,г/моль;
τ- продолжительность электролиза, (если постоянная Фарадея (F) берется в Кл, то время в секундах, если в А-ч, то время
в часах).
При электролизе с получением металлов практическую массу металла определяют путем взвешивания катода до и после электролиза. Эквивалентная масса металла рассчитывается по формуле:
ЭМе = А/n, где А - атомная масса металла, г/моль;
n - число электронов, принимаемых ионами металла на катоде.
Толщину слоя металлического покрытия вычисляют по формуле:
|
|
|
IKЭВТτ100 |
|
|
|
|
|
||||||||||
|
|
h = ----------------- , |
|
|
|
|
|
|||||||||||
|
|
|
F ρ |
|
|
|
|
|
||||||||||
где h - |
толщина покрытия, мкм; |
|
|
|
|
|
||||||||||||
ρ - |
плотность металла, г/см3; |
|
|
|
|
|
||||||||||||
ВТ - |
выход металла по току,%; |
|
|
|
|
|
||||||||||||
Э - |
эквивалентная масса металла, г/моль; |
|
|
|
|
|
||||||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

23
F - постоянная Фарадея, Кл или А-ч;
τ - продолжительность электролиза, с. или час.; IК - катодная плотность тока, А/см2.
Катодная плотность тока рассчитывается по формуле:
IК = I/SК ,
где I - сила тока, А;
SК - площадь катода, см2.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Электродные
потенциалы

УМК «ХИМИЯ»
Тема лекции: Электродные
потенциалы
Лектор – Иванов М.Г.

Цель лекции:
изложение основных понятий электродных потенциалов на границе металлраствор электролита в рамках современной химической теории
Компетенции, формируемые у студента:
Умения:
прогнозировать на основе современных представлений о строении атомов и химической связи, возможность протекания ОВ реакций в расплавах и растворах электролитов.

СОДЕРЖАНИЕ
Основные понятия Носители заряда
Связь электродного потенциала и энергии Гиббса Водородный электрод Уравнение Нернста
Потенциалы газовых электродов Диаграммы Латимера Диаграммы Пурбе Гальванический элемент
Элемент Даниэля Гальванический элемент с инертными электродами
Литература

Основные понятия |
содержание |
|
По типу носителей заряда проводники электрического тока делят на две группы: в проводниках первого рода ток переносят электроны (металлы, полупроводники), в проводниках второго рода – ионы (растворы и расплавы электролитов).
Электродом называется проводник первого рода, контактирующий с проводником второго рода:

Основные понятия |
содержание |
|
При погружении металла M в раствор, содержащий одноименные ионы Mn+ устанавливается динамическое равновесие между катионами Мn+, находящимися в растворе, и атомами М на поверхности электрода:
Me – ne + mH O |
[Me(H O) |
]n+ |
2 |
2 m |
|
|
|
|
Если преобладает прямая реакция, то пластина заряжается положительно, а раствор вблизи электрода отрицательно. Если преимущественно идёт обратная реакция, то пластина заряжается отрицательно, а раствор вблизи электрода – положительно.

Основные понятия |
содержание |
|
Электродный потенциал служит мерой изменения свободной энергии Гиббса ( G) в системе и указывает на направление окислительновосстановительного процесса:
Gо = – ЕоnF
G <0, когда E > 0 Самопроизвольный процесс
Gо = – RT•lnK |
|
O |
|
RT |
|
|
|
|
|
|
|
E |
|
nF ln K |
|||
|
|
||||

Основные понятия |
содержание |
|
За величину электродного потенциала данного электрода в водородной шкале принимают ЭДС гальванического элемента:
Me/[Me(H2O)m]n+ (H2, H2SO4)/Pt
Стандартные значения потенциалов электродов (E0), при условиях: температура 298,15 К, давление газа (для газовых электродов) 1,013•105 Па,
концентрация потенциалопределяющих ионов - 1 моль/л.

Уравнение Нернста |
содержание |
|
R F
T n
=8,314 Дж/(моль К) – универсальная газовая постоянная;
=96500 Кл/моль - постоянная Фарадея (заряд одного моля электронов);
–абсолютная температура, К;
–число электронов;
символы в квадратных скобках означает молярную концентрацию вещества.

Уравнение Нернста |
содержание |
|
для ионно-металлического электрода:
для водородного электрода:

Уравнение Нернста |
содержание |
|
При температуре 298,15 К уравнение Нернста для, полуреакции
MnO4 + 8H+ + 5e = Mn2+ + 4H2O
примет вид
E |
|
/Mn |
2 |
|
MnO |
|
|
|
4 |
|
|
=
Eo |
|
|
2 + |
0,059 lg |
[MnO4 ][H+]8 |
MnO4 |
/Mn |
|
5 |
[Mn2+] |
|

 Уравнение Нернста
Уравнение Нернста
Для реакций
2H |
|
2e H |
|
||
|
|
2 |
O2 + 4e + 4H+ = 2H2O;
содержание
E |
|
|
|
|
|
E |
o |
|
|
0,059pH |
||
2H |
|
/H |
|
|
2H |
|
/H |
|||||
|
2 |
|
|
|
2 |
|||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||
E |
0 |
|
|
|
|
|
1,23 0,059pH. |
|||||
O |
/2H |
2 |
O |
|||||||||
|
|
|
|
|
|
|||||||
|
2 |
|
|
|
|
|
|
|
|
|
||

Диаграммы Латимера |
содержание |
|
Диаграммы Латимера - это простой и удобный способ описания окислительновосстановительных свойств, проявляемых элементом в различных степенях окисления
E |
|
E |
1 |
|
2 |
A |
B |
C |
|
E |
|
|
3 |
|
если Е2>Е1, то ион «В» термодинамически неустойчив, и диспропорционирует на «А» и С».

Диаграммы Латимера |
содержание |
|
pH = 14
pH = 0

Диаграммы Латимера |
содержание |
|
(при рН = 0)
неустойчивыми в кислой среде будут ионы MnO42- :
1MnO42¯ + 2e + 4H+ = MnO2 + 2H2O
2MnO42¯ – e = MnO4¯
3 MnO42¯ + 4H+ = MnO2 + 2H2O + 2 MnO4¯
∆Ео = ЕоОх - EоRed = 2,26 – 0,56 = 1,17B.

Диаграммы Пурбе |
содержание |
|
25°C: [Cu] = 10-4 M.

Гальванический элемент |
содержание |
|
Элемент Даниэля

Гальванический элемент |
содержание |
|
Элемент Даниэля
Zn / ZnSO4 CuSO4 / Cu
Cu2+ + 2e = Cuo (катод, восстановление)
Zno – 2e = Zn2+ (анод, окисление)
Zn0 + Сu2+ = Zn2+ + Cu0
ЭДС = ЕоОх - EоRed = 0,34 – (– 0,76) = 1,1B

Гальванический элемент с |
содержание |
|
инертным электродом
Zn / ZnSO4 KMnO4, H2SO4, MnSO4, /С
2 |
MnO + 5e +8H+ = Mn2+ |
+ 4H O (катодный процесс ) |
|
4 |
2 |
5 |
Zno - 2e = Zn2+ |
(анодный процесс) |
2 MnO4 + 5Zn + 16H+ = 2Mn2+ + 5Zn2+ +8H2O
ЭДС = ЕоОх - EоRed = 1,51 – (– 0,76) = 2,27B

Выводы и заключения |
содержание |
|
|
|
Электродные потенциалы является важнейшей является частью неорганической химии.
Знание законов Фарадея, а также понятие электродного потенциала позволяет охарактеризовать электрохимические процессы.

Список литературы |
содержание |
|
1. Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа.
2002.
2. О.М. Полторак, Л.М. Ковба. «Физико-химические основы неорганической химии». М.: МГУ, 1994.
3. В.И. Горшков, И.А. Кузнецов. «Физическая химия». М.: МГУ,
1993.
4. А. Джонсон. Термодинамические аспекты в курсе неорганической химии. М.: Мир. 1985.
5. Анорганикум. Под ред. Л. Кольдица. М. Мир. 1984. Т.1. 6.
Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность. М., Химия, 1987.
7. Фичини Ж., Ламброзо-Бадер Н., Депезе Ж.-К. Основы физической химии. М. Мир. 1972. стр.276-283.
8. Дж. Кемпбел. Современная общая химия. М.:Мир. 1975г. Т.2.
стр.90. гл.20., Т3.
9. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. М.:
Мир,1982. Т. 2.
10. Б.Б.Дамаскин, О.А.Петрий. Электрохимия. М: Высшая школа,
1987.
11. CRC Hand book of Chemistry and Physics. 82 издание. 2001-2002.

Электролиз

УМК «ХИМИЯ»
Тема лекции: Электролиз
Лектор – Иванов М.Г.

Цель лекции:
изложение основных понятий электролиза
водных растворов и расплав электролитовий в рамках современной химической теории
Компетенции, формируемые у студента:
Умения:
прогнозировать на основе современных
представлений о строении атомов и
химической связи, реакции, протекающие при
электролизе в расплавах и растворах
электролитов.

СОДЕРЖАНИЕ
Основные понятия Электролиз расплавов электролитов
Электролиз водных растворов электролитов Катодные процессы
Поведение ионов металлов Перенапряжение
Анодные процессы Перенапряжение Поведение анионов
Электролиз с растворимым анодом Законы электролиза Литература

Основные понятия |
содержание |
|
Электролиз – это совокупность окислительно-восстановительных процессов, которые протекают на электродах, помещенных в раствор или расплав электролита, под действием постоянного электрического тока, приложенного от внешнего источника.
Основные понятия:
Отрицательный полюс источника постоянного тока присоединяют к электроду, который называют
катодом; положительный полюс к электроду, который называют анодом.
Основные понятия |
содержание |
|
- |
+ |
Катод |
Анод |
Схема простейшего электролизера

Основные понятия |
содержание |
|
Е = -nF/ G
E > 0, ΔG < 0 - самопроизвольный процесс протекает в прямом направлении (гальванический элемент).
Если ЭДС будет отрицательной, то самопроизвольное протекание ОВР становится невозможным.
E < 0, ΔG > 0 - для проведения реакции в прямом направлении необходимо приложить внешнюю ЭДС (электролиз).

Электролиз расплавов |
содержание |
|
электролитов
В простейших бинарных электролитах типа MeHal , MeHal2 (Me
– металл IA или IIA группы Пеpиодической системы, Hal – галоген) на катоде выделяется свободный металл, а на аноде – (галоген)
При этом на катоде протекает полуреакция восстановления катиона металла:
Men+ + ne = Me
на аноде - полуреакция окисления галогенид-аниона:
2Cl- - 2e = Cl2

Электролиз расплавов |
содержание |
|
электролитов
При электролизе расплава гидродифторида калия (анод
– угольный, катод – никелевый) протекает следующие реакции
На катоде: |
На аноде: |
2НF - + 2е = Н |
2 |
+ 4F- |
2НF |
- - 2е = F + 2HF |
2 |
|
2 |
2 |
2НF + 2е = Н |
2 |
+ 2F- |
2F |
- - 2е = F |
|
|
2 |
2 |

Электролиз водных растворов |
содержание |
|
При электролизе растворов необходимо учитывать присутствие ионов растворителя, которые при определенных условиях могут разряжаться на электродах. Так, при электролизе водных растворов, следует учитывать присутствие ионов воды:
Н2О ↔ Н+ + ОН-

Катодные процессы |
содержание |
|
На катоде идет процесс восстановления окислителя:
Ox + ne = Red
Me |
|
+ ne = Me 2Н + 2е = Н2 |
|
|
n+ |
+ |
(в кислой среде) |
2Н2О + 2е = 2ОН- + Н2
(в нейтральной и щелочной средах)

Катодные процессы |
содержание |
|
При электролизе водных растворов все металлы можно разделить на три группы:
1. Металлы, осаждение которых на катоде не сопровождается выделением водорода. К ним относятся металлы, стоящие в ряду стандартных потенциалов за водородом (медь, серебро, золото и др.).
2. Металлы, осаждение которых на катоде сопровождается выделением водорода. В ряду стандартных потенциалов эти металлы находятся между марганцем и водородом
(-1,0 ЕОМеn+/Ме 0).
3. Металлы, которые в водных растворах не могут быть получены. В эту группу входят щелочные, щелочноземельные металлы, а также магний и алюминий.

Катодные процессы |
содержание |
|
Выделение водорода на катоде происходит с высоким перенапряжением, в то время как перенапряжение при разряде металлов гораздо меньше.
V
Zn2+ + 2e = Zn
2H+ + 2e = H2
0 |
-0,763 Е1 |
Е2 |
-1,1 -ЕК, |
в
С учетом перенапряжения: E2H /H2 -1,1

Анодные процессы |
содержание |
|
На аноде идет процесс окисления восстановителя:
Red – ne = Ох
Me - ne = Men+ |
2Н О – 4е = О + 4Н+ |
|
|
2 |
2 |
Растворимый анод |
В кислой и нейтральной среде |
|
2Cl- - 2e = Cl |
2 |
4ОН- - 4е = О |
2 |
+ 2Н О |
|
|
2 |
Разряд анионов |
В щелочной среде |

Анодные процессы |
содержание |
|
Выделение кислорода на аноде происходит с высоким перенапряжением, в то время как перенапряжение при разряде хлора гораздо меньше.
V
2Cl- - 2e = Cl2
2H2O – 4e = O2 + 4H+
1,23 |
1,36 E1 E2 |
1,8 EA, в |
С учетом перенапряжения: EO2/2H2O 1,8B.

Анодные процессы |
содержание |
|
Анионы кислородсодержащих кислот SO42-, PO43-, NO3- и др., в которых центральный атом имеет высшую степень окисления, при электролизе водных растворов не разряжаются.
Ионы галогенов: Cl-, Br-, I- в водном растворе легко разряжаются:
2Hal- - 2e = Hal2
Фтор электролизом водных |
0 |
2,87B. |
растворов получить невозможно: |
EF2 /2F |

Анодные процессы |
содержание |
|
Пpи высоких анодных плотностях тока
некотоpые анионы могут окисляться до
пеpоксоанионов, напpимеp:
2SO42− − 2e = S2O82−
H2PO4− + 2OH−−2e = H2PO5− +H2O

Электролиз с растворимым |
содержание |
|
|
анодом |
|
|
Электролиз с растворимым анодом используют для рафинирования некоторых металлов – меди, никеля, серебра, золота, свинца, олова и других, для нанесения защитных и декоративных покрытий на поверхность металлических изделий.
Процесс электролитического рафинирования состоит в анодном растворении загрязненного примесями (чернового) металла и последующем его катодном осаждении.
Me - ne = Men+

Законы электролиза |
содержание |
|
Установил (1833-1834) законы электролиза, названные его именем.
Фарадей (Faraday) Майкл
(1791-1867).

Законы электролиза |
содержание |
|
I закон. Масса вещества, окисленного на аноде или восстановленного на катоде, пропорциональна количеству прошедшего через раствор или расплав электричества.
m = kQ
II закон. Массы окисляющихся или восстанавливающихся на электродах веществ при пропускании одного и того же количества электричества пропорциональны их химическим эквивалентам.
M(г) = MIT/nF V(л) = 22,4IT/nF

Законы электролиза |
содержание |
|
Число Фарадея F
- это фундаментальная постоянная, равная
заряду одного моля электронов.
F = e·NA = 1,60218·10-19Кл·6,022045·1023моль-1 = 96484,6 Кл/моль ≈ ≈ 96500 Кл/моль
e – заряд одного электрона
NA – число Авогадро

Выводы и заключения |
содержание |
|
|
|
Электролиз является важнейшей является
частью неорганической химии.
Знание законов электролиза, определяющих
зависимость между количеством прошедшего электричества и количеством вещества,
выделяющимся на электроде позволяет, а
также понятие электродного потенциала
позволяет охарактеризовать электрохимические процессы.

Список литературы |
содержание |
|
1. Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа. 2002.
2. О.М. Полторак, Л.М. Ковба. «Физико-химические основы неорганической химии». М.: МГУ, 1994.
3. В.И. Горшков, И.А. Кузнецов. «Физическая химия». М.:
МГУ, 1993.
4. А. Джонсон. Термодинамические аспекты в курсе неорганической химии. М.: Мир. 1985.
5. Анорганикум. Под ред. Л. Кольдица. М. Мир. 1984. Т.1. 6.
Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность. М., Химия, 1987.
7. Фичини Ж., Ламброзо-Бадер Н., Депезе Ж.-К. Основы физической химии. М. Мир. 1972. стр.276-283.
8. Дж. Кемпбел. Современная общая химия. М.:Мир. 1975г.
Т.2. стр.90. гл.20., Т3.
9. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии.
М.: Мир,1982. Т. 2.
10. Б.Б.Дамаскин, О.А.Петрий. Электрохимия. М: Высшая школа, 1987.
11. CRC Hand book of Chemistry and Physics. 82 издание.
2001-2002.

Энергетика химических превращенийений.. 1йзакон термодинамикиики
Лекция 1

Признаки химической реакции
изменение цвета
появление запаха изменение вкуса
выпадение осадка
свечение
увеличение объема
выделение тепла, разогревание, взрыв
поглощение тепла,
охлаждение
возникновение э.д.с.
Почему происходит реакция |
термодинамика |
Как происходит реакция |
кинетика |

Система
Мир / "среда" |
СИСТЕМА |
Энергия Энергия Энергия
Изолированная |
Закрытая |
Открытая |
Вещество Вещество Вещество
♦ Система - конкретный объект исследования,
выделенный из окружающего мира реально существующими или воображаемыми границами.
Состояние системы
♦ Система характеризуется присущими ей свойствами
Экстенсивные свойства –
суммирующиеся (V, m, ...)
Интенсивные свойства –
выравнивающиеся при контакте систем (p, T, c, ...)
♦ Совокупность свойств определяет состояние системы,
Уравнение состояния F(p, V, T, ...) = 0
pV = nRT (уравнение состояния идеального газа)

Свойства системы
9 Полное изменение свойств системы (p, V, ...) не зависит от пути изменения системы, но определяется начальным и конечным состояниями системы
9 Величины, изменение которых зависит от пути изменения системы, не являются свойствами системы
9 Если изменение величины не зависит от пути
превращения, то эта величина является свойством
системы

Свойства системы
9 Полное изменение свойств системы (p, V, ...) не зависит от пути изменения системы, но определяется начальнымФункция состоянияи конеч ым состоянне зависитямиотсистемыпути процесса ! 9 Величины, изменение которых зависит от пути изменения системы, не являются свойствами системы
9 Если изменение величины не зависит от пути
превращения, то эта величина является свойством
системы
