
- •Хлор. Электронное строение атома, молекулы. В природе. Получение и применение. Химические свойства (примеры реакций с водой, металлами и неметаллами). Соляная кислота.
- •Взаимодействие с водой:
- •Общая характеристика элементов via группы. Положение в периодической системе, строение и размер атомов, физические и химические (окислительно-восстановительные) свойства простых веществ.
- •Кислород. Нахождение в природе, получение и применение. Озон. “Озоновый щит”.
- •Кислотные и окислительно-восстановительные свойства, получение и применение серной кислоты.
- •Строение молекулы, физические и химические свойства, получение и применение аммиака. Свойства гидроксида и солей аммония.
- •Оксиды азота. Получение и свойства, образование в атмосфере и экологическая роль оксидов азота (II) и (IV).
- •Углеводороды. Нахождение в природе (газовые гидраты), а также получение и применение.
- •Карбонаты в природе. Получение и применение оксида углерода (IV). Сода.
- •Оксид кремния (IV). Кремниевая кислота. Силикагель. Гидролиз силикатов. Выветривание. Применение в промышленности (строительные материалы).
- •Алюминий. Нахождение в природе. Получение и применение.
- •Алюминий. Кислотно-основные свойства оксида и гидроксида, их применение.
- •Общая характеристика элементов iia группы. Положение в периодической системе, строение и размер атомов, физические и химические свойства простых веществ.
- •Жесткость воды. Цели и методы ее устранения. Образование сталактитов и сталагмитов. Опреснение морской воды (промышленные методы).
- •Первый ряд переходных элементов (3d-элементы). Строение атомов и проявляемые валентности. Примеры реакций получения простых веществ.
- •Гидроксиды 3d-элементов в состояниях высшей степени окисления (кислотно–оснόвные и окислительно-восстановительные свойства).
- •Железо. Строение атома и проявляемые валентности. В природе. Получение.
- •Железо. Строение атома. Оксиды и гидроксиды железа (II) и (III). Получение и свойства.
- •Взаимодействие с гироксидом натрия:
- •Взаимодействие с гидроксидом натрия:
- •Viiв группа. Строение атомов и проявляемые степени окисления. Сравнение с элементами viiа группы.
- •Оксиды и гидроксиды марганца (кислотно-оснόвные и окислительно-восстановительные свойства).
- •Viв группа. Строение атома, проявляемые степени окисления хрома. Гидроксиды (кислоты и основания) хрома.
- •Нахождение в природе элементов iia группы. Получение оксидов магния и кальция. Кислотно-основные характеристики и взаимодействие с водой оксидов и гидроксидов.
- •Iв группа. Строение атомов, проявляемые степени окисления. Сравнение свойств простых веществ с элементами iа группы в реакциях с водой и кислотами. Соединения меди (I), (II).
Классы химических соединений. Приведите примеры и назовите по три кислоты, основания и соли. Как можно идентифицировать (узнать среди других) выбранные вами
Химические соединения бывают трех видов:
Кислота – электролит, диссоциирующий в растворах с образованием ионов водорода (HCl,
 ,
,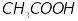 )
)Основание – акцептор протона, частица (молекула или ион) которая способна принимать ион водорода – протон (NaOH,
 ,
Са(ОН)2)
,
Са(ОН)2)Соли – электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы отличные от гидроксид-ионов. (
 ,
, ,
NaCl)
,
NaCl)
HCl – реагирует с карбонатами с выделением газа; - если кислота концентрированая, то можно взять стеклянную трубочку, обмокнуть ее в кислоту и провести по бумаге, если умага будет обугливаться – то кислота серная. Так же можно измерить плотность с помощью ареометра, у серной кислоты плотность около 1,84 г/мл.; - определима по характерному запаху.
NaOH – можно провести реакцию с алюминием, алюминий будет растворяться, и будет выделяться водород; - при нагревании до 350 градусов будет разлогаться на оксид магния и воду. Оксид магния – бесцветные кристаллы, белого цвета; Са(ОН)2 - Качетсвенной реакцией на гидроксид кльция будет - Са(ОН)2 + СО2 → СаСО3↓ + Н2О, как итог – помутнение воды.
NaCl – провести реакцию с нитратом серебра (
 )
хлорид серебра выпадет в виде белых
хлопьев и укажет нам наличие ионов Cl,
а ионы натрия будут окрашивать цвет
пламени в желтый цвет;
-
провести качественную реакцию -
)
хлорид серебра выпадет в виде белых
хлопьев и укажет нам наличие ионов Cl,
а ионы натрия будут окрашивать цвет
пламени в желтый цвет;
-
провести качественную реакцию -
 ,
кремневая кислота выпадет в виде
студенистого осадка-геля;
- под действием уксуса начнет шипеть.
,
кремневая кислота выпадет в виде
студенистого осадка-геля;
- под действием уксуса начнет шипеть.
Водород. Строение атома. Изотопы. Окислительно–восстановительные свойства водорода. В природе. Получение, применение. "Водородная энергетика".
Водород был открыт в XVI веке Парацельсом.
Водород – бесцветный газ, не имеющий
запаха. При температуре ниже -240
 он сжижается под давлением.
он сжижается под давлением.
Водород – самый легкий из всех газов, он в 14,5 раз легче воздуха. Водород хорошо растворим в некоторых металлах (Ni,Pt), и мало растворим в воде. Молекулы водорода быстрее молекул всех других газов распространяются в среде другого вещества (самая быстрая диффузия).
Водород имеет три изотопа:
 -
протий,
-
протий,
 - дейтерий и
- дейтерий и
 -
тритий. Протий и D стабильны,
тритий – радиактивен (полураспал –
12,5 лет). Молекула водорода состоит из
двух атомов. Атом имеет структурную
формулу
-
тритий. Протий и D стабильны,
тритий – радиактивен (полураспал –
12,5 лет). Молекула водорода состоит из
двух атомов. Атом имеет структурную
формулу
 - один электрон на единственном электронном
слое. У него отсутствует промежуточный
электрон между валентным электроном и
ядром. Ион водорода, представляет собой
протон, размер которого на несколько
порядков меньше размеров любого другого
катиона. Водород не способен образовывать
ионных соединений, в которых он выступал
бы в качестве катиона, в следствие его
огромного поляризующего действия. Атом
водорода способен так же присоединять
один электрон. При этом образуется
отрицательно заряженный ион с электронной
оболочой как у гелия. Водород имеет
двойственную химическую природу,
проявляя как окислительную, так и
востановительную способность. В
большинстве реакций он выступает в
качестве восстановителя, образуя
соединения, в которых степень его
окисленности равна +1. В реакциях с
активными металлами он выступает в
качестве окислителя: степень его
окисслености в этих соединениях равна
-1. В свободном состоянии на Земле водород
встречается в незначительных количествах,
но в виде соединений весьма распрастранен.
1/9 массы воды. Водород состовляет 17% от
общего числа атомов в земной коре. В
космосе водород – самый распрастраненный
элемент. На его додя приходиться половина
массы Солнца и большинства других звезд.
В промышленности водород получают
главным образом из природного газа.
Этот газ смешивают с водяным паром и
кислородом. При нагревании этой смеси
до 800-900
в присутствии катализатора происходит
реакция
- один электрон на единственном электронном
слое. У него отсутствует промежуточный
электрон между валентным электроном и
ядром. Ион водорода, представляет собой
протон, размер которого на несколько
порядков меньше размеров любого другого
катиона. Водород не способен образовывать
ионных соединений, в которых он выступал
бы в качестве катиона, в следствие его
огромного поляризующего действия. Атом
водорода способен так же присоединять
один электрон. При этом образуется
отрицательно заряженный ион с электронной
оболочой как у гелия. Водород имеет
двойственную химическую природу,
проявляя как окислительную, так и
востановительную способность. В
большинстве реакций он выступает в
качестве восстановителя, образуя
соединения, в которых степень его
окисленности равна +1. В реакциях с
активными металлами он выступает в
качестве окислителя: степень его
окисслености в этих соединениях равна
-1. В свободном состоянии на Земле водород
встречается в незначительных количествах,
но в виде соединений весьма распрастранен.
1/9 массы воды. Водород состовляет 17% от
общего числа атомов в земной коре. В
космосе водород – самый распрастраненный
элемент. На его додя приходиться половина
массы Солнца и большинства других звезд.
В промышленности водород получают
главным образом из природного газа.
Этот газ смешивают с водяным паром и
кислородом. При нагревании этой смеси
до 800-900
в присутствии катализатора происходит
реакция
 .
Полученную смесь газов разделяют. В
лабараториях водород получают большей
частью электролизом водных растворов
NaOH или KOH.
Электроды изготавливают из листового
никеля. Так же распространен метод
выделения водорода из растворов серной
или соляной кислот действием на них
цинка.
.
Полученную смесь газов разделяют. В
лабараториях водород получают большей
частью электролизом водных растворов
NaOH или KOH.
Электроды изготавливают из листового
никеля. Так же распространен метод
выделения водорода из растворов серной
или соляной кислот действием на них
цинка.
Водород исмпользуют для восстановления
некоторых цветных металлов и их оксидов,
пользуясь тем, что водород может отнимать
кислород от многих соединений. Например,
если пропускать водород надо накаленным
оксидом меди, то происходит ее
восстановление:
 .
В химической промышленности водород
используют для синтеза хлорводорода,
аммиака, идущего в свою очередь на
производство азотной кислоты и удобрений,
для получения метилового спирта и других
органических соединений. Водородная
энергетика – отрасль энергетики
основанная на использовании водорода
в качестве средства для аккумулирования,
транспортировки и потребления энергии
людьми, транспортной инфраструкртурой
и различными производственными
направлении.
.
В химической промышленности водород
используют для синтеза хлорводорода,
аммиака, идущего в свою очередь на
производство азотной кислоты и удобрений,
для получения метилового спирта и других
органических соединений. Водородная
энергетика – отрасль энергетики
основанная на использовании водорода
в качестве средства для аккумулирования,
транспортировки и потребления энергии
людьми, транспортной инфраструкртурой
и различными производственными
направлении.
Бинарные соединения водорода. Приведите примеры кислотных, оснόвных и амфотерных гидридов. Продемонстрируйте их свойства на примере реакций с водой.
Водород образует бинарные соединения
почти со всеми элементами (со всеми
металлами, и с неметаллами имеющими
меньшую электроотрицательность чем
водород). Такие соединения называют
гидридами. Все гидриды металлов –
нестойки и при нагревани разлагаются
на металл и водоро. При действии на них
воды протекает ОВР, в готорой гидрид-ион
 выступает
в качестве восстановителя, а водород
воды в качестве окислителя:
выступает
в качестве восстановителя, а водород
воды в качестве окислителя:

Кислотные гидриды – силаны (#
 )
) .
Силаны очень легко окисляются, так же
являются очень хорошими восстановителями.
Легко гидролизуются.
.
Силаны очень легко окисляются, так же
являются очень хорошими восстановителями.
Легко гидролизуются.Основные гидриды – NaH.
 .
Сильный восстановитель
.
Сильный восстановительАмфотерные гидриды -
 .
.
 .
Сильный восстановитель
.
Сильный восстановитель
Общая характеристика элементов VIIA группы. Положение в периодической системе, строение и размер атомов, физические и химические (окислительно-восстановительные) свойства простых веществ.
Входящие в VIIA группу элементы: фтор, хлор, бром, иод и астат называются галогенами (солерождающими). Название из за способности взаимодействовать с металлами с образованием типичных солей.
Во внешнем электронном слое содержат
7 электронов ( ).
Обладают значительным сродством к
электрону – их атомы легко присоединяют
электрон, образуя однощщарядные
отрицательные ионы, обладающие электронной
стурктурой соответствующего благородного
газа (
).
Обладают значительным сродством к
электрону – их атомы легко присоединяют
электрон, образуя однощщарядные
отрицательные ионы, обладающие электронной
стурктурой соответствующего благородного
газа (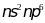 ).
Это характеризует их как типичные
неметаллы. Аналогичное строение наружного
электронного слоя обуславливает большое
сходство (химические свойства, типы и
свойства образуемых соединений) галогенов
друг с другом. С повышением порядкового
номера элементов в ряду F-At
увеличиваются радиусы атомов (от
0,064нм), уменьшается электроотрицательность,
ослабевают неметаллические свойства
и оксилителная способность элементов.
Галогены проявляют степени окислености
от -1 до +7, за исключением фтора – он
всегда -1.
).
Это характеризует их как типичные
неметаллы. Аналогичное строение наружного
электронного слоя обуславливает большое
сходство (химические свойства, типы и
свойства образуемых соединений) галогенов
друг с другом. С повышением порядкового
номера элементов в ряду F-At
увеличиваются радиусы атомов (от
0,064нм), уменьшается электроотрицательность,
ослабевают неметаллические свойства
и оксилителная способность элементов.
Галогены проявляют степени окислености
от -1 до +7, за исключением фтора – он
всегда -1.
Физические свойства: Все галогены обладают очень резким запахом. Их вдыхание опасно. Молекулы простых веществ, образуемые атомами галогенов – двухатомны. В ряду F-At возрастает поляризуемость молекул, в следствие чего возрастают температуры плавления и кипения галогенов. Галогены малорастворимы в воде.
Химические свойства: Свободные галогены проявляют чрезвычайно высокую химическую активность. Они вступают во взаимодействие почти со всеми простыми веществами. Галогены способны присоединять электроны. Галогены – очень энергичне окислители.
Хлор. Электронное строение атома, молекулы. В природе. Получение и применение. Химические свойства (примеры реакций с водой, металлами и неметаллами). Соляная кислота.
Внешний электронный слой атома: .
На валентном уровне атома хлор содержиться
1 неспаренный электрон, по этому
валентность равная 1 очень стабильна
для хлора. Может провлять и другие
валентности благодоря незанятой орбитали
d-подуровня. Возможные
степени окисления - +1;-1;+3;+5;+7 Известны
соединения в которых атом хлора формально
проявляет валентность 4 и 6:
.
На валентном уровне атома хлор содержиться
1 неспаренный электрон, по этому
валентность равная 1 очень стабильна
для хлора. Может провлять и другие
валентности благодоря незанятой орбитали
d-подуровня. Возможные
степени окисления - +1;-1;+3;+5;+7 Известны
соединения в которых атом хлора формально
проявляет валентность 4 и 6:
 .
Молекула хлора – двухатомная
.
Молекула хлора – двухатомная

При обычных условия хлор – ядовитый газ желто-зеленого цвета, с резким запахом.
В природе встречаются два изотопа
хлора:
 ,
,
 .
В земной коре – хлор самый распространенный
галоген. Хлор соединяется почти со всеми
элементами Таблицы Менделеева. В природе
встречается только в виде соединений
в составе минералов (NaCl
– галит, KCl – сильвин).
Самые большие запасы хлора в составе
солей вод морей и океанов. (нормальное
давление) При температуре -34 С хлор
становитсья жидким, при температуре
ниже 101 С жидкий хлор кристализуется.
.
В земной коре – хлор самый распространенный
галоген. Хлор соединяется почти со всеми
элементами Таблицы Менделеева. В природе
встречается только в виде соединений
в составе минералов (NaCl
– галит, KCl – сильвин).
Самые большие запасы хлора в составе
солей вод морей и океанов. (нормальное
давление) При температуре -34 С хлор
становитсья жидким, при температуре
ниже 101 С жидкий хлор кристализуется.
Хлор получают в настоящее время в
больших количествах путем электролиза
водных растворов NaCl и
KCl. Хлор выделяется у
анода. В лабораториях хлор получают
действием различных окислителей на
соляную кислоту. Например:
 .
Так же: если пропускать HCl
и
.
Так же: если пропускать HCl
и
 через трубку, нагретую до 400 С и содержащую
кусочки пемзы, на которх распределен в
качестве катадизатора хлорид меди (II)
через трубку, нагретую до 400 С и содержащую
кусочки пемзы, на которх распределен в
качестве катадизатора хлорид меди (II)
 ,
то происходит окисление хлорводорода
кислородом:
,
то происходит окисление хлорводорода
кислородом:

Взаимодействие с металлами:
 ,
,

Взаимодействие с неметаллами:
 ,
,

Взаимодействие с водой:
Соляная кислота (HCl) – раствор хлорводорода в воде . Бесцветная, «дымящая» на воздухе, едкая жидкость. Максимальная концентрация 38%. Соли соляной кислоты называют хлоридами.. Соляную кислоту получают растворением газообразного хлорводорода в воде.
Общая характеристика элементов via группы. Положение в периодической системе, строение и размер атомов, физические и химические (окислительно-восстановительные) свойства простых веществ.
Элементы VIA группы –
Кислород, сера, селен, теллур и полоний.
Полоний радиоактивен. Во внешней
электронной оболочке атомы этих элементов
содеожат 6 электронов – два на s
орбитали и 4 на p-орбитали.
Кислород отличается отсутствием
d-подуровня во внешнем
электронном слое ( ).
У сстп (по первым буквам элементов) число
неспаренных электронов в атоме может
быть увеличено путем перевода s-
и p- электронгов на
d-подуровень внешнего
слоя. В свзяи с этим сстп проявляют
ковалентность равную не только 2, но
также 4 и 6.
).
У сстп (по первым буквам элементов) число
неспаренных электронов в атоме может
быть увеличено путем перевода s-
и p- электронгов на
d-подуровень внешнего
слоя. В свзяи с этим сстп проявляют
ковалентность равную не только 2, но
также 4 и 6.
Ксст – неметаллы, полоний – металл. В своих соединениях они проявляют как отрицательную, так и положитеьную окисленность. В соединениях с металлами и с водородом их степень окисленности, как правило равна -2. В соединениях с неметаллами она может иметь значение +4 или +6.
Физические свойства и химические свойства закономерно изменяются с увеличением порядкового номера. Появляение новых электронных слоев влечет за собой увеличение радиусов атомов, уменьшение электроотрицательности, понижение окислитенльной активности незаряженных атомов и усиление восстановительных свойст атомов со степенью окисленности -2. Неметаллические свойства ярко выраженные у кислорода, оказываются очень ослабленными у теллура. Радус атомов увеличивается с 0,066 у кислорода.
