
- •Закон постоянства состава. Условия его выполнения. Классифицируйте следующие соединения на вещества постоянного и переменного состава:
- •Атомная единица массы. Моль. Молярные масса и объем веществ в различных агрегатных состояниях. Вычислите молярный объем
- •Влияние температуры на химическое равновесие. Причины влияния. Приведите 2 примера реального использования изменения температуры для смещения равновесия
- •Влияние концентрации на химическое равновесие. Причины влияния. Приведите по 2 примера реального использования изменения концентрации реагента или продукта для смещения равновесия
- •Влияние температуры на скорость химической реакции. Причины влияния. Уравнение Аррениуса. Приведите 2 примера реального использования изменения температуры для изменения скорости.
- •Примеры:
- •Электролиты, определение. Жидкие электролиты (2 примера). Механизм электропроводности растворов электролитов.
- •Протолитические равновесия. Константа равновесия. Приведите три примера
- •Условия образования и растворения осадка:
- •Симплексные и комплексные соединения. Координационное число. Константа устойчивости.
- •Примеры овп:
- •Примеры овп в природе:
- •Симметрии ао.
- •36. Заполнение ао электронами. Принцип Паули. Правило Хунда. Энергетические диаграммы элементов
- •Ионизационный потенциал и сродство к электрону атомов (порядок величин, единицы измерения). Закономерности изменения при движении по
- •Химическая связь. Перекрывание ао (s-, p-мо). Характеристики связи: энергия, длина, полярность (определения, единицы измерения).
- •Cвязывающие, несвязывающие и антисвязывающие мо. Кратность связи. (На примере молекул
- •Электронное строение веществ, образованных из атомов. Металлы, неметаллы, полупроводники.
- •Водородная связь (энергия водородной связи в сравнении с другими видами связи). Свойства воды, обусловленные водородными связями.
Симметрии ао.
Электронные облака s-электронов
первого, второго и последующих слоев
обладают сферической симметрией так
как графики их функций
 и
не зависят от расстояния
и
не зависят от расстояния
Э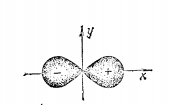
 лектронные
облака p-электронов,
второго и последующих слоев обладают
формой двойной груши или гантели. Это
связано с тем, что высота (глубина)
максимума зависит от направления
радиус-вектора r. В некотором
направлении выоста максимума наибольшая.
В направлениях, состовляющих угол с
осью х, высота максимума тем меньше, чем
больще этот угол.
лектронные
облака p-электронов,
второго и последующих слоев обладают
формой двойной груши или гантели. Это
связано с тем, что высота (глубина)
максимума зависит от направления
радиус-вектора r. В некотором
направлении выоста максимума наибольшая.
В направлениях, состовляющих угол с
осью х, высота максимума тем меньше, чем
больще этот угол.
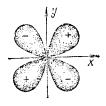
Электронные облака d-электронов обладают четырехлепестковой формой, причем знаки волновой фунции в лепестках чередуются.
36. Заполнение ао электронами. Принцип Паули. Правило Хунда. Энергетические диаграммы элементов
Принцип Паули – в атоме не может быть двух электронов, у которых все четыре квантовых числа били бы одинаковы. Каждая атомная орбиталь может быть занята не более чем двумя электронами, спины которых противоположны по абсолютному значению.
Спаренные электроны – электроны находящиеся на одной орбитали и обладающие противоположно направленными спинами
Неспаренные электроны – одиночный электрон занимающий орбиталь.
На s-подуровне, m=0, значит на нем имеется всего одна орбиталь. Максимальное количество электронов равно 2.
На p-подуровне, (m=(-1;0;1)), имеется три орбитали, каждая из которых занята максимум двумя электронами. Максимальное количество электронов равно 6.
На d-подуровне, (m обладает пятью значениями), имеется пять орбиталей, каждая из которых занята максимум двумя электронами. Максимальное количество электронов равно 10.
На f-подуровне – максимальное количество электронов равно 14.
Максимальное количество электронов на подуровне с орбитальным числом l = 2(2l+1)
Наиболее устойчивое состояние электрона в атоме соответствует минимальному возможному значению его энергии. Любое другое его состояние называется возбужденным – неустойчивым
Заполнение АО электронами:
H -
 ,
He -
,
He -
 - первый период завершен, так как
заканчивается заполнение ближайшего
к ядру слоя.
- первый период завершен, так как
заканчивается заполнение ближайшего
к ядру слоя.
Li -
 ,
Be -
,
Be -
 - заняты все s-орбитали,
начинается заполнение p-орбиталей
- заняты все s-орбитали,
начинается заполнение p-орбиталей
B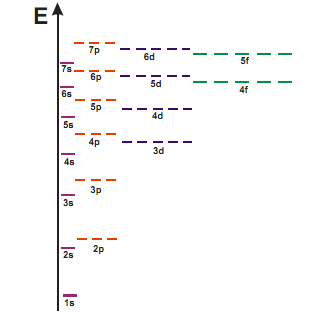 -
-
 ,
C-
,
C-
 ,
N -
,
N -
 ,
после заполнения каждой p-орбитали
одним электроном, начинается полное
заполнение p-орбиталей
,
после заполнения каждой p-орбитали
одним электроном, начинается полное
заполнение p-орбиталей
O -
 ,
F -
,
F -
 ,
Ne -
,
Ne -
 - второй период завершен
- второй период завершен
H,He,Li,Be – s-элементы Li, Be,B,C,N,O,F,Ne – p-элементы
Третий период, подобно второму,
начинается с двух s-элементов,
за которыми следует 6 p-элементов.
После аргона (Ar -
 )
у калия и кальция формируется s-подуровень
4ого слоя, вместо заполнения третьего
электронного слоя. Это происходит потому
что подуровень 4s
характеризуется более низкой энергией,
чем подуровень 3d, что
связанно с более сильным экранированием
d-электронов в сравнении
с s-электронами. В
соответствии с этим размещение внешних
электронов на 4s-подуровне
соответствует наиболее устойчивому
состоянию атомов. Последовательность
заполнения АО подчиняется первому
правилу Клечковского: при увеличении
заряда атома последовательное заполнение
электронных орбиталей происходит от
орбиталей с меньшим значением суммы
n+l к орбиталям
с большим значением этой суммы
)
у калия и кальция формируется s-подуровень
4ого слоя, вместо заполнения третьего
электронного слоя. Это происходит потому
что подуровень 4s
характеризуется более низкой энергией,
чем подуровень 3d, что
связанно с более сильным экранированием
d-электронов в сравнении
с s-электронами. В
соответствии с этим размещение внешних
электронов на 4s-подуровне
соответствует наиболее устойчивому
состоянию атомов. Последовательность
заполнения АО подчиняется первому
правилу Клечковского: при увеличении
заряда атома последовательное заполнение
электронных орбиталей происходит от
орбиталей с меньшим значением суммы
n+l к орбиталям
с большим значением этой суммы
Правило Хунда – устойчивому состоянию атомасоответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Правило Хунда не запрещает другого распределения электронов на подуровне.
Положение элементов в периодической системе соответствует электронному строению их атомов.
Четвертый период -

