
- •Закон постоянства состава. Условия его выполнения. Классифицируйте следующие соединения на вещества постоянного и переменного состава:
- •Атомная единица массы. Моль. Молярные масса и объем веществ в различных агрегатных состояниях. Вычислите молярный объем
- •Влияние температуры на химическое равновесие. Причины влияния. Приведите 2 примера реального использования изменения температуры для смещения равновесия
- •Влияние концентрации на химическое равновесие. Причины влияния. Приведите по 2 примера реального использования изменения концентрации реагента или продукта для смещения равновесия
- •Влияние температуры на скорость химической реакции. Причины влияния. Уравнение Аррениуса. Приведите 2 примера реального использования изменения температуры для изменения скорости.
- •Примеры:
- •Электролиты, определение. Жидкие электролиты (2 примера). Механизм электропроводности растворов электролитов.
- •Протолитические равновесия. Константа равновесия. Приведите три примера
- •Условия образования и растворения осадка:
- •Симплексные и комплексные соединения. Координационное число. Константа устойчивости.
- •Примеры овп:
- •Примеры овп в природе:
- •Симметрии ао.
- •36. Заполнение ао электронами. Принцип Паули. Правило Хунда. Энергетические диаграммы элементов
- •Ионизационный потенциал и сродство к электрону атомов (порядок величин, единицы измерения). Закономерности изменения при движении по
- •Химическая связь. Перекрывание ао (s-, p-мо). Характеристики связи: энергия, длина, полярность (определения, единицы измерения).
- •Cвязывающие, несвязывающие и антисвязывающие мо. Кратность связи. (На примере молекул
- •Электронное строение веществ, образованных из атомов. Металлы, неметаллы, полупроводники.
- •Водородная связь (энергия водородной связи в сравнении с другими видами связи). Свойства воды, обусловленные водородными связями.
Примеры овп:
1)
 .
Валентность водорода повышается с 0 до
+1, он окисляется, а валентность хлора
понижается от 0 до -1, он восстонавливается.
Водород – восстновитель, хлор –
окисилитель.
.
Валентность водорода повышается с 0 до
+1, он окисляется, а валентность хлора
понижается от 0 до -1, он восстонавливается.
Водород – восстновитель, хлор –
окисилитель.
2)
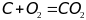 Углерод окисляется, а кислород
восстанавливается.
Углерод окисляется, а кислород
восстанавливается.
Окислительно-восстановительные процессы (редокс-процессы) – сопряженные реакции, они невозможны поотдельности. Если в реакции что-то окислилось, то в ней непременно участвует окислитель, котороый при этом восстанавливается, и наооборот. Суммы валентностей всех элементов слева в редокс-реакциях равны сумме валентностей всех элементов справа от знака равенства.
Метод полуреакций:
Когда реакция протекает в гальваническом элементе или осуществляется путем электролиза, то каждая полуреакция протекает на соответствующем электроде. Такие полуреакции называют электродными процессами.
На первом этапе процесс окисления и восстановления записывается отдельно, а затем уравнения полуреакций складываются.
Пример:
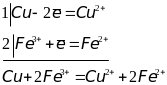
Примеры овп в природе:
Процесс дыхания
Извержение вулкана
Электродный потенциал. Стандартный электродный потенциал.
Каждая окислительно-восстановительная реакция слагается из полуреакций окисления и восстановления. Когда реакция протекает в гальваническом элементе или осуществляется путем электролиза, то каждая полуреакция протекает на соответствующем электроде. Такие полуреакции называют электродными процессами.
Гальванический элемент – устройство, которые применя/т для непосредственного преобразования химической реакции в электрическую энергию
Электролиз – совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита.
Электродвижущая сила – максимальное напряжение гальванического элемента, соответствующее обратимому протеканию реакции.
Электродные потенциалы (равновесные потенциалы) – электродвижущие силы которые представленны в виде разности двух величин, каждая из которых отвечает данной полуреакции. Измеряется в вольтах.
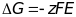
На примере
медноцинкового элемента:

Разбиваем на
полуреакции:
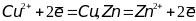
Э.д.с. этого элемента
(Е) можно представить как разность
электродных потенциалов, один из которых
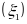 отвечает первой, а другой
отвечает первой, а другой
 -
второй из записанных полуреакций.
-
второй из записанных полуреакций.
 .
Изменение энергии Гиббса
.
Изменение энергии Гиббса
 ,
которое отвечает термодинамичеки
обратимому восстановлению одного моля
ионов меди, равно
,
которое отвечает термодинамичеки
обратимому восстановлению одного моля
ионов меди, равно
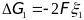 ,
а изменение энергии Гиббса
,
а изменение энергии Гиббса
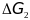 ,
отвечающее термадинамиески обратимому
окислению одного моля атомов цинка,
равно
,
отвечающее термадинамиески обратимому
окислению одного моля атомов цинка,
равно
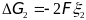 .
В общем случае любому электродному
процессу:
.
В общем случае любому электродному
процессу:
 соответствует электродный потециал
соответствует электродный потециал
 и изменение энергии Гиббса, равное
и изменение энергии Гиббса, равное
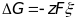
Величины электродных процессов зависят от:
Природы веществ – участинков электродного процесса
Соотношения между концентрациями (сторого говоря активностями, но при не выскоих концентрация – погрешность приемлима) этих веществ
От температуры системы. Эта зависимость
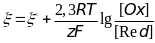 .
.
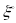 -
стандартный электродный потенциал.
-
стандартный электродный потенциал.
Стандартный электродный потенциал – потенциал данного электродного процесса при концентрациях (точнее говоря активностей) всех участвующих в нем веществ, равных единице.
При стандартной
температуре

Для построения
численной шкалы электродных потенциалов,
нужно потенциал какого-либо электродного
процесса принять за ноль. В качестве
эталона для создания такой шаклы принят
электродный процесс
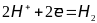 .
Изменение энергии Гиббса в этой рекции
при стандартных условиях принимается
равным нулю.
.
Изменение энергии Гиббса в этой рекции
при стандартных условиях принимается
равным нулю.
Если электродный процесс выражается уравнением
 ,
то он равен
,
то он равен
 -
уравнение Нернста
-
уравнение НернстаЕсли электродный процесс выражается уравнением
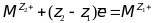 ,
то он равен
,
то он равен

Ряд электродных
потенциалов
- Li,K,Ca,Na,Al,Zn,Fe,Cr,Pb,
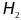 ,Cu,Ag,Pt,Au.
Ряд расположен в порядке возрастания
электродного потенциала реакции
,Cu,Ag,Pt,Au.
Ряд расположен в порядке возрастания
электродного потенциала реакции
Атомная орбиталь (АО). Квантовые числа. s, p, d-АО (симметрия).
Атомная орбиталь – состояние электрона в атоме, характеризующееся определенными значениями квантовых чисел n,l,m (определенными размерами, формой, ориентацией в пространстве)
Вероятность обнаружения электрона в
нектором малом объеме
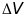 выражается произведением квадрата
волновой фунции на этот объем
выражается произведением квадрата
волновой фунции на этот объем
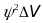 .
ТАким образом
.
ТАким образом
 выражает плотность вероятности нахождения
электрона в соответствующей области
пространства.
выражает плотность вероятности нахождения
электрона в соответствующей области
пространства.
Квантовое число – значение целого
числа n в формуле
 .
Выаод формулы:
.
Выаод формулы:
Состояние электрона в атоме характеризуется
волной де Бройля. Волня де Бройлся –
стоячая волна. Стоячая волна образовывается
при условии, что
 ,
,
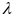 -
длина волны, l –длина
одномерного атома, n –
целое число.
-
длина волны, l –длина
одномерного атома, n –
целое число.
Согласно уравнению де Бройля
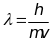 ,
отсюда
,
отсюда
 ,
теперь находим кинетическую энергию
электрона
,
теперь находим кинетическую энергию
электрона
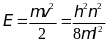 .
Значение 4х квантовых чисел (одно из
этих чисел – спин) в трехмерной системе
определяет состояние электрона.
.
Значение 4х квантовых чисел (одно из
этих чисел – спин) в трехмерной системе
определяет состояние электрона.
Главное квантовое число (n) – определяет возможные энергитические состояния электрона в атоме и размер электронного облака. Наименьшей энергией электрон обладает при n=1, с увиличением n энергия элетрона возрастает. Состояние электрона, характеризующееся определенным значением главного квантового числа, называют энергитическим уровнем электрона.
Орбитальное квантовое число (l, побочное, азимутальное) – величина определяющая форму электронного облака. Оно принимает значения от 0 до (n-1). Состояние электрона, характеризующиеся различными значениями l, называют энергитическими подуровнями. Такие подуровни называются s,p,d,f (0,1,2,3 соответственно). Состояние электрона в атоме, отвечающее определенным значениям n и l, записывается следующим образоом: сначала цифрой указывается значение главного квантового числа, а затем буквой – орбитального квантового числа.\
Магнитное квантовое число (m) – определяет ориентацию электронного облака в пространстве. Оно принимает значение от –l до +l. Некоторому l значению соответствует 2l+1 значения m.
С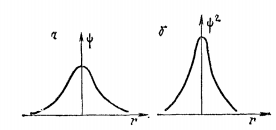 пиновое
квантовое число – величина определяющая
собственное состояние электрона
пиновое
квантовое число – величина определяющая
собственное состояние электрона
