
- •Закон постоянства состава. Условия его выполнения. Классифицируйте следующие соединения на вещества постоянного и переменного состава:
- •Атомная единица массы. Моль. Молярные масса и объем веществ в различных агрегатных состояниях. Вычислите молярный объем
- •Влияние температуры на химическое равновесие. Причины влияния. Приведите 2 примера реального использования изменения температуры для смещения равновесия
- •Влияние концентрации на химическое равновесие. Причины влияния. Приведите по 2 примера реального использования изменения концентрации реагента или продукта для смещения равновесия
- •Влияние температуры на скорость химической реакции. Причины влияния. Уравнение Аррениуса. Приведите 2 примера реального использования изменения температуры для изменения скорости.
- •Примеры:
- •Электролиты, определение. Жидкие электролиты (2 примера). Механизм электропроводности растворов электролитов.
- •Протолитические равновесия. Константа равновесия. Приведите три примера
- •Условия образования и растворения осадка:
- •Симплексные и комплексные соединения. Координационное число. Константа устойчивости.
- •Примеры овп:
- •Примеры овп в природе:
- •Симметрии ао.
- •36. Заполнение ао электронами. Принцип Паули. Правило Хунда. Энергетические диаграммы элементов
- •Ионизационный потенциал и сродство к электрону атомов (порядок величин, единицы измерения). Закономерности изменения при движении по
- •Химическая связь. Перекрывание ао (s-, p-мо). Характеристики связи: энергия, длина, полярность (определения, единицы измерения).
- •Cвязывающие, несвязывающие и антисвязывающие мо. Кратность связи. (На примере молекул
- •Электронное строение веществ, образованных из атомов. Металлы, неметаллы, полупроводники.
- •Водородная связь (энергия водородной связи в сравнении с другими видами связи). Свойства воды, обусловленные водородными связями.
Влияние температуры на скорость химической реакции. Причины влияния. Уравнение Аррениуса. Приведите 2 примера реального использования изменения температуры для изменения скорости.
Р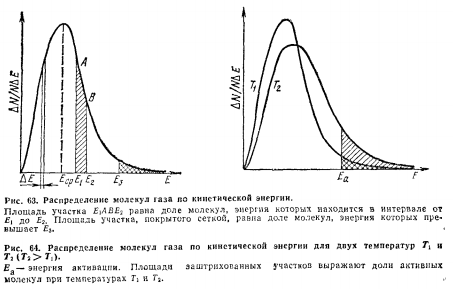 еакция
осуществляется посредством взаимоударения
молекул. Но не все соударения приводят
к образованию продукта реакции, так как
часть молекул не обладает энергией
активации, то есть являются неактивными.
В реакцию вступают только активные
молекулы. При росте температуры
увеличивается число активных молекул,
соответственно количество соудоряющихся
молекул увеличивается, а значит и
скорость химической реакции так же
увеличивается. В качествее примера мы
можем взять распределение для газа,
находящегося при постоянной температуре.
По горизональной оси отложена энергия
E одной молекулы газа, а
по вертикальной – доля общего числа
молекул обладающих энергией, лежащей
в узком интервале от E до
еакция
осуществляется посредством взаимоударения
молекул. Но не все соударения приводят
к образованию продукта реакции, так как
часть молекул не обладает энергией
активации, то есть являются неактивными.
В реакцию вступают только активные
молекулы. При росте температуры
увеличивается число активных молекул,
соответственно количество соудоряющихся
молекул увеличивается, а значит и
скорость химической реакции так же
увеличивается. В качествее примера мы
можем взять распределение для газа,
находящегося при постоянной температуре.
По горизональной оси отложена энергия
E одной молекулы газа, а
по вертикальной – доля общего числа
молекул обладающих энергией, лежащей
в узком интервале от E до
 ,
деленная на величину этого интервала
,
деленная на величину этого интервала
 .
Общее число молекул газа обозначим за
N, а их долю, обладающую
энергией, лежащей в указанном интервале,
через
.
Общее число молекул газа обозначим за
N, а их долю, обладающую
энергией, лежащей в указанном интервале,
через
 ,
тогда откладываемая на оси ординат
величина будет равна
,
тогда откладываемая на оси ординат
величина будет равна
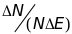 .
Рассмотрим столбик шириной
и высотой, равной ординате кривой.
Площадь такого столбика будет равна
,
тоесть доде молекул, энергия которых
лежит в интервале
.
Аналогично площадь ограниченная кривой,
двумя ординатами и осью абцисс, равна
доле молекул газа, энергия которых лежит
в промежутке
.
Рассмотрим столбик шириной
и высотой, равной ординате кривой.
Площадь такого столбика будет равна
,
тоесть доде молекул, энергия которых
лежит в интервале
.
Аналогично площадь ограниченная кривой,
двумя ординатами и осью абцисс, равна
доле молекул газа, энергия которых лежит
в промежутке
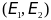 .
Кривая на рисунке 63 показывает, что
молекулы газа, находящегося при постоянной
температуре, обладают различной энергией.
Наибольшая их часть имеет энергию,
равную некоторой средней величине
.
Кривая на рисунке 63 показывает, что
молекулы газа, находящегося при постоянной
температуре, обладают различной энергией.
Наибольшая их часть имеет энергию,
равную некоторой средней величине
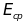 ,
или близкую к ней. Но имеются молекулы
энергия которых большe или меньше
.
При этом, чем сильнее отличается энергия
от
,
тем меньшая доля молекул газа обладает
такой энергией.
,
или близкую к ней. Но имеются молекулы
энергия которых большe или меньше
.
При этом, чем сильнее отличается энергия
от
,
тем меньшая доля молекул газа обладает
такой энергией.
Рис. 64. Кривая, относящаяся к температуре
T2,
смещенна вправо, в сторону более высоких
энергий. Если мы отметим энергию активации
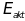 на рисунке, то мы увидим что доля молекул
газа, энергия которых превышает
,
резко возрастает с повышением температуры.
на рисунке, то мы увидим что доля молекул
газа, энергия которых превышает
,
резко возрастает с повышением температуры.
Правило Вант-Гоффа - В интервале
температур от
 до
до
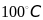 при повышении температуры на каждые
10 градусов скорость химической реакции
возрастает в 2-4 раза
при повышении температуры на каждые
10 градусов скорость химической реакции
возрастает в 2-4 раза
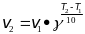
Уравнение Аррениуса:
 ,
А – характеризует частоту столкновений
реагирующих веществ, R –
универсальная газовая постоянная
,
А – характеризует частоту столкновений
реагирующих веществ, R –
универсальная газовая постоянная
Примеры:
Синтез Аммиака (
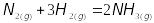 ),
при комнатной температуре – эта реакция
незаметна
),
при комнатной температуре – эта реакция
незаметна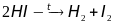
Влияние концентрации на скорость химической реакции. Причины влияния. Приведите 2 примера реального использования изменения концентрации реагента для изменения скорости реакции.
Скорость реакции пропорциональна числу соударений, которые претерпевают молекулы реагирующих веществ. Число соудорений тем больше, чем выше концентрация каждого из исходных веществ. При повышении концентрации хотя бы одного из реагирующих вещест скорость реакции возрастает в соответствеии с кинетическим уравнением
1)
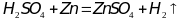 при повышении концентрации серной
кислоты скорость реакции будет
увеличиваться
при повышении концентрации серной
кислоты скорость реакции будет
увеличиваться
2)
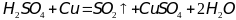 - пока концентрация серноой кислоты не
достигент определенного значения
реакция будет прохожить очень медленно,
но при увеличении концентрации скорость
реакции востановления серной кислоты
медью до сернистого газа будет
увеличиваться.
- пока концентрация серноой кислоты не
достигент определенного значения
реакция будет прохожить очень медленно,
но при увеличении концентрации скорость
реакции востановления серной кислоты
медью до сернистого газа будет
увеличиваться.
Растворы (твердые, жидкие, газообразные — по 2 примера). Способы выражения концентрации растворов. Процентная и молярная концентрации, мольная доля.
Раствор – гомогенная смеь, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
Растворитель – компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твердого вещества с твердым, растворителем считается компонент количество которого в растворе преобладает.
Растворы бывают: твердыми, жидкими и газообразными.
Твердые растворы – фазы переменного состава, в которых атомы различных элементов расположенны в общей кристаллической решетке. Способность образовывать растворы свойственна всем кристаллическим твердым телам. По существу, все кристаллические вещества, считающиеся чистыми, представляют собой твердые растворы с очень малы содержанием примисей.
Чугун, SiO2.
Жидкие расторы – это жидкие вещества взаимодействующие между собой или с веществами в других агрегатных состояних.
Раствор
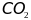 в воде, раствор сахара в чае.
в воде, раствор сахара в чае.
Газообразные растворы – это смеси газов.
Воздух, NO2
Растворы бывают разбавленными и концентрированными.
Разбавленные – растворы с низским содержанием растворенного вещества.
Концентрированные – растворы с выскоим содержанием растворенного вещества.
Состав раствора может выражаться разными способами – как с помощью долей или процентов, так и с помощью концентрации.
Молярная концентрация (молярность)
– отношение количества растворенного
вещества к объему раствора. Обычно
обозначается
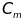 или
M. Так, 2М
или
M. Так, 2М
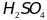 означает
раствор, в каждом литре которого
содержиться 2 моля серной кислоты, т.е.
=2моль/л
означает
раствор, в каждом литре которого
содержиться 2 моля серной кислоты, т.е.
=2моль/л
Процентная концентрация (массовая доля) – отношение (обычно прцентное) массы растворенного вещества к массе раствора. Например 15% (масс.) водный раствор хлорида натрия – это такой раствор, в 100 единицах массы которого содержиться 15 единиц массы NaCl и 85 единиц массы воды.
Мольная доля (молярная доля) – отношение
количества растворенного вещества (или
растворителя) к сумме количеств всех
веществ, состовляющих раствор. В случае
раствора одного вещества в другом
мольная доля растворенного вещества
(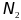 )
равна
)
равна
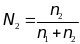 ,
а мольная доля растворителя (
,
а мольная доля растворителя (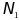 )
равна
)
равна
 ,
где
,
где
 -
соответственно количества вещества
расторителя и растворенного вещества.
-
соответственно количества вещества
расторителя и растворенного вещества.
