
- •Закон постоянства состава. Условия его выполнения. Классифицируйте следующие соединения на вещества постоянного и переменного состава:
- •Атомная единица массы. Моль. Молярные масса и объем веществ в различных агрегатных состояниях. Вычислите молярный объем
- •Влияние температуры на химическое равновесие. Причины влияния. Приведите 2 примера реального использования изменения температуры для смещения равновесия
- •Влияние концентрации на химическое равновесие. Причины влияния. Приведите по 2 примера реального использования изменения концентрации реагента или продукта для смещения равновесия
- •Влияние температуры на скорость химической реакции. Причины влияния. Уравнение Аррениуса. Приведите 2 примера реального использования изменения температуры для изменения скорости.
- •Примеры:
- •Электролиты, определение. Жидкие электролиты (2 примера). Механизм электропроводности растворов электролитов.
- •Протолитические равновесия. Константа равновесия. Приведите три примера
- •Условия образования и растворения осадка:
- •Симплексные и комплексные соединения. Координационное число. Константа устойчивости.
- •Примеры овп:
- •Примеры овп в природе:
- •Симметрии ао.
- •36. Заполнение ао электронами. Принцип Паули. Правило Хунда. Энергетические диаграммы элементов
- •Ионизационный потенциал и сродство к электрону атомов (порядок величин, единицы измерения). Закономерности изменения при движении по
- •Химическая связь. Перекрывание ао (s-, p-мо). Характеристики связи: энергия, длина, полярность (определения, единицы измерения).
- •Cвязывающие, несвязывающие и антисвязывающие мо. Кратность связи. (На примере молекул
- •Электронное строение веществ, образованных из атомов. Металлы, неметаллы, полупроводники.
- •Водородная связь (энергия водородной связи в сравнении с другими видами связи). Свойства воды, обусловленные водородными связями.
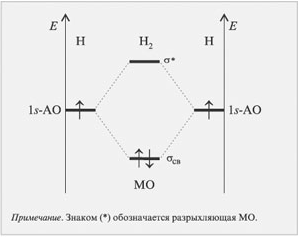
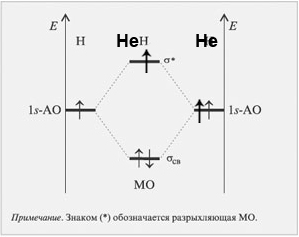
Cвязывающие, несвязывающие и антисвязывающие мо. Кратность связи. (На примере молекул
МО которую описывает уравнение: называется связывающей. МО обеспечивает большую плотность между ядрами по сравнению с простой суммой электронных плотностей отдельных атомов, это обуславливает притяжение ядер. Она имеет более низкую энергию, чем АО из которых она образовалась.
МО которую описывает уравнение: называется разрыхляющей (антисвязывающей). МО понижает электронную плотность между ядрами, что приводит к их отталкиванию. При это энергия системы повышается в сравнении с изолированными атомами. Энергия этой МО больше чем энергия образующих ее ядер.
Если АО практически не изменяется при образовании молекулы – такая связь МО называется несвязывающей.
Кратность связи -
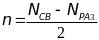
1) Кратность свзяи: Н2 = 1
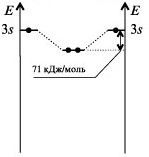
HeH=0,5
3)
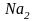 =1
=1
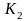

2) Кратность связи:
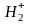 =0,5
=0,5
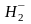 =0,5
=0,5
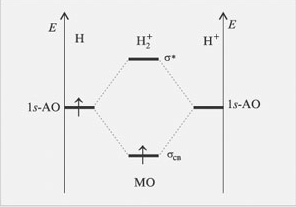
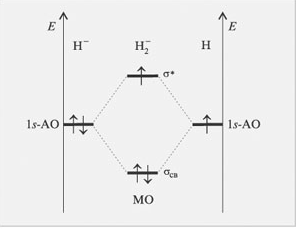
Заполнение МО электронами. Принцип Паули. Правило Хунда Кратность и относительная прочность связи (что такое "прочность связи"?). На примере энергетических диаграмм двухатомных молекул, образованных элементами 1-го периода.
Заполнение МО электронами происходит так же как и заполнение АО.
Принцип Паули – в атоме не может быть двух электронов, у которых все четыре квантовых числа били бы одинаковы. Каждая атомная орбиталь может быть занята не более чем двумя электронами, спины которых противоположны по абсолютному значению.
Правило Хунда – устойчивому состоянию атомасоответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Правило Хунда не запрещает другого распределения электронов на подуровне.
Кратность связи -
О тносительнаю прочность связи можно оценить по энергии, которая необходима для разрыва связей между атомами в разных соединениях. Эта энергия дается для одинакового числа молекул таких соединений. Чем выше кратность связи – тем она короче и прочнее.
Кратность связи:
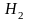 =1,
=0,5,
=0,5,
HeH=0,5
=1,
=0,5,
=0,5,
HeH=0,5
Прочность связи: прочная, непрочная, непрочная, непрочная.
Электронное строение веществ, образованных из атомов. Металлы, неметаллы, полупроводники.
Все металлы характеризуются сравнительной легкостью отдачи валентных электронов, способностью образовывать положительно заряженные ионы и проявлять в своих соединениях только положительную окисленность. В свободном состоянии все металлы – востановители. Внешние электроны в атомах металлов находятся на значительном удалении от ядра и связаны с ним сравнительно слабо – атомы металла характеризуются низкими потенциалами ионизации и близким к нулю или отрицательным сродством к электрону.
Металлы в кристалическом состоянии имеют «свободные» электроны, способные под действием даже слабых электрических полей перемещатся по кристаллу.
Н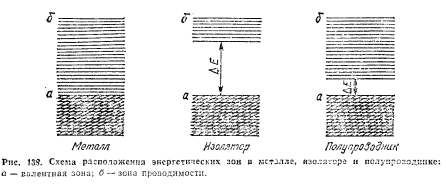 еметаллы
такими электронами – необладают.Их
свойства обусловленны тем, что их зона
проводимости отделена от валентной
зоны запрещенной зоной (значительным
энергетическим промежутком
).
В изоляторах электроны не могут свободно
перемещаться по кристаллу и служить
переносчиками электрического тока.
еметаллы
такими электронами – необладают.Их
свойства обусловленны тем, что их зона
проводимости отделена от валентной
зоны запрещенной зоной (значительным
энергетическим промежутком
).
В изоляторах электроны не могут свободно
перемещаться по кристаллу и служить
переносчиками электрического тока.
Заполнение электронами МО, составляющих энергитическую зону, происходит в порядке последовательного возрастании энергии.
Полупроводники – вещества которые при низких температурах проявляют свойства изоляторов, а при выскоих обладают высокой проводимостью электричества.
Электронное строение: энергетическая зона, валентная зона (совокупность уровней занятых валентными электронами), зона проводимости (незаполненные уровни), запрещенная зона
