
- •Закон постоянства состава. Условия его выполнения. Классифицируйте следующие соединения на вещества постоянного и переменного состава:
- •Атомная единица массы. Моль. Молярные масса и объем веществ в различных агрегатных состояниях. Вычислите молярный объем
- •Влияние температуры на химическое равновесие. Причины влияния. Приведите 2 примера реального использования изменения температуры для смещения равновесия
- •Влияние концентрации на химическое равновесие. Причины влияния. Приведите по 2 примера реального использования изменения концентрации реагента или продукта для смещения равновесия
- •Влияние температуры на скорость химической реакции. Причины влияния. Уравнение Аррениуса. Приведите 2 примера реального использования изменения температуры для изменения скорости.
- •Примеры:
- •Электролиты, определение. Жидкие электролиты (2 примера). Механизм электропроводности растворов электролитов.
- •Протолитические равновесия. Константа равновесия. Приведите три примера
- •Условия образования и растворения осадка:
- •Симплексные и комплексные соединения. Координационное число. Константа устойчивости.
- •Примеры овп:
- •Примеры овп в природе:
- •Симметрии ао.
- •36. Заполнение ао электронами. Принцип Паули. Правило Хунда. Энергетические диаграммы элементов
- •Ионизационный потенциал и сродство к электрону атомов (порядок величин, единицы измерения). Закономерности изменения при движении по
- •Химическая связь. Перекрывание ао (s-, p-мо). Характеристики связи: энергия, длина, полярность (определения, единицы измерения).
- •Cвязывающие, несвязывающие и антисвязывающие мо. Кратность связи. (На примере молекул
- •Электронное строение веществ, образованных из атомов. Металлы, неметаллы, полупроводники.
- •Водородная связь (энергия водородной связи в сравнении с другими видами связи). Свойства воды, обусловленные водородными связями.
Закон постоянства состава. Условия его выполнения. Классифицируйте следующие соединения на вещества постоянного и переменного состава:
Закон постоянства состава – соотношения между массами элементов, входящих в состав данного соединения, постоянны и не зависят от способа получения этого соединения
Закон кратных соотношений – Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие числа.
Соотношения между массами элементов, входящих в состав данного вещества постоянно лишь при условии постоянства изотопного состава этих элементов. При изменении изотопного состава элемента меняется и массовый состав соединения.
Вещества постоянного состава – вещества с молеклярной структурой
Соединения переменного состава – соединения в которых на единицу массы данного элемента может приходиться различная масса другого элемента. Соединения переменного состава имеют атомную структуру.
Молекулярные вещества – Большинство
простых веществ неметаллов
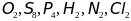 ,
соединения неметаллов друг с другом
(бинарные и многоэлементные):
,
соединения неметаллов друг с другом
(бинарные и многоэлементные):

Немолекулярные вещества – простые
вещества металлы и их сплавы: Na,
Cu, Fe,
соединения металлов с неметаллама: NaH,
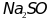 ,
,
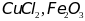 ,
неметаллы: бор, кремний, углерод (алмаз),
фософор (черный и красный), некоторые
бинарные соединения неметаллов SiC,
,
неметаллы: бор, кремний, углерод (алмаз),
фософор (черный и красный), некоторые
бинарные соединения неметаллов SiC,

SO2 – пост., SO3- пост., Cu2O – пер., CuO – пер., NaCl – пер.
FeO – пер., Fe2O3 – пер., H2SO4 – пост., полиизобутилен – пост.
Атомная единица массы. Моль. Молярные масса и объем веществ в различных агрегатных состояниях. Вычислите молярный объем
Атомная единица массы – 1/12 часть
массы атома изотопа углерода

Моль – количество вещества, содержащее
столько молекул, атомов, ионов, электронов
или других структурных единиц, сколько
содержиться атомов в 12г изотопа углерода
.
В одноим моле вещества содержиться
 моль
моль
 структурных единиц (постоянная Авогадро)
структурных единиц (постоянная Авогадро)
Молярная масса вещества – отношение
массы m вещества к его
количеству n
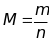 Выражается в г/моль. Молярная масса
вещества пропорциональна массе
соответствующей структурной единицы,
т.е. относительной молекулярной массе
данного вещества (М(отн))
Выражается в г/моль. Молярная масса
вещества пропорциональна массе
соответствующей структурной единицы,
т.е. относительной молекулярной массе
данного вещества (М(отн))
 М(отн)),
так как K=1
М(отн)),
так как K=1
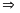 молярная
масса вещества, выраженная в граммах
на моль, имеет то же численное значение,
что и его относительная молекулярная
(атомная) масса.
молярная
масса вещества, выраженная в граммах
на моль, имеет то же численное значение,
что и его относительная молекулярная
(атомная) масса.
Молярная масса газа равна его плотности
по отношению к другому газу, умноженной
на молярную массу второго газа
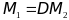
Молярный объем – отношение объема, занимаемого веществом к его количеству.
Согласно закону Авогадро одно и то же
число молекул любого газа занимает при
одинаковых условия один и тот же объем.
С другой стороны, 1 моль любого вещества
содержит одинаковое число частиц. Отсюда
следует, что при определенных температуре
и давлении 1 моль любого вещества в
газообразном состоянии занимает один
и тот же объем. При нормальных условиях
(101,325 кПа и
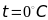 )
этот объем равен 22,4 л.
)
этот объем равен 22,4 л.
Для других агрегатных состояний объем
вычисляется по формуле

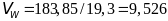 cm3
cm3
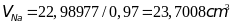
Закон Авогадро. Относительная плотность газа. Какой газ имеет меньший молярный объем? Меньшую плотность? Почему?
Закон Авогадро – В равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержиться одно и то же число молекул
Относительная плотность газа –
отношение массы данного газа к массе
другого газа, взятого в том же объеме,
при той же температуре и том же давлении.

1)
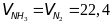 по закону Авогадро; так как
,
то
по закону Авогадро; так как
,
то

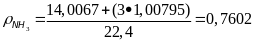 ;
;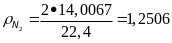

2)
 по закону Авогадро; так как
,
то
по закону Авогадро; так как
,
то
;
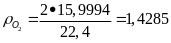

Энтальпия образования вещества. Стандартное состояние вещества. Энтальпия какой из нижеприведенных реакций является энтальпией образования соответствующего вещества? Ответ обоснуйте.
Энтальпия. H=U+PV,
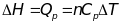 ,
[
,
[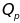 ]-теплота,
поглощенная системой при постоянном
давлении, [
]-теплота,
поглощенная системой при постоянном
давлении, [ ]-количество
вещества, [
]-количество
вещества, [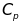 ]-молярная
теплоемкость ещества при постоянном
давлении. Изменение энтальпии равно
взятому с обратным знаком теловому
эффекту реакции, проведенной при
постоянной температуре и постоянном
давлении. Энтальпией образования
вещества называют энтальпию реакции
образования данного вещества из простых
при стандартных условиях. Если элемент
образуется из нескольких простых
веществ, то берется наиболее устойчивое
из них.
]-молярная
теплоемкость ещества при постоянном
давлении. Изменение энтальпии равно
взятому с обратным знаком теловому
эффекту реакции, проведенной при
постоянной температуре и постоянном
давлении. Энтальпией образования
вещества называют энтальпию реакции
образования данного вещества из простых
при стандартных условиях. Если элемент
образуется из нескольких простых
веществ, то берется наиболее устойчивое
из них.
Стандартное состояние – состояние вещества, находящегося в стандартных условиях.
Стандартные условия – одинаковые концентрации веществ (чистое состояние для индивидуальных веществ, концентрация равная 1 моль в 1000 г растворителя, для растворов, парциальное давление, равное нормальному атмосферному лавлению для газов)
Ca + C + 3/2 O2 = 2CaCO3 – Энатльпия образования, так как все вещества взяты в наиболее устойчивом состоянии и являются простыми
Fe + S + 2O2 = FeSO4 - Энатльпия образования, так как все вещества взяты в наиболее устойчивом состоянии и являются простыми
Cu + C + 3/2 O2 = CuCO3 - Энатльпия образования, так как все вещества взяты в наиболее устойчивом состоянии и являются простыми
Энтропия вещества. Зависимость от температуры, массы, объема, агрегатного состояния (причины зависимости), предельные значения, единицы измерения. Молярная энтропия какого вещества больше:
Энтропия – величина пропорциональная
логорифму вероятности осуществления
данного макросостояния
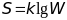 ,
,
 Дж/К
– коэффицент пропорциональности.
Наименьшей энтропией обладает правильно
построенный кристалл при абсолютном
нуле. Энтропия такого кристалла будет
равна 0, так как W=1. Энтропия
зависит только от состояния системы.
Энтропия увеличивается по мере увеличения
температуры. Если процесс проводиться
обратимо и при постоянной температуре,
то изменение энтропии -
Дж/К
– коэффицент пропорциональности.
Наименьшей энтропией обладает правильно
построенный кристалл при абсолютном
нуле. Энтропия такого кристалла будет
равна 0, так как W=1. Энтропия
зависит только от состояния системы.
Энтропия увеличивается по мере увеличения
температуры. Если процесс проводиться
обратимо и при постоянной температуре,
то изменение энтропии -
 .
Энропия системы возрастает тем сильнее,
чем ниже температура при которой
поглощается теплота. Энтропия возрастает
при увеличении числа молекул газов и
уменьшается при их уменьшении. Энтропия
не зависит от массы вещества, но
увеличивается при увеличении его объема.
.
Энропия системы возрастает тем сильнее,
чем ниже температура при которой
поглощается теплота. Энтропия возрастает
при увеличении числа молекул газов и
уменьшается при их уменьшении. Энтропия
не зависит от массы вещества, но
увеличивается при увеличении его объема.
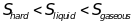 ,
потому что молекулы твердого вещества
более упорядоченны, чем молекулы жидкого
и газа, а расположение молекул в газе в
свою очередь стремиться к бесконечности.
Энтропия имеет размерность энергии
деленной на температуру (Дж/К)
,
потому что молекулы твердого вещества
более упорядоченны, чем молекулы жидкого
и газа, а расположение молекул в газе в
свою очередь стремиться к бесконечности.
Энтропия имеет размерность энергии
деленной на температуру (Дж/К)
Энртопия углекислого газа будет больше
Энтропия воды будет больше
Энтропия химической реакции. Приведите по 3 примера химических и по 1 нехимических процессов, сопровождающихся увеличением и уменьшением энтропии.
Энтропия химической реакции находиться
по следующему правилу:

Процессы, сопровождающиеся увеличением энтропии – называются необратимыми.
Нехимический (увеличение): Расширение газа в пустоту. Убрав перегородку, газ распространится на весь объем. За счет увеличения объема увеличиться число микроскопических состояний реализующих любое из макроскопических состояний гаха, т.е. энтропия возрастет, Обратный процесс, при котором все молекулы соберуться в ½ сосуда, практически невозможен, так как ему соответствует уменьшение энтропии.
Процессы связанные с уменьшением энтропии маловероятны, т.к. вероятность P резко убывает по экспоненте.
Этропия увеличивается при плавлении кристаллов, испарении жидкости, расширении газов, смешении и растворении и химических реакция развложения.
Энтропия уменьшается при кристаллизации, конденсации паров, сжатии газов, химических реакциях синтеза.
Химические (увеличение):
1)
 2)
2)
 3)
3)
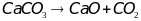
Химические (уменьшение):
1)
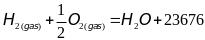 Дж/моль
2)
Дж/моль
2)

3)
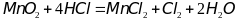
Самопроизвольные и несамопроизвольные процессы в природе (приведите по два примера химических и нехимических само- и несамопроизвольных процессов).
Самопроизвольно могут протекать только те процессы, за счет энергии которых можно совершать полезную работу или если сказать иначе только те процессы, которые приводят к понижению свободной энергии системы; система приходит в состояние равновесия когда свободная энергия достигает минимального значения. Соответственно все остальные процессы являются не самопроизвольными.
Химические самопроизвольные процессы:
Испарение бензола
Кристаллизация из перенасыщенного раствора
Нехимические самопроизвольные процессы:
1) Скатывание тела с наклонной поверхности
2) Смешение газов
Химические несамопроизвольные процессы:
1) Синтез соляной кислоты
2) Востановление алюминия из руды
Нехимические несамопроизвольные процессы:
1) Постройка дома
2) Получение зачета
8. Энергия Гиббса образования вещества. Температурная зависимость. Стандартное состояние вещества. Укажите стандартное состояние вещества
Энергия Гиббса – функция которая отражает вдияние на направление протекания процесса как тенденции к уменьшению внутренней энергии, так и тенденции к достижению наиболее вероятного состояния системы.
Энергей Гиббса образования вещества называют Энергию Гиббса реакции образования данного вещества из простых при стандартных условиях. Если элемент образуется из нескольких простых веществ, то берется наиболее устойчивое из них.
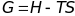 - связь энергии Гиббса с температурой,
энтропией и энтальпией, как можно видеть
из этой реакции энергия Гиббса сильно
зависит от температуры.
- связь энергии Гиббса с температурой,
энтропией и энтальпией, как можно видеть
из этой реакции энергия Гиббса сильно
зависит от температуры.
 -
изменение энергии Гиббса. При низких
температурах множитель T
мал и абсолютное значение произведения
-
изменение энергии Гиббса. При низких
температурах множитель T
мал и абсолютное значение произведения
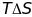 тоже
мало. В этом случае, для реакций с больщим
тепловым эффектом,
тоже
мало. В этом случае, для реакций с больщим
тепловым эффектом,
 ,
тогда
,
тогда
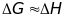 ,
а при высоких температурах
,
а при высоких температурах
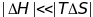 ,
а значит и
,
а значит и
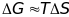
Стандартное состояние – состояние вещества, находящегося в стандартных условиях.
Стандартные условия – одинаковые концентрации веществ (чистое состояние для индивидуальных веществ, концентрация равная 1 моль в 1000 г растворителя, для растворов, парциальное давление, равное нормальному атмосферному лавлению для газов)
Стадартное состояние воды – чистая жидкость, без примисей
Стандартное состояние кислорода – двухатомный газ
Энергия Гиббса химической реакции. Каков смысл ее абсолютной величины и знака (+ или –). Объясните, при каких условиях возможна реакция, если
Энергия Гиббса химической реакции
 Дж/моль.
Зная значение энергии Гиббса мы можем
найти константу равновесия. Отрицательное
значение является необходимым, но не
достаточным условием протекания реакции,
если DrG>0
то реакция не должна протекать, если
равна 0, то система находиться в равновесии.
Дж/моль.
Зная значение энергии Гиббса мы можем
найти константу равновесия. Отрицательное
значение является необходимым, но не
достаточным условием протекания реакции,
если DrG>0
то реакция не должна протекать, если
равна 0, то система находиться в равновесии.
1) При абсолютном значении DrG больше 0, реакция протекать не будет.
2) Когда мы находим
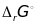 мы находим величину относящуюся к к
веществам взятым в стандартных состояних,
в виде индивидуальных веществ. На самом
деле в реакцию вступаю растворы, то же
относиться и к продуктам реакции. В
растворе активность вещества отличаеться
от стандартного состояния тем больше,
чем меньше его концентрация.
мы находим величину относящуюся к к
веществам взятым в стандартных состояних,
в виде индивидуальных веществ. На самом
деле в реакцию вступаю растворы, то же
относиться и к продуктам реакции. В
растворе активность вещества отличаеться
от стандартного состояния тем больше,
чем меньше его концентрация.
Химическое и физическое равновесие. равновесие. (стабильное, метастабильное, неустойчивое).
Х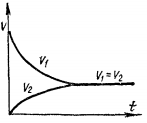 имическое
равновесие– состояние при котором
скорости
имическое
равновесие– состояние при котором
скорости
прямой и обратной реакции одинаковы. Химическое равновесие называют динамическим равновесием (подчеркивая тем самым,
что при равновесии прямая и обратная
реакция протекает, но вслидствии
равенства между собой в системе не
заметна)
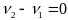 ,
,
 - скорость прямой,
- скорость прямой,
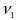 -
скорость обратной
-
скорость обратной
реакции. Количественной мерой химичсского
равновесия является константа
химического равновесия.
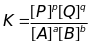 (большие буквы – вещества, маленькие –
коэфиценты в уравнении реакции)
Кинетическим критерием служит нулевая
энергия Гиббса.
(большие буквы – вещества, маленькие –
коэфиценты в уравнении реакции)
Кинетическим критерием служит нулевая
энергия Гиббса.
Физическое равновесие – равновесие для достижения которого необходимы процессы изменения лишь межмолекулярных взаимодействий в системе. Условием равновесие является равенство свободной энергии Гиббса в разных фазах.
Метастабильные равновесия – состояния системы соответствующие локальным максимумам энтропии и минимумам термодинамических потенциалов.
Стабильное равновесие – состояние системы с основным максимумом энтропии и минимумами термодидамических потенциалов.
Неустойчивое равновесие – состояние системы, при котором любое отклонение от состояние равновесия окажеться критическим, и система не сможет вернуться обратно в состояние покоя.
11. Необходимые условия (возможность) достижения равновесия (скорость реакции, количество вещества, изолированность системы).
Для того что бы система достигла равновесия скорости прямой и обратной реакции должны сравняться. Что бы это произошло, система должна быть изолированной, протекающая реакция должна быть обратима. Свободная энергия должна быть минимальна.
Находится ли в равновесии (физическом, химическом) при комнатной температуре система
1)
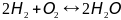 Химическое равновесие достигнуто, но
физического равновесия нет
Химическое равновесие достигнуто, но
физического равновесия нет
2)
 Химическое равновесие достигнуто,
физического равновесия нету
Химическое равновесие достигнуто,
физического равновесия нету
Константа равновесия химической реакции (на конкретном примере реакции). Концентрации каких участников реакции и почему отсутствует в выражении з. д. м.?
Константа равновесия химической реакции – количественная характеистика химического равновесия.
Пример расчета: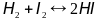
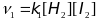 ,
,
 согласно закону действия масс.
согласно закону действия масс.
При равновесии
 или
или
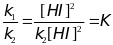 -
константа равновесия химической реакции.
В случаях гетерогенных реакций в
выражение константы равновесия, так же
как и в в выражение закона действия масс
входят концентрации только тех веществ,
которые находяться в газовой или жидкой
фазе. Это происходит потому, что активности
таких веществ равны 1.
-
константа равновесия химической реакции.
В случаях гетерогенных реакций в
выражение константы равновесия, так же
как и в в выражение закона действия масс
входят концентрации только тех веществ,
которые находяться в газовой или жидкой
фазе. Это происходит потому, что активности
таких веществ равны 1.
Принцип Ле-Шателье в применении к химическим системам (по 1 примеру гомогенных и гетерогенных равновесий и влияние на них различных факторов). К каким системам неприменим принцип Ле-Шателье?
Принцип Ле-Шателье в применении к химическим системам – если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится. Принципе Ле-Шателье неприменим к системам не находящимся в состоянии истинного равновесия.
Гомогенная система:

Гетерогенная система:

Нарушение равновесия в следствие изменении концентрации какого-либо из веществ – согласно закону действия масс, увеличение концентрации водорода повлечет за собой увеличение скорости прямой реакции-реакции синтеза, тогда как скорость обратной реакции не измениться. В прямом направлении реакция будет протекать быстрее, чем в обратном. В результате этого концентрации и азота и водорода будут уменьшаться, что повлечет за собою замедление прямой реакции, а концентрация амиака будет возрастать, что вызовет ускорение обратной реакции. Через некоторое время скорости прямой и обратной реакции снова сравняются – установиться равновесие. Таким образом: при увеличении концентрации какого-либо из веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества, при уменьшении концентрации какого-либо вещества равновесие смещается в сторону образования этого вещества.
Нарушение равновесия в следствие изменения давления (путем увеличения или уменьшения объема системы): При увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газов, т.е. в сторону понижения давления; при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул газов, т.е. в сторону увеличения давления. Если же изменения числа молекул газов не происходит, то и равновесия не изменяется.
Нарушение равновесия вследствие изменения температуры: фактором, который определяет направление смещения равновесия является знак теплового эффекта реакции. Для синтеза амиака тепловой эффект состовляет +92,4 кДж, значит реакция экзотермическая, а значит при повышении температуры равновесие в этой системе сдвинется в сторону разложения аммиака, так как этот процесс идет с поглощением теплоты. То есть можно сказать, что при повышении температуры равновесие смещается в направлении эндотермической, а при понижении – в направлении экзотермической реакции.
