
Федеральное агенство по образованию
Тверской государственный технический университет
Кафедра химии и биотехнологии
Лабораторная работа № 33
Тверь, 2006 г.
Лабораторная работа 33
Определение стандартного окислительно-восстановительного потенциала ферри- ферро- электрода с учетом коэффициентов активности и расчет равновесия электродной реакции.
Цель работы: выполнить экспериментальную работу по определению стандартного окислительно-восстановительного потенциала ферро-феррицианидного электрода с учетом коэффициентов активности ионов и рассчитать константу равновесия электродной реакции.
Приборы и реактивы:
1) 0,01М раствор K4[Fe(CN)6]
2) 0,01М раствор K3[Fe(CN)6]
3) две пипетки с делениями до 25 мл.
4) стакан для измерения
5) электроды (хлорсеребряный и платиновый)
6) иономер
Теоретическая часть
Электрохимия- раздел физической химии, в котором изучаются физико-химические свойства ионных систем, а также процессы и явления на границах раздела фаз с участием заряженных частиц (электронов и ионов). Электрохимия включает две части: ионику (теорию электролитов) и электродику (электрохимическую термодинамику и кинетику). В ионике и электродике исследуются как равновесные, так и неравновесные процессы. В равновесной ионике изучаются свойства ионных систем в равновесии и строение растворов, расплавов и твердых электролитов. В неравновесной ионике исследуются вопросы, связанные с электропроводностью электролитов. В равновесной электродике изучаются условия равновесия на границе электрод-раствор(расплав); этот раздел электродики называют электрохимической термодинамикой или термодинамикой гальванического элемента.
Объектом изучения неравновесной электродики являются: измерения скоростей процессов на границе раздела электрод-раствор (расплав) и вскрытие закономерностей, которым они подчиняются. Данный раздел электродики называется кинетикой электродных процессов или электрохимической кинетикой.
Ионные системы- электролиты (растворы, расплавы, твердые вещества)- это системы, в которых перенос электрических зарядов осуществляется ионами. Они называются проводниками 2-го рода, в отличие от проводников 1-го рода, в которых прохождение электрического тока обусловлено потоком электронов.
Растворы электролитов являются неидеальными растворами. Для описания отклонения их свойств от идеальных растворов и наличия в таких системах отдельных ионов вводятся понятия активности раствора как целого, а также понятия об активностях отдельных ионов, средних активностях электролита и соответствующих коэффициентах активности.
В теории электролитов широко используется понятие ионной силы:
![]()
где
![]() -
ионная сила,
-
ионная сила,
![]() -
концентрация ионов,
-
концентрация ионов,
![]() -
их заряд.
-
их заряд.
Между коэффициентами активности ионов и ионной силой раствора имеется количественная связь, которая была установлена экспериментально, а затем выведена теоретически Дебаем и Гюккелем.
В электрохимии проведение химических реакций используется для получения электрической энергии; в свою очередь подведенная извне электрическая энергия применяется для осуществления химических реакций. Упомянутые реакции называются электрохимическими, и по своей природе они являются окислительно-восстановительными реакциями. В чем же отличие обычных окислительно-восстановительных реакций от электрохимических?
При проведении, например, окислительно-восстановительной реакции между металлическим цинком и ионами двухвалентной меди в растворе:
![]()
на границе раздела
фаз цинк — раствор происходит столкновение
ионов
![]() ,
с атомами цинка в поверхностном слое
его кристаллической решетки и происходит
переход электронов от восстановителя-
цинка к окислителю — ионам
.
Этот электронный переход осуществляется
на достаточно малом расстоянии между
ними. Кроме того, сами столкновения и
электронные переходы происходят хаотично
и химическая энергия процесса выделяется
в виде теплоты.
,
с атомами цинка в поверхностном слое
его кристаллической решетки и происходит
переход электронов от восстановителя-
цинка к окислителю — ионам
.
Этот электронный переход осуществляется
на достаточно малом расстоянии между
ними. Кроме того, сами столкновения и
электронные переходы происходят хаотично
и химическая энергия процесса выделяется
в виде теплоты.
Ту же самую окислительно-восстановительную реакцию можно провести иначе, а именно -электрохимическим путем. Для этого окислитель и восстановитель должны быть пространственно разделены, а передача электронов должна осуществляться при помощи проводников 1-го рода. В качестве восстановителя используется металлический цинк, в качестве второго проводника 1-го рода— металлическая медь. Оба этих проводника 1-го рода, называемых электродами, погружаются соответственно в растворы электролитов содержащих ионы но отношению к которым обратимы электроды.
Такие ионы называются
потенциалопределяющими . Для того чтобы
не происходило смешивания электролитов,
они разделяются диафрагмой, через
которую возможен переход ионов, или же
электролитическая связь между ними
обеспечивается так называемым соляным
мостиком. При соединении электродов
проводниками первого рода на какой-либо
потребитель электрической энергии,
через него потечет электрический ток.
При этом на одном из электродов на
границе с электролитом будет происходить
реакция окисления, на другом —
восстановления, т.е. оба процесса будут
пространственно разделены, передача
электронов от восстановителя к окислителю
будет происходить не хаотично, а
направленно по внешней цепи и химическая
энергия реакции будет непосредственно
превращаться в электрическую. В
рассматриваемой нами электрохимической
системе на цинковом электроде идет
окисление цинка с переходом цинк-ионов
в раствор:![]()
![]()
а на медном электроде - реакция восстановления ионов меди с выделением элементарной меди на электроде
![]()
Т.о., суммарно на обоих электродах протекает та же реакция окисления-восстановления, что и при непосредственном контакте цинка с ионами меди в растворе:
![]()
но в рассмотренной системе эта реакция будет уже электрохимической, а описанная конструкция называется гальваническим элементом.
Определение: «Гальваническим элементом называется система, производящая энергию за счёт протекающих в ней химических реакций". "Электрохимическая система, в которой за счет внешней электрической энергии совершаются химические превращения, называется электролитической ванной или электролизером".
Электрод, принимающий электроны от участников реакций называется анодом, отдающий электроны - катодом. Электролит, примыкающий к аноду, называется анолитом, к катоду-канолитом.
Каждый гальванический элемент характеризуется переменным значением электродвижущей силы (ЭДС), которая представляет собой разность потенциалов на электродах равновесно работающего элемента (на концах равновесной электрохимической цепи).
Уравнение для ЭДС гальванического элемента может быть выведено из уравнения изотермы химической реакции равновесно протекающей в элементе.
Если в последнем протекает следующая реакция:
![]()
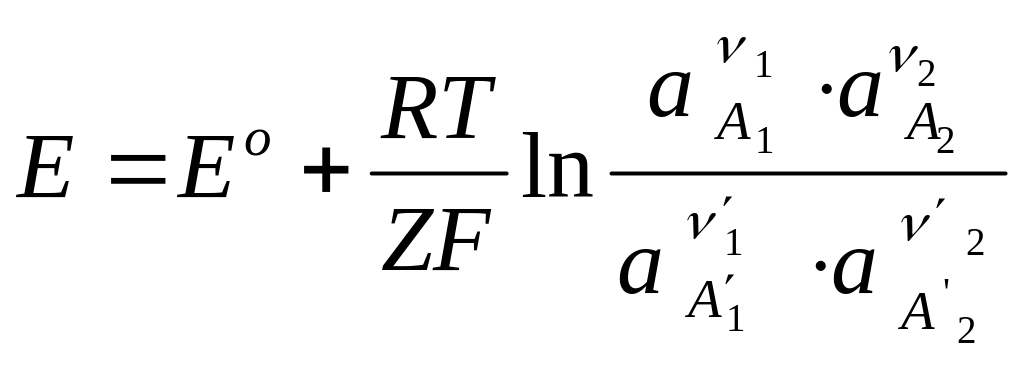
Е-ЭДС элемента, в; Е - стандартное значение ЭДС, в; R- универсальная газовая постоянная дж/моль;
![]() -
число электронов, участвующих в
окислительно-восстановительной реакции;
-
число электронов, участвующих в
окислительно-восстановительной реакции;
F-
число Фарадея, к/моль;
![]() -
активности веществ- участников реакции;
-
активности веществ- участников реакции;
![]() -стехиометрические
коэффициенты в уравнении реакции.
Записанная формула называется уравнением
Нернста. В связи с неопределенностью
записи уравнения реакции, заключающейся
в том, что нельзя однозначно установить
какие из веществ считать исходными, а
также продуктами, знак ЭДС также
оказывается неопределенным.
-стехиометрические
коэффициенты в уравнении реакции.
Записанная формула называется уравнением
Нернста. В связи с неопределенностью
записи уравнения реакции, заключающейся
в том, что нельзя однозначно установить
какие из веществ считать исходными, а
также продуктами, знак ЭДС также
оказывается неопределенным.
Поскольку на каждом из электродов протекает частная реакция окисления либо восстановления, которую можно записать в виде:
![]()
применяя те же принципы термодинамики, которые использовались при выводе уравнения для ЭДС гальванического элемента, может быть выведено следующее уравнение для электродного потенциала:
 где
где
![]() -электродный
потенциал,
-электродный
потенциал,
![]() - стандартный электродный потенциал,
остальные символы те же, что и в уравнении
для ЭДС. Эта формула называется уравнением
Нернста-Тюрина. При записи уравнения
частной электродной реакции допускается
та неопределенность, что и при написании
реакции в элементе. Кроме того, абсолютное
значение электродного потенциала
неизвестно.
- стандартный электродный потенциал,
остальные символы те же, что и в уравнении
для ЭДС. Эта формула называется уравнением
Нернста-Тюрина. При записи уравнения
частной электродной реакции допускается
та неопределенность, что и при написании
реакции в элементе. Кроме того, абсолютное
значение электродного потенциала
неизвестно.
Для устранения неопределенности в числовых значениях электродных потенциалов была введена так называемая водородная шкала.
Измерения ЭДС гальванических элементов и величин электродных потенциалов (относительно стандартного водородного электрода, для которого величина электродного потенциала условно принята равной нулю при любой температуре) производится компенсационным методом с использованием потенциометров различных марок или же для этой цели применяются современные электронные приборы- « ионометры», «рН-метры»,милливольтметры и т.п.
Классификация электродов
Согласно международной конвенции об ЭДС и электродных потенциалов реакция, приводящая к возникновению электродного потенциала, записывается так, чтобы в левой части уравнения находилась окислённая, а в правой восстановлённая форма вещества:
![]()
где S- число электронов, участвующих в электронной реакции.
Классификация электродов основывается на природе реакции, протекающей на нём. Различают следующие электроды:
Электроды первого рода – системы, в которой окисленной формой являются ионы металла, а восстановленной – металл электрода. Схема электродов (полуэлемента) записывается так, чтобы ионы электролита были слева, а материал электрода - справа от разделительной черты:
M![]() /
M
/
M
Электродная реакция:
![]()
Как правило, электроды первого рода обратимы относительно катиона. Однако, встречаются электроды первого рода, обратимые относительно аниона. В этом случае окисленной формой является металлоид, а восстановленной ионы металлоида (анионы).
Схема электрода:
![]()
Электродная реакция:
![]()
Пример:
![]()
Амальгамные электроды относятся к электродам первого рода и представляют собой полуэлементы, в которых амальгама какого-либо металла находится в контакте с электролитом, содержащим ионы этого металла.
Схема электрода:
![]()
Электродная реакция:
![]()
Ртуть ведет себя как инертная среда, в которой растворен металл М, а потенциал-опредиляющими ионами являются ионы этого металла.
Для электродов первого рода (в том числе и амальгамных) можно записать общую формулу для электродного потенциала по уравнению Нернста-Тюрина:
![]()
Так, например, для металлических электродов:
![]()
где
![]() -активность
потенциалопредиляющих ионов,
-активность
потенциалопредиляющих ионов,
![]() -их заряд,
-их заряд,
![]() -активность
металла. Для чистых металлов
-активность
металла. Для чистых металлов
![]() и член
и член
![]() вводится в стандартный потенциал.
вводится в стандартный потенциал.
Для амальгамного электрода:
![]()
Т.е. зависит не только от активности ионов металла, но и от его активности в амальгаме. Если металл находится в ртути в атомарном состоянии(m=1), то:
![]()
Электроды второго рода - это системы, в которых металл покрыт слоем его трудно растворимой соли (или оксида), а электролит содержит анионы этой соли(для оксида- ионы ОН-).
Схема электрода:
![]()
Электродная реакция:
![]()
Уравнение электродного потенциала:
![]()
так как
и
![]() ,то
,то
![]() включается в стандартный потенциал.
включается в стандартный потенциал.
Пример: хлорсеребряный электрод
Схема:
![]()
Электродная реакция:
![]()
Уравнение
электродного потенциала:
![]()
Окислительно-восстановительные
электроды или редокс-электроды (системы)
представляют собой инертный металл(![]() и др.), погруженные в электролит, содержащий
одновременно окисленную и восстановленную
формы того или иного вещества. При этом
металл электрода не участвует в
окислительно-восстановительной реакции
(электродной реакции), а лишь является
передатчиком электронов между окислителем
и восстановителем. Название такого
электрода не очень удачно, так как на
любом обратимом электроде протекает
окислительно-восстановительная реакция,
однако упомянутое название широко
распространено.
и др.), погруженные в электролит, содержащий
одновременно окисленную и восстановленную
формы того или иного вещества. При этом
металл электрода не участвует в
окислительно-восстановительной реакции
(электродной реакции), а лишь является
передатчиком электронов между окислителем
и восстановителем. Название такого
электрода не очень удачно, так как на
любом обратимом электроде протекает
окислительно-восстановительная реакция,
однако упомянутое название широко
распространено.
Различают простые и сложные редокс-электроды. В простых электродах реакция протекает так, что ионы-окислители и ионы-восстановители изменяют валентность без изменения состава.
Например:
![]() ;
;![]() и
т.д.
и
т.д.
В общем случае электродную реакцию можно записать в виде:
![]()
Схема электрода:
![]()
Уравнение
электродного потенциала:
![]()
Стандартные
потенциалы простых редокс-электродов
можно связать со стандартными потенциалами
электродов первого рода. Эта связь
устанавливается по правилу Лютера.
Поясним это на следующем примере.
Восстановление
![]() до
металлической меди можно провести
сразу:
до
металлической меди можно провести
сразу:
![]()
т.к.
![]()
![]() откуда
откуда
![]()
Тот же процесс можно осуществить в две стадии:
![]()
![]()
![]()
В равновесных
условиях:
![]()
Поэтому:
![]() ,
откуда по любым двум неизвестным
,
откуда по любым двум неизвестным
![]() легко
рассчитывается третий стандартный
потенциал.
легко
рассчитывается третий стандартный
потенциал.
Так, например,
потенциал электрода первого рода
![]() ,
измерить который непосредственно нельзя
из-за неустойчивости ионов
,
измерить который непосредственно нельзя
из-за неустойчивости ионов
![]() ,
можно рассчитать по значениям
,
можно рассчитать по значениям
![]() и
и
![]() ,
которые определяются из эксперимента:
,
которые определяются из эксперимента:
![]() 2/3
2/3![]()
В сложных редокс-электродах реакция протекает с изменением валентности и состава окислителей и восстановителей. В таких реакциях участвуют ионы водорода и молекулы воды. Активность последней в разбавленных растворах остается практически неизменной, в концентрированных растворах она может существенно изменяться.
Схема сложного редокс-электрода записывается так:
![]()
Пример: система перманганат-ионы – двухвалентные ионы марганца
![]()
Электродная реакция:
![]()
Уравнение электродного потенциала:
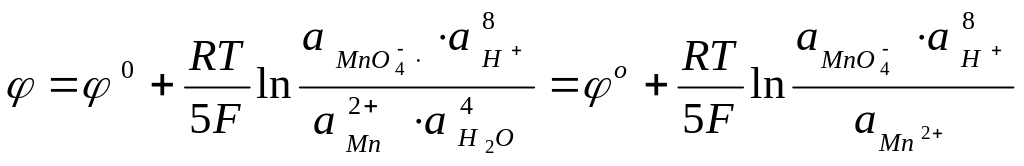
Так как
![]() (разбавленный раствор), то член
(разбавленный раствор), то член
![]() включается в
стандартный потенциал. Другой пример-
хингидронный электрод. Это система,
состоящая из хинона (Х)-окислитель и
гидрохинона(гх)- восстановитель в водном
растворе, в который погружена платина-
инертный проводник первого рода. Для
приготовления такого электрода берется
эквимолекулярная смесь хинона и
гидрохинона- хингидрон, при растворении
которого в водной среде отношение
концентраций:
включается в
стандартный потенциал. Другой пример-
хингидронный электрод. Это система,
состоящая из хинона (Х)-окислитель и
гидрохинона(гх)- восстановитель в водном
растворе, в который погружена платина-
инертный проводник первого рода. Для
приготовления такого электрода берется
эквимолекулярная смесь хинона и
гидрохинона- хингидрон, при растворении
которого в водной среде отношение
концентраций:
![]()
На электроде протекает следующая реакция:
![]()
хинон гидрохинон
Уравнение для потенциала электрода записывается так:
![]()
Т.к.
![]() Легко можно заметить, что измерив в
эксперименте
Легко можно заметить, что измерив в
эксперименте
![]() и зная
и зная![]() можно
рассчитать
можно
рассчитать
![]() ,
а стало быть и
,
а стало быть и![]() ,
поэтому
,
поэтому
![]() ,откуда
,откуда
![]()
Хингидронный
электрод используется для определения
![]() водных растворов только в кислых
нейтральных средах, так как в щелочной
среде гидрохинон как кислота реагирует
с основанием, а окислительно-восстановительная
система х-гх разрушается.
водных растворов только в кислых
нейтральных средах, так как в щелочной
среде гидрохинон как кислота реагирует
с основанием, а окислительно-восстановительная
система х-гх разрушается.
Газовые электроды - разновидность окислительно-восстановительных электродов; их можно отнести и к электродам первого рода.
Однако из-за большой
значимости они выделены в особую группу.
Газовый электрод состоит из инертного
металла (чаще всего платинированной
платины, пластины или проволоки), к
которому подводится электрохимически
активный газ(![]() ,
и погруженный в раствор, содержащий
ионы, обменивающиеся с газом электронами.
Механизм процесса, происходящего на
таком электроде, достаточно сложен.
Суть его состоит в следующем: если,
например, пропускается ток молекулярного
водорода, то молекулы последнего сначала
адсорбируются на платине, где они
диссоциируют на атомы и последние,
отдавая электроны металлу, превращаются
в положительно заряженные ионы, которые
переходят в раствор. Через некоторое
время в системе устанавливается
равновесие, которое можно записать так:
,
и погруженный в раствор, содержащий
ионы, обменивающиеся с газом электронами.
Механизм процесса, происходящего на
таком электроде, достаточно сложен.
Суть его состоит в следующем: если,
например, пропускается ток молекулярного
водорода, то молекулы последнего сначала
адсорбируются на платине, где они
диссоциируют на атомы и последние,
отдавая электроны металлу, превращаются
в положительно заряженные ионы, которые
переходят в раствор. Через некоторое
время в системе устанавливается
равновесие, которое можно записать так:
![]()
Таким образом, платина выполняет роль катализатора и передатчика электронов от адсорбированного водорода на ионы в раствор и обратно. Поскольку достигнуто равновесие, то его можно записать с термодинамических позиций, опуская промежуточные стадии, в таком виде:
![]() или
или
![]()
Схема электрода:
![]()
Напомним, что электродная реакция записывается так, что слева указывается окисленная форма вещества, а справа-восстановленная. Поэтому электродная реакция на водородном электроде имеет следующий вид:
![]()
Тогда уравнение для электродного потенциала по формуле Нернста-Тюрина запишется:

И так как для водородного электрода принят равным нулю и активность газов равняется их фугитивности, то
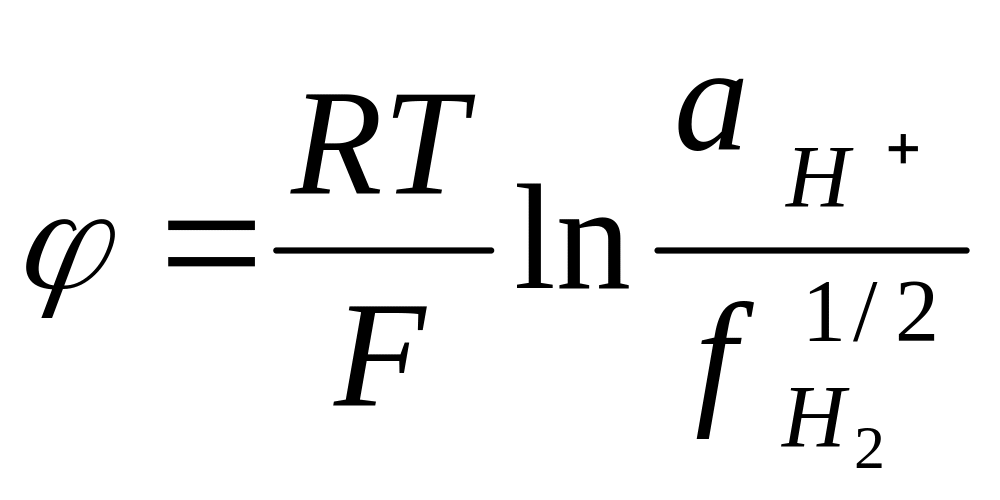
При
низких давлениях
![]() ,
поэтому:
,
поэтому:
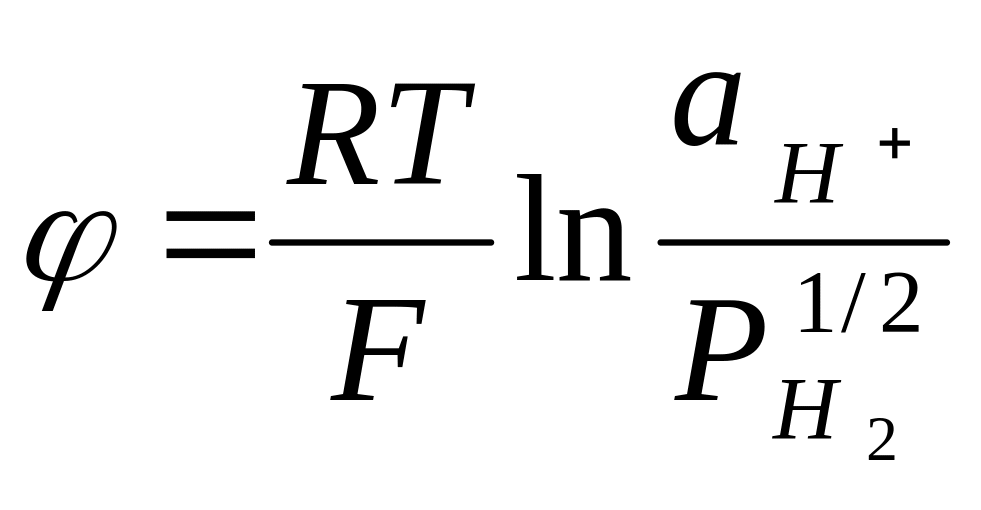
Поскольку
![]() ,
то преобразуя уравнение к виду:
,
то преобразуя уравнение к виду:
![]()
и, измерив в опыте величину электродного потенциала, можно легко рассчитать при заданном давлении водородного газа. Поэтому водородный электрод используется для измерения растворов.
Другой пример газового электрода-кислородный, который отличается от водородного лишь тем, что в качестве электрохимически активного вещества используется кислород. Схема электрода:
![]()
Электродная реакция в нем :
![]()
Уравнение электродного потенциала:

так как
![]() и
и
![]() ,
то
,
то
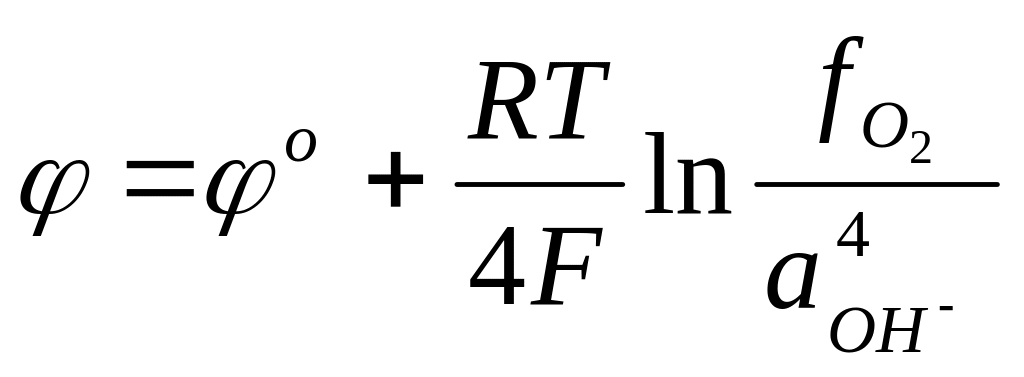
При низких давлениях
![]() ,
поэтому
,
поэтому

Аналогично
конструируется хлорный электрод![]() для которого электродная реакция:
для которого электродная реакция:
![]()
и уравнение для потенциала при низких давлениях:

Водородный и кислородный электроды используются в топливных элементах, которые широко применяются в настоящее время в космической технике в качестве автономных источников электроэнергии.
Ионселективные
(ионообменные) электроды - это
электроды чувствительные к определенному
иону. Они конструируются на основе
полупроницаемых мембран, на границе
раздела которых с раствором происходит
обмен между ионами-катионами или
анионами. В качестве таких ионообменных
мембран используются, в частности,
стеклянные мембраны различного состава.
На границе раздела стеклянная
мембрана-раствор, содержащий соответствующие
ионы, например,
![]() ,
возникает ионообменное равновесие:
,
возникает ионообменное равновесие:
![]()
Уравнение электродного потенциала, отвечающее этой реакции, для кислых и щелочных сред с PH=10-12 записывается так:
![]()
В связи с этим, стеклянный электрод широко применяется в лабораторной и производственной практике для измерения . Более подробно с теорией, конструкцией и использованием стеклянного электрода студенты знакомятся при подготовке и выполнении тех работ, в которых используется стеклянный электрод.
Экспериментальная часть
Сущность работы
заключается в конструировании
гальванического элемента, составленного
из редокс-электрода и стандартного
электрода сравнения. В качестве окислителя
и восстановителя в первом электроде
используется ферри- и ферроцианидные
ионы (раствор,содержащий соли![]() и
и![]() )
второй электрод - хлорсеребряный (с
известным значением потенциала). Путем
изменения концентраций окислителя и
восстановителя в редокс-электроде и
измерения ЭДС составленного элемента
можно рассчитать стандартное значение
редокс-электрода и константу равновесия
электродной реакции.
)
второй электрод - хлорсеребряный (с
известным значением потенциала). Путем
изменения концентраций окислителя и
восстановителя в редокс-электроде и
измерения ЭДС составленного элемента
можно рассчитать стандартное значение
редокс-электрода и константу равновесия
электродной реакции.
Ход работы
Из 0.01 М растворов
ферри- и ферроцианидов калия в растворе
0,005 М
![]() приготавливаются смеси с различным
соотношением окисленной и восстановленной
форм ионов. Для этого пипетками с
делениями до 25 мл(2 пипетки, каждая для
ферри или ферроцианида) берутся объемы
растворов окислителя и восстановителя
в следующем соотношении объёмов:
приготавливаются смеси с различным
соотношением окисленной и восстановленной
форм ионов. Для этого пипетками с
делениями до 25 мл(2 пипетки, каждая для
ферри или ферроцианида) берутся объемы
растворов окислителя и восстановителя
в следующем соотношении объёмов:
