- •Рабочая тетрадь
- •Инструкция по работе с тетрадью
- •Техника безопасности в лаборатории технического анализа и контроля производства, контроля загрязнения атмосферы и воды и приборов экологического контроля Общие правила
- •Лабораторная работа № Определение общей жесткости воды
- •Определение общей жесткости комплексонометрическим методом.
- •Лабораторная работа № Определение карбонатной жесткости воды
- •Лабораторная работа № Определение содержания кислорода, растворенного в воде по Винклеру
- •Лабораторная работа № Определение окисляемости воды
- •Лабораторная работа № Определение железа в воде фотометрическим методом
- •Значения нормативов оперативного контроля случайной составляющей погрешности (сходимости и воспроизводимости).
- •Значения характеристики погрешности и ее составляющих.
- •Лабораторная работа № Определение сульфатов в воде
- •Лабораторная работа № Определение нитратов в воде
- •Лабораторная работа № Определение органолептических показателей качества воды
- •Определение запаха.
- •Оценка интенсивности запаха
- •Определение прозрачности.
- •Определение цветности.
- •Приготовление шкалы цветности
- •Определение температуры воды.
Лабораторная работа № Определение железа в воде фотометрическим методом
Цель работы.
Изучить методику определения железа с сульфосалициловой кислотой фотометрическим методом.
Пояснения к работе.
В подземных водах железо находится в форме гидрокарбоната железа (II). При попадании в открытые водоемы гидрокарбонат теряет СО2 , а карбонат гидролизуется с образованием гидроксида железа (II), который реагируя с кислородом, растворенным в воде, образует гидроксид железа (III) и затем оксид железа (III):
Fe(HCO3)2 → FeCO3↓ + H2O + CO2↑;
FeCO3 + H2O → Fe(OH)2↓ + CO2↑;
4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3 → 2Fe2O3*3H2O.
Таким образом в воде могут находиться соединения железа (II) и железа (III).
Большие количества растворенного в воде железа не оказывают вредного влияния на здоровье людей, но такая вода не пригодна для хозяйственно-бытовых целей. Повышенное содержание железа вызывает окрашивание, помутнение, придает воде запах сероводорода, неприятный чернильный привкус, а в сочетании с гуминовыми соединениями – болотный привкус. Колонии железобактерий могут закупорить просвет трубопроводов. Вода с повышенным содержанием железа непригодна для использования в ряде отраслей промышленности.
ГОСТ 2874-82 устанавливает для воды водопроводов ПДК железа, равную 0,3 мг/дм3. Для воды местных источников водоснабжения допускается содержание железа 0,5-0,6 мг/дм3. Для водопроводов, подающих воду без специальной обработки по согласованию с СЭС, допускается содержание железа до 1 мг/дм3.
Принцип метода.
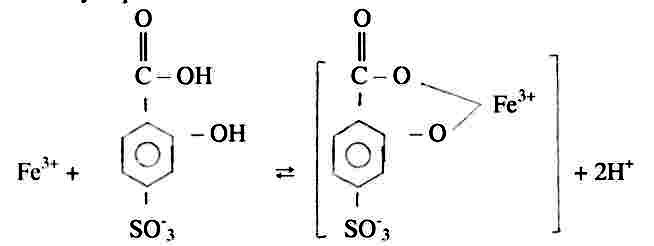
Фотометрический метод определения массовой концентрации общего железа основан на образовании сульфосалициловой кислотой или ее натриевой солью с солями железа окрашенных комплексных соединений, причем в слабокислой среде сульфосалициловая кислота реагирует только с солями железа (3-) (красное окрашивание), а в слабощелочной среде – с солями железа (2+) и (3+) (желтое окрашивание).
Оптическую плотность окрашенного комплекса для железа общего измеряют при длине волны λ = 425 нм, для железа (3+) при длине волны λ = 500 нм.
При рН<3 образуется комплексное соединение фиолетового цвета, имеющего состав 1:1, моносульфосалицилат железа.
|
При увеличении рН до 4…9 образуется красное комплексное соединение, имеющее состав 1:2. При рН = 4 сульфосалициловая кислота находится в растворе в виде анионов HSal -. Поэтому происходит реакция:
|
В этом соединении железо имеет координационное число 4.
При рН>9-11,5 образуется желтый комплекс состава 1:3, трисульфосалицилата железа.
|
При рН>12 происходит разложение комплекса с выделением в осадок гидроксида железа.
pH = 2-4 (3+)
Fe3+ + H2Sal2- → [FeSal]+ + 2H+
pH>4 (Fe2+)
[FeSal]+ + H2Sal2- → [FeSal2]- + 2H+
pH = 8-10 (Fe2+ + Fe3+)
[FeSal2]- + H2Sal2- → [FeSal3]3- + 2H+
|
Задание.
Изучить методику определения содержания железа в воде фотоколориметрическим методом.
Отобрать пробу воды.
Выполнить определение содержания железа фотоколориметрическим методом.
Оформить содержание отчета.
Ответить на контрольные вопросы.
Оборудования и реактивы:
Оборудование.
Подготовку спектрофотомера или фотоэлектроколориметра к работе проводят в соответствии с рабочей инструкцией по эксплуатации прибора.
Реактивы.
Приготовление 20 % раствора сульфосалициловой кислоты. Навеску сульфосалициловой кислоты (20,0 г) помещают в колбу, растворяют в 80 см3 дистиллированной воды.
Приготовление раствора аммиака (1:1). Смешивают равные части аммиака концентрированного и воды дистиллированной.
Приготовление раствора хлорида аммония. Навеску хлорида аммония (107 г) помещают в мерную колбу вместимостью 1000 см3, растворяют в дистиллированной воде и доводят до метки дистиллированной водой. Срок хранения – 1 неделя.
Приготовление основного раствора из СО с аттестованным содержанием. Раствор готовят в соответствии с прилагаемой к образцу инструкцией. 1дм3 раствора должен содержать 100 мг железа. Срок хранения – 1 месяц.
Приготовление рабочего раствора. Его готовят в день проведения анализа разбавлением основного раствора в 10 раз дистиллированной водой. В 1 дм3 раствора содержится 10 мг железа.
Расчет концентрации Fe3+ в градуировочных растворах:
Концентрация Fe3+ в основном растворе:
Fe(NH4)*(SO4)2*12H2O - Fe3+
С Fe(NH4)*(SO4)2*12H2O = г/ дм3 - С Fe3+5 г/ дм3
M Fe(NH4)*(SO4)2*12H2O = г - M Fe3+= г
С Fe3+ (г/ дм3) осн.р. =
С Fe3+ (мг/ дм3) осн.р.=
Концентрация Fe3+ в рабочем растворе:
![]()
Концентрация Fe3+ в градуировочных растворах:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Работа в лаборатории.
Построение градуировочного графика.
Для его построения необходимо приготовить образцы для градуировки с массовой концентрацией железа от 0,1 до 10,0 мг/дм3. Условия анализа, его проведение должны соответствовать условиям выполнения измерений и выполнению измерений.
Состав и количество образцов для построения градуировочных графиков приведены в таблице 3. Погрешность обусловленная процедурой приготовления образцов для градуировки, не превышает 2,5%.
Таблица 3. Состав и количество образцов для градуировки при анализе железа.
№ п/п |
Массовая концентрация железа в градуировочных растворах, мг/дм3 |
Аликвотная часть растворов (см3), помещенных в мерную колбу на 100 см3 |
|
Рабочий раствор с концентрацией 10 мг/дм3 График 1 (кювета 50 мм) |
Основной раствор с концентрацией 100 мг/дм3 График 2 (кювета 10 мм) |
||
1 |
|
0,00 |
|
2 |
|
1,00 |
|
3 |
|
2,50 |
|
4 |
|
5,00 |
|
5 |
|
7,50 |
|
6 |
|
10,00 |
-1,00 |
7 |
|
|
2,50 |
8 |
|
|
5,00 |
9 |
|
|
7,50 |
10 |
|
|
10,00 |
Анализ образцов для градуировки проводят в порядке возрастания их концентрации. Для построения градуировочного графика каждую искусственную смесь необходимо фотометрировать 3 раза с целью исключения случайных результатов и усреднения оптической плотности, а по оси абсцисс – величину концентрации вещества в мг/дм3.
Выполнение определений.
Определение железа общего(2-,3-).
Если в обработке пробы озолением нет необходимости, то к отобранному объему (100 см3 и менее) добавляют 0,5 см3 азотной кислоты концентрированной. И упаривают раствор до 1/3 объема.
Полученный раствор, с концентрацией от 0,1 до 10,0 мг/дм3, помещают в мерную колбу на 100 см3, нейтрализуют раствором аммиака до рН = 7-8 по индикаторной бумаге, приливают 2,0 см3 аммония хлористого, 2,0 см3 сульфосалициловой кислоты. Доводят до метки дистиллированной водой. Тщательно перемешивают и оставляют на 5 минут до полного развития окраски (рН>8, желтая).
Оптическую плотность полученного раствора измеряют при длине волны λ = 425 нм, в кювете с длиной поглощающего слоя 50 или 10 мм по холостому раствору, проведенного таким же способом с дистиллированной водой. По калибровочному графику находят содержание железа общего.
Определение железа(3-).
Определение можно проводить только в тех случаях, когда пробу не обрабатывали с целью разрушения органических компонентов, и не кипятили, т.к. при этом (2+) окисляется до железа (3+).
Пробу объемом 80,0 см3 и менее, в зависимости от концентрации, помещают в мерную колбу вместимостью 100 см3, нейтрализуют раствором аммиака или соляной кислотой до рН = 3-5 по индикаторной бумаге, прибавляют 2 см3 сульфосалициловой кислоты, доводят до метки дистиллированной водой. Тщательно перемешивают и оставляют на 5 минут до полного развития окраски.
Оптическую плотность раствора измеряют при длине волны λ = 500 нм, в кювете с длиной поглощающего слоя 10 или 50 мм по холостому раствору, проведенного таким же способом с дистиллированной водой. По калибровочному графику находят содержание железа общего.
Содержание отчета.
№ п/п |
C Fe3+ мг/дм3 |
А1 |
А2 |
А3 |
|||||||||
1 |
2 |
3 |
. Ср. |
1 |
2 |
3 |
р Ср. |
1 |
2 |
3 |
С Ср. |
||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
11 |
|
|
|
|
|
|
|
|
|
|
|
|
|
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Обработка грпадуировочного графика матстатистикой.
№ |
Xi |
Yi |
Xi2 |
Xi∙ Yi |
Yiрасч |
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
Σ |
|
|
|
|
|
Обработка грпадуировочного графика матстатистикой.
№ |
Xi |
Yi |
Xi2 |
Xi∙* Yi |
Yiрасч |
7 |
|
|
|
|
|
8 |
|
|
|
|
|
9 |
|
|
|
|
|
10 |
|
|
|
|
|
11 |
|
|
|
|
|
12 |
|
|
|
|
|
Σ |
|
|
|
|
|
![]()
![]()
Yiрасч = a + b ∙Xi
![]()
![]()
Yiрасч 1=
Yiрасч 2=
Yiрасч 3=
Yiрасч 4=
Yiрасч 5=
Yiрасч 6=
Yiрасч 7=
Yiрасч 8=
Yiрасч 9=
Yiрасч 10=
Yiрасч 11=
Yiрасч 12=
Построить график зависимости А (Yiрасч ) = f (С Fe3+)
Исследуемых растворов
Номер исслеуемого раствора |
Оптическая плотность растворов |
Концентрация Fe3+ по графику в исследуемых растворах в мг/дм3 |
|||
|
А1 |
А2 |
A3 |
Аср |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
Содержание железа рассчитывается по формуле:
![]()
Сгр – концентрация железа, найденная по градуировочному графику, мг/дм3.
![]()
![]()
![]()