
- •Техническая термодинамика: цели и задачи. Основные понятия и определения: рабочее тело, термодинамическая система (тдс), виды тдс.
- •Основные параметры состояния: температура
- •3. Основные параметры состояния: давление.
- •4.Основные параметры состояния: объем.
- •5.Термодинамические процессы: равновесные, неравновесные, обратные, прямые, обратимые, необратимые, замкнутые.
- •6. Понятие идеального газа.
- •7. Уравнение состояния идеального газа.
- •8. Газовые смеси. Закон Дальтона.
- •9. Способы задания состава газовых смесей.
- •10. Теплоемкость, определение, виды, уравнения связи.
- •12. Энтальпия.
- •13. Теплота.
- •14. Работа.
- •15. Первый закон термодинамики. Аналитическое выражение, частные случаи.
- •16 Энтропия.
- •17. Уравнение Майера.
- •18. Цикл Карно.
- •19.Холодильная машина
- •21. Изотермический процесс.
- •22. Изобарный процесс.
- •23 Политропный процесс.
- •Так как для политропы в соответствии с (5.1)
- •24. Изохорный процесс.
- •25. Водяной пар.
- •26. Влажный воздух.
- •27.Термодинамика потока газа или пара.
- •28. Способы переноса теплоты.
- •Конвекция
- •29. Теплопроводность в плоских однослойных стенках.
- •30 Теплопроводность в плоских многослойных стенках. Многослойная плоская стенка
- •31 Физический смысл коэффициента теплопроводности. Уравнение Фурье.
- •32 Теплопроводность в цилиндрической однослойной стенке. Однородная цилиндрическая стенка
- •33 Теплопроводность в цилиндрической многослойной стенке.
- •34. Конвективный теплообмен.
- •35. Уравнение Ньютона-Рихмана.
- •36. Физический смысл коэффициента теплоотдачи.
- •38. Температурные графики прямоточного и противоточного тоа. Расчет среднего логарифмического температурного напора.
- •39.Числа подобия
- •40.Виды тоа по принципу действия.
- •41. Уравнение теплового баланса тоа.
6. Понятие идеального газа.
Идеальным называется газ, у которого объемы молекул бесконечно малы и отсутствуют силы молекулярного взаимодействия. Молекулы идеального газа представляют собой материальные точки, взаимодействие между которыми ограничено молекулярными соударениями.
Любой реальный газ тем ближе к идеальному, чем ниже его давление и выше температура. Например, окружающий нас воздух можно считать идеальным газом. Понятие идеального газа и законы идеальных газов полезны в качестве предела законов реального газа.
На практике часто приходится иметь дело с газами при невысоких давлениях, поэтому расчеты различных термодинамических процессов с достаточной степенью точности можно проводить по уравнениям идеального газа.
7. Уравнение состояния идеального газа.
Из
уравнений
,
и
,
следует,
что
![]() .
.
Рассмотрим 1 кг
газа. Учитывая, что в
нем содержится N
молекул
и, следовательно,
![]() , получим:
, получим:
![]() .
.
Постоянную величину Nk, отнесенную к 1 кг газа, обозначают буквой R и называют газовой постоянной. Поэтому
![]() ,
или
,
или
![]() .
(1.3)
.
(1.3)
Полученное соотношение представляет собой уравнение Клапейрона.
Умножив
(1.3) на М,
получим
уравнение
состояния для произвольной массы газа
М:![]()
![]() .
(1.4)
.
(1.4)
Уравнению Клапейрона можно придать универсальную форму, если отнести газовую постоянную к 1 кмолю газа, т. е. к количеству газа, масса которого в килограммах численно равна молекулярной массе μ. Положив в (1.4) М=μ и V=V μ, получим для одного моля уравнение Клапейрона — Менделеева:
![]() .
.
Здесь
![]() — объем киломоля газа, а
— объем киломоля газа, а
![]() —
универсальная
газовая постоянная.
—
универсальная
газовая постоянная.
В соответствии с законом Авогадро (1811г.) объем 1 кмоля, одинаковый в одних и тех же условиях для всех идеальных газов, при нормальных физических условиях равен 22,4136 м3, поэтому
![]()
Газовая
постоянная 1 кг газа составляет
![]() .
.
8. Газовые смеси. Закон Дальтона.
В инженерной практике часто приходится иметь дело с газообразными веществами, близкими по свойствам к идеальным газам и представляющими собой механическую смесь отдельных компонентов различных газов, химически не реагирующих между собой. Это так называемые газовые смеси. В качестве примера можно назвать продукты сгорания топлива в двигателях внутреннего сгорания, топках печей и паровых котлов, влажный воздух в сушильных установках и т. п.
Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений всех входящих в нее компонентов:
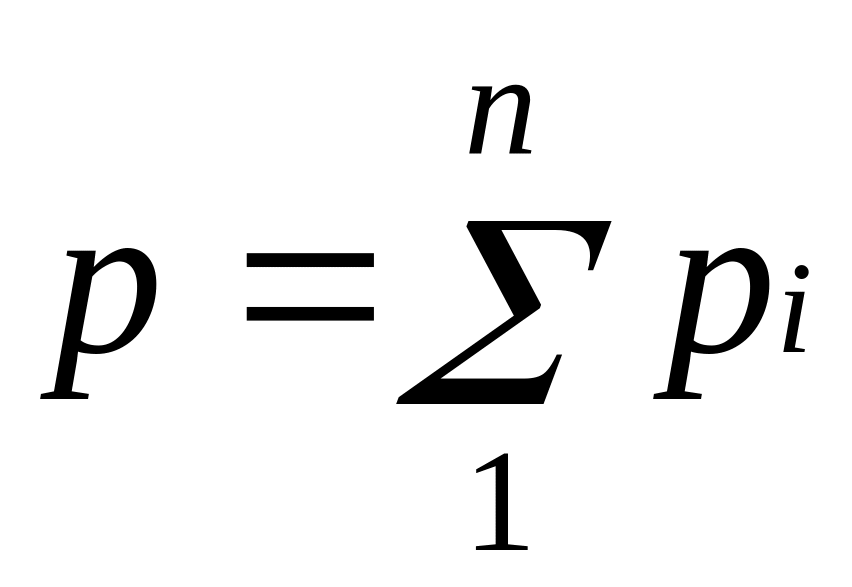
Парциальное давление pi — давление, которое имел бы газ, если бы он один при той же температуре занимал весь объем смеси.
9. Способы задания состава газовых смесей.
Состав газовой смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей называется отношение массы отдельного компонента Мi, к массе смеси М:
![]() .
.
Очевидно, что

![]() и
и
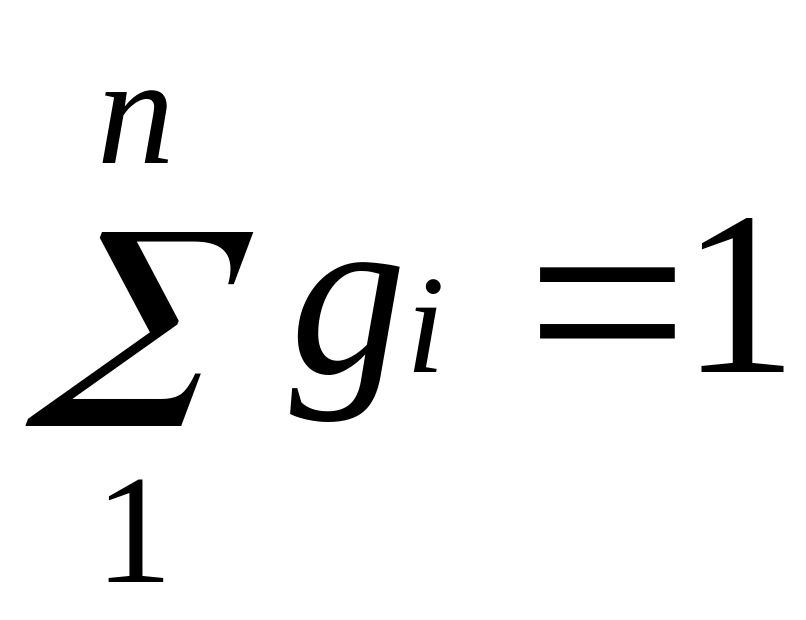 .
.
Массовые доли
часто задаются в
процентах. Например, для сухого воздуха
![]() ;
;
![]() .
.
Объемная
доля представляет
собой
отношение приведенного объема газа V,
к полному объему смеси V:
![]() .
.
Приведенным называется объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси.
Для вычисления приведенного объема запишем два уравнения состояния i-го компонента:
![]() ;
(2.1)
;
(2.1)
![]() .
.
Первое уравнение относится к состоянию компонента газа в Смеси, когда он имеет парциальное давление pi и занимает полный объем смеси, а второе уравнение — к приведенному состоянию, когда давление и температура компонента равны, как и для смеси, р и Т. Из уравнений следует, что
![]() .
(2.2)
.
(2.2)
Просуммировав
соотношение (2.2) для всех компонентов
смеси, получим с учетом закона Дальтона
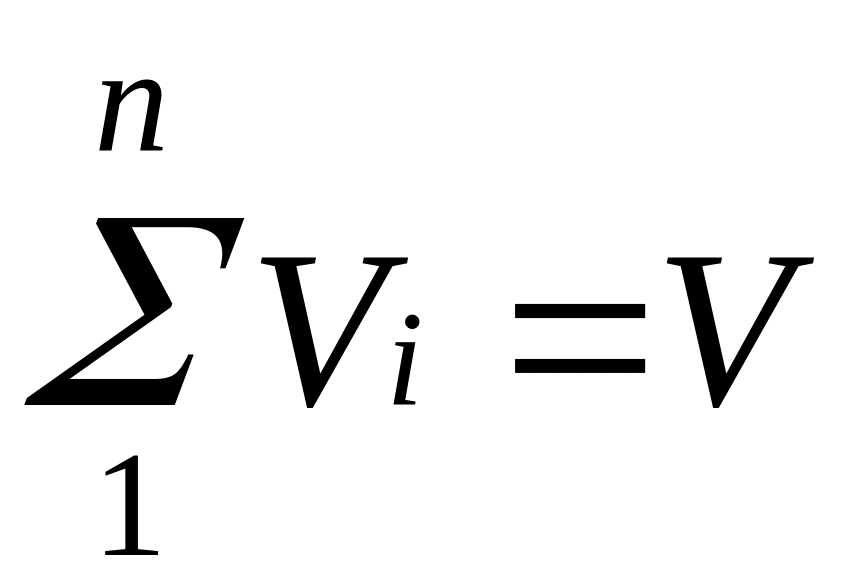 ,откуда
,откуда
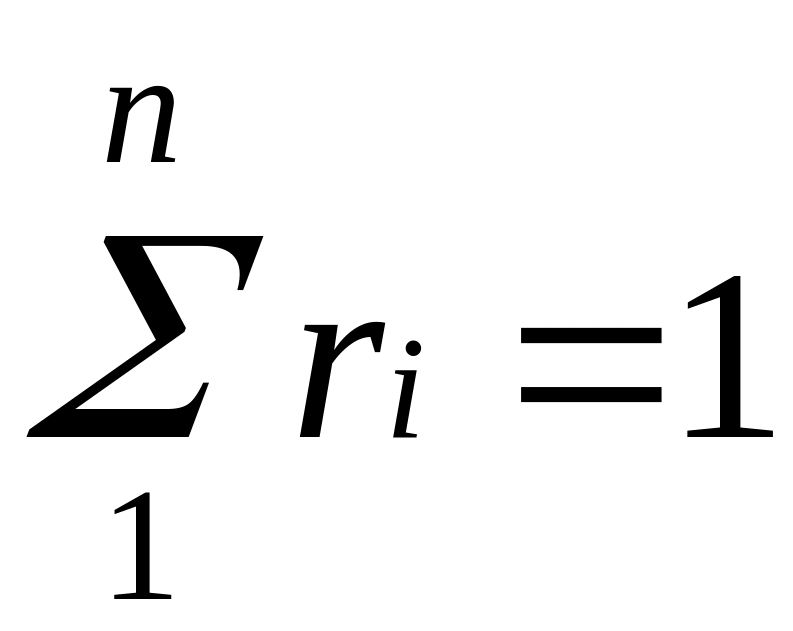 .
Объемные доли также часто задаются
в процентах. Для воздуха
.
Объемные доли также часто задаются
в процентах. Для воздуха
![]() ,
,![]() .
.
Иногда бывает удобнее задать состав смеси мольными долями. Мольной долей называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси N.
Пусть газовая
смесь состоит из N1
молей
первого компонента, N2
молей
второго
компонента и т. д. Число молей смеси
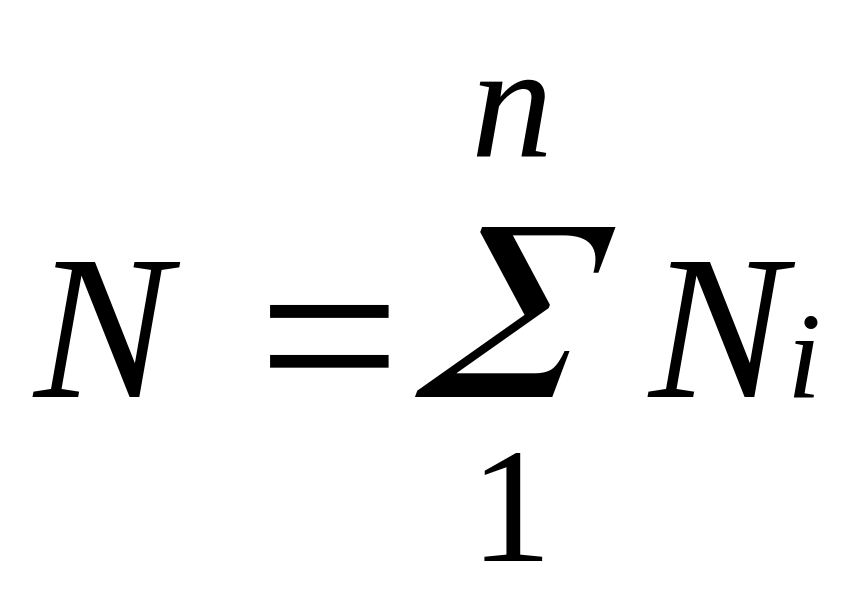 ,
а мольная доля компонента
будет равна
,
а мольная доля компонента
будет равна
![]() .
.
В
соответствии с законом Авогадро объемы
моля любого газа при одинаковых р
и Т, в
частности при температуре и
давлении смеси, в идеально газовом
состоянии одинаковы. Поэтому приведенный
объем любого компонента может быть
вычислен как произведение объема моля
![]() на число молей этого компонента,
т. е.
на число молей этого компонента,
т. е.
![]() а объем смеси — по формуле
а объем смеси — по формуле
![]() .
Тогда
.
Тогда
![]() ,
и, следовательно, задание смесильных
газов мольными долями равно заданию ее
объемными долями.
,
и, следовательно, задание смесильных
газов мольными долями равно заданию ее
объемными долями.
