
Лекция 5а
Гидролиз солей
Гидролиз – это
разложение веществ водой.
Соли, как и
другие вещества, изменяют реакцию
водного раствора, претерпевая гидролиз
(от греч.
![]() –
вода и
–
вода и
![]() –
разложение). Причиной его является
электролитическая диссоциация и соли,
и воды на ионы, и взаимодействие между
ними. Вода диссоциирует незначительно
на ионы Н+
и ОН–
(1 молекула из 550 000), причем в процессе
гидролиза один или оба этих иона могут
связываться с ионами, образующимися
при диссоциации соли, в малодиссоциирующее,
летучее или нерастворимое в воде
вещество. На практике особенно часто
приходится иметь дело с гидролизом
солей. Естественно предположить, что
растворы средних солей, которые являются
продуктами полного замещения протонов
в молекулах кислот катионами металла,
должны иметь нейтральную реакцию среды.
Однако это предположение оказывается
справедливым только в отношении солей,
образованных сильными кислотами и
сильными основаниями. Поскольку соль
состоит из катиона и аниона, то возможны
три типа гидролиза:
–
разложение). Причиной его является
электролитическая диссоциация и соли,
и воды на ионы, и взаимодействие между
ними. Вода диссоциирует незначительно
на ионы Н+
и ОН–
(1 молекула из 550 000), причем в процессе
гидролиза один или оба этих иона могут
связываться с ионами, образующимися
при диссоциации соли, в малодиссоциирующее,
летучее или нерастворимое в воде
вещество. На практике особенно часто
приходится иметь дело с гидролизом
солей. Естественно предположить, что
растворы средних солей, которые являются
продуктами полного замещения протонов
в молекулах кислот катионами металла,
должны иметь нейтральную реакцию среды.
Однако это предположение оказывается
справедливым только в отношении солей,
образованных сильными кислотами и
сильными основаниями. Поскольку соль
состоит из катиона и аниона, то возможны
три типа гидролиза:
• гидролиз по катиону (в реакцию с водой вступает только катион); • гидролиз по аниону (в реакцию с водой вступает только анион); • совместный гидролиз (в реакцию с водой вступает и катион, и анион).
Соли, образованные сильными основаниями (NаОН, КОH, Ва(ОH)2) и сильными кислотами (Н2SO4, HCl, НNO3), гидролизу не подвергаются, т.к. образующие их катионы и анионы не способны в растворах связывать ионы Н+ и ОН– (причина – высокая диссоциация). Когда соль образована слабым основанием или слабой кислотой или оба «родителя» – слабые, соль в водном растворе подвергается гидролизу. При этом реакция среды зависит от относительной силы кислоты и основания. Другими словами, водные растворы таких солей могут быть нейтральными, кислыми или щелочными в зависимости от констант диссоциации образующихся новых веществ. Реакции гидролиза в одних случаях являются обратимыми, а в других – идут до конца.
Уравнение гидролиза соли записывают в два этапа:
1) диссоциация соли в растворе − необратимая реакция (α = 1) 2) гидролиз иона соли (его взаимодействие с водой) − обратимая реакция (α < 1).
Этапы 1 и 2 складывать нельзя!
Пример 1. Гидролиз соли, образованной катионом слабого основания и анионом сильной кислоты (сульфата меди(II))
1. Определяем тип гидролиза. Привести уравнение диссоциации соли:
CuSO4 = Cu2+ + SO42-.
Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты. Идет гидролиз по иону слабого электролита, т.е. по катиону.
2. Пишем ионное уравнение гидролиза, определяем среду:
Cu2+ + H–OH = CuOH+ + H+ (pH<7).
Образуется катион гидроксомеди(II) и ион водорода, среда – кислая.
3. Составляем молекулярное уравнение. Надо учитывать, что составление такого уравнения есть некоторая формальная задача. Из положительных и отрицательных частиц, находящихся в растворе, составляются нейтральные частицы, существующие только на бумаге. В данном случае можно составить формулу (CuOH)2SO4, но для этого ионное уравнение мысленно умножается на два:
2CuSO4 + 2H2O = (CuOH)2SO4 + H2SO4.
Продукт реакции относится к группе основных солей. Названия основных солей, как и названия средних, следует составлять из названий аниона и катиона, в данном случае соль называется «сульфат гидроксомеди(II)».
Гидролиз солей слабых многоосновных оснований и/или кислот происходит ступенчато. Число ступеней гидролиза равно наибольшему заряду одного из ионов соли. Например: гидролиз Nа2СО3 происходит в 2 ступени, Al2(SО4)3 – в 3, а Co(CH3COO)2 в 2.
Однако гидролиз по второй ступени и особенно по третьей идет очень слабо. Поэтому при написании уравнений гидролиза обычно ограничиваются первой ступенью. Если гидролиз практически завершается на первой ступени, то при гидролизе солей слабых многоосновных оснований и сильных кислот образуются основные соли, а при гидролизе солей сильных оснований и слабых многоосновных кислот образуются кислые соли.
Соли, образованные катионами, сильно подверженными гидролизу (такие как Sn2+ или Bi3+), удается растворить только при добавлении кислоты; при растворении в чистой воде гидроксокатионов получается настолько много, что соответствующая основная соль выпадает в осадок:
SnCl2 + H2O = Sn(Cl)OH↓ + HCl Bi(NO3)3 + H2O = Bi(NO3)2OH↓ + HNO3
Итак, соли, образованные катионом малорастворимого основного или амфотерного гидроксида и анионом сильной кислоты, подвергаются гидролизу по катиону и образуют в растворе кислотную среду. Например, при добавлении к раствору хлорида сурьмы(III) дистиллированной воды наблюдается образование осадка SbOCl, что свидетельствует о протекании реакции гидролиза соли SbCl3 по второй ступени. Именно вторая ступень гидролиза хлорида сурьмы(III) приводит к образованию основной соли Sb(ОН)2Сl, разложение которой и дает осадок хлорида оксосурьмы. Таким образом, разбавляя раствор, смещаем равновесие реакции гидролиза в сторону образования продуктов реакции.
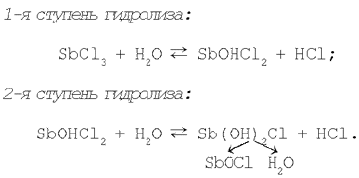
Так, если к раствору с осадком SbОСl прилить соляную кислоту, то осадок растворится. Если затем вновь в раствор добавить воду, то наблюдается повторное образование осадка.
Описанное явление подтверждает обратимый характер процесса и возможность смещения химического равновесия реакции гидролиза.
Пример 2. Гидролиз соли, образованной катионом сильного основания и анионом слабой кислоты (ортофосфата рубидия).
1. Определяем тип гидролиза:
Rb3PO4 = 3Rb+ + PO43–.
Рубидий – щелочной металл, его гидроксид – сильное основание, фосфорная кислота, особенно по своей третьей стадии диссоциации, отвечающей образованию фосфатов, – слабая кислота. Идет гидролиз по аниону.
2. Пишем ионное уравнение гидролиза, определяем среду:
PO43–+ H–OH = HPO42– + OH– (pH>7).
Продукты – гидрофосфат- и гидроксид-ионы, среда – щелочная.
3. Составляем молекулярное уравнение:
Rb3PO4 + H2O = Rb2HPO4 + RbOH.
Получили кислую соль – гидрофосфат рубидия.
Особенно сильно идет гидролиз солей, образованных одновременно слабыми основанием и кислотой. Но даже для них степень гидролиза обычно не превышает 1%.
Пример 3. Гидролиз соли, образованной катионом слабого основания и анионом слабой кислоты (ацетата алюминия).
1. Определяем тип гидролиза:
Al(CH3COO)3 = Al3+ + 3CH3COO–.
Соль образована катионом слабого основания и анионами слабой кислоты. Идет совместный гидролиз.
2. Пишем ионные уравнения гидролиза, определяем среду:
Al3+ + H–OH = AlOH2+ + H+,
CH3COO– + H–OH = CH3COOH + OH– pH раствора зависит от относительной силы кислоты и основания.
Учитывая, что гидроксид алюминия очень слабое основание, предположим, что гидролиз по катиону будет протекать в большей степени, чем по аниону. Следовательно, в растворе будет избыток ионов водорода, и среда будет кислая.
Не стоит пытаться составлять здесь суммарное уравнение реакции. Обе реакции обратимы, никак друг с другом не связаны, и такое суммирование бессмысленно.
3. Составляем молекулярное уравнение:
Al(CH3COO)3 + H2O = AlOH(CH3COO)2 + CH3COOH.
ацетат гидроксоалюминия
Необратимый гидролиз
Если соль образована слабой кислотой и слабым основанием, то такая соль нередко разлагается водой до конца (выпадает осадок, выделяется газ). Если все же водный раствор соли существует, то его кислотность зависит от того, чья константа диссоциации (основания или кислоты) больше. Когда выше значение константы диссоциации кислоты, раствор обычно слабокислый, а когда основания – слабощелочной. В некоторых случаях гидролиз солей протекает особенно сильно и степень гидролиза достигает почти 100%. Такие соли в водных растворах не существуют, а хранятся только в сухом виде. В таблице растворимости против них стоит прочерк. Примерами таких солей могут служить ВаS, Аl2S3, Сr2(SO3)3 и другие (см. таблицу растворимости в учебниках). Подобные соли, имеющие высокую степень гидролиза, гидролизуются полностью и необратимо, т. к. продукты их гидролиза выводятся из раствора в виде малорастворимого, нерастворимого, газообразного (летучего), малодиссоциирующего вещества или разлагаются водой на другие вещества. Соли, полностью разлагаемые водой, нельзя получить реакцией ионного обмена в водных растворах, т.к. вместо ионного обмена более активно протекает реакция гидролиза. Для полного протекания гидролиза нужно, чтобы соль была образована очень слабой кислотой и очень слабым основанием. Кроме того, желательно, чтобы один из продуктов гидролиза уходил из сферы реакции в виде газа. (Малорастворимые вещества, остающиеся в контакте с раствором, вообще говоря, не уходят из сферы реакции, поскольку все равно в какой-то степени растворимы.) Поэтому полному гидролизу подвергаются обычно соли газообразных или неустойчивых кислот: сероводородной, угольной, отчасти сернистой. К ним примыкают вещества, которые в обычном понимании уже не являются солями: нитриды, фосфиды, карбиды, ацетилениды, бориды. Полностью гидролизуются также алкоголяты. Например:
2АlCl3 + 3Na2S = Аl2S3 + 6NaCl (так могло бы быть), но вследствие гидролиза
2АlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S + 6NaCl (так есть фактически).
Соли, подобные Al2S3, получают в безводных средах спеканием компонентов в эквивалентных количествах или другими способами.
CaS + 2H2O = Ca(OH)2 + H2S.
3Na2SiO3 + 2AlCl3 + 6H2O = 3H2SiO3 + 2Al(OH)3 + 6NaCl.
Причина этой реакции заключается в смещении равновесий в реакциях в сторону продуктов реакции:
SiO32-
+ H2O
↔ HSiO3-
+ OH-,
Al3+
+ H2O
![]() AlOH2+
+ H+
в результате необратимого взаимодействия
гидроксид - иона с ионом водорода: Н+
+ ОН–
= H2О.
AlOH2+
+ H+
в результате необратимого взаимодействия
гидроксид - иона с ионом водорода: Н+
+ ОН–
= H2О.
Итак, допустим, что в разных сосудах установились равновесия:
CO32–
+ H2O![]() HCO3–
+ OH–,
HCO3–
+ OH–,
Al3+ + H2O AlOH2+ + H+.
Обе соли гидролизованы незначительно, но если растворы смешать, то происходит связывание ионов H+ и OH–. В соответствии с принципом Ле-Шателье оба равновесия смещаются вправо, и гидролиз протекает полностью:
2 AlCl3 + 3 Na2CO3 + 3 H2O = 2 Al(OH)3 + 3 CO2 + 6 NaCl.
Это называется взаимным усилением гидролиза.
Гидролиз бинарных соединений
Многие вещества, относящиеся к классу бинарных соединений и не являющиеся солями, не могут существовать в водном растворе, поскольку подвергаются необратимому гидролизу:
Mg3N2 + 8H2O = 3Mg(OH)2 + 2NH3 · H2O CaC2 + 2H2O = Ca(OH)2 + C2H2 ↑ SCl2O2 + 2H2O = H2SO4 + 2HCl.
Поскольку гидролиз бинарных соединений протекает необратимо, следует оберегать их от контакта с водой и влажным воздухом. Кроме солей гидролизу подвергаются и другие неорганические вещества:
Сl2 + Н2О = НСl + НClO.
В отличие от гидролиза солей, который является обменным процессом, гидролиз таких веществ, как гидриды щелочных и щелочно-земельных металлов, является окислительно-восстановительным процессом. Гидриды металлов разлагаются водой с образованием щелочи и водорода:
NaH
+ H2O
= NaOH
+ H2![]() ,
,
CaH2
+ 2H2O
= Ca(OH)2![]() + 2H2
.
+ 2H2
.
Гидролиз органических веществ происходит в присутствии катализаторов (ферментов), которые разрывают химические связи. Освободившиеся валентности используются для присоединения групп Н+ и ОН– из молекул воды. При этом реакция среды не изменяется.
Многие галогениды, как правило, активно реагируют с водой, образуя гидрид одного элемента и гидроксид другого. Например:
СlF + H–OH = HClO + HF,
PСl3 + 3H–OH = P(OH)3 + 3HCl (по Л.Полингу).
Как правило, при такого рода реакциях, также называемых гидролизом, более электроотрицательный элемент соединяется с Н+, а менее электроотрицательный – с ОН–. Легко заметить, что приведенные выше реакции протекают в соответствии с этим правилом.
