
Это позволяет заключить, что при бесконечном разбавлении степень диссоциации α стремится к единице.
Кислоты и основания диссоциируют ступенчато. Каждая ступень диссоциации характеризуется своей константой.
На состояние динамического равновесия, в котором находится раствор слабого электролита, сильно влияет присутствие одноименного иона. Так, диссоциация уксусной кислоты протекает по схеме
![]()
и для этой реакции
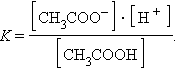
Прибавление к раствору уксусной кислоты ее соли (CH3COONa → CH3COO– + Na+) резко увеличивает концентрацию ионов CH3COO– и смещает равновесие в сторону образования недиссоциированных молекул кислоты. Ее диссоциация теперь пренебрежимо мала, и концентрация недиссоциированных молекул почти равна концентрации кислоты, тогда при [CH3COOH] = [кислота], и [CH3COO–] = [соль] концентрация H+ равна
![]()
или
![]()
Следовательно, концентрация ионов H+ этого раствора будет определяться соотношением концентраций кислоты и соли, взятых для его приготовления.
Рассуждая аналогичным образом, можно вывести уравнения для раствора слабого основания и его соли (NH4OH и NH4Cl):
![]()
или
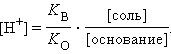
Из предыдущих уравнений видно, что концентрация ионов водорода при разбавлении сохраняется, ибо отношения [кислота]:[соль], [соль]:[основание] остаются постоянными. Добавление к такой смеси кислоты или щелочи приводит к связыванию избыточных ионов H+ анионами, а OH– – катионами. Это смещает равновесие диссоциации слабого электролита, в результате чего концентрация H+ практически не меняется. Растворы, содержащие смесь слабого электролита и его соли, сохраняющие характерные для него значения pH при разбавлении, добавлении сильных кислот или щелочей, называются буферными.
Произведение растворимости
Растворение твердых электролитов прекращается, когда образуется насыщенный раствор, в котором устанавливается гетерогенное равновесие между твердой фазой и перешедшими в раствор ионами. Например:
CaSO4
(т) ![]() Ca2+(р-р)
+ SO42–(р-р)
Ca2+(р-р)
+ SO42–(р-р)
В выражение константы этого гетерогенного равновесия не входит концентрация твердой фазы (см. особенности закона действия масс для гетерогенных процессов): K= [Ca2+][SO42–].
В насыщенном растворе твердого электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Она называется произведением растворимости. ПР(CaSO4) = [Ca2+][SO42–].
Если молекула электролита содержит несколько одинаковых ионов, то концентрации этих ионов, согласно закону действия масс, должны быть возведены в соответствующие степени. Например: PbI2 Pb2+ + 2 I–, ПР(PbI2) = [Pb2+][I–]2.
Зная произведения растворимости, можно решать вопросы, связанные с образованием или растворением осадков при химических реакциях. Например, пусть диссоциация соли АВ происходит на два иона:
АВ А+ + В–
Обозначив
растворимость через s
(моль/л), получим [A+]=[B–]=s,
ПР=[A+][B–]=s2.
На практике чаще возникает обратная
задача определения растворимости. Для
соли, диссоциирующей на два иона, ![]() .
Значения ПР можно найти в химических
справочниках. Например, ПР(AgCl)=1,8·10–10,
ПР(AgBr)=6·10–13,
ПР(BaSO4)=1,1·10–10,
ПР(HgS)=10–52.
Если соль имеет общую формулу AB2,
то она диссоциирует по уравнению:
.
Значения ПР можно найти в химических
справочниках. Например, ПР(AgCl)=1,8·10–10,
ПР(AgBr)=6·10–13,
ПР(BaSO4)=1,1·10–10,
ПР(HgS)=10–52.
Если соль имеет общую формулу AB2,
то она диссоциирует по уравнению:
AB2 A2+ + 2 B–
В
этом
случае
[A2+]=s,
[B–]
=2s,
ПР=[A2+][B–]2
=s
·
(2s)2
=
4s3, ![]() .
.
Если фактическое произведение концентраций (ПС) ионов в некотором растворе превышает значение произведения растворимости, т.е. ПС>ПР, то раствор является пересыщенным, и из него выпадает осадок. Условие растворения осадка (ненасыщенности раствора): ПС<ПР. Оба процесса идут с одинаковой скоростью, и система приходит в состояние равновесия при ПС=ПР (насыщенный раствор).
