
- •Термодинамика - отдел теоретической физики, изучающий явления исключительно с точки зрения превращения энергии из одного вида в другой, не рассматривая их по существу.
- •Билет 1.
- •Билет 2,3,4,5,6.
- •1Ое начало термодинамики
- •Билет 7.
- •Билет 8.
- •Билет 9.
- •Билет 10.
- •Билет 11.
- •Билет 12.
- •Билет 13.
- •Билет 14.
Билет 12.
Полученные неравенства выражают собой закон возрастания энтропии, который можно сформулировать следующим образом:
В адиабатически изолированной термодинамической системе энтропия не может убывать: она или сохраняется, если в системе происходят только обратимые процессы, или возрастает, если в системе протекает хотя бы один необратимый процесс.
Таким образом, изолированная термодинамическая система стремится к максимальному значению энтропии, при котором наступает состояние термодинамического равновесия.
При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия:

при δQ = 0.
Поэтому цикл Карно удобно представить в координатах T и S (температура и энтропия).
Билет 13.
Поскольку в системе при изохорном процессе происходит теплообмен с внешней средой, то происходит изменение энтропии.
![]()
![]() - молярная теплоемкостью при постоянном
объеме.
- молярная теплоемкостью при постоянном
объеме.
![]()
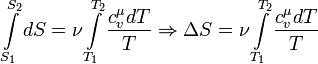
Изменение энтропии при квазистатическом изобарном процессе равно
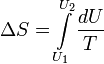
В случае, если изобарный процесс
происходит в идеальном газе, то dU = d(νCvT
+ νRT) = ν(Cv + R)dT = νCpdT, следовательно,
изменение энтропии можно выразить как
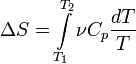
Если пренебречь зависимостью Cp от
температуры, то
![]()
Изотермический процесс
![]()
Термодинамическая вероятность — число способов, которыми может быть реализовано состояние физической системы.
Уравнение Больцмана связывает энтропию S идеального газа и термодинамическую вероятность — величину W, которая равна количеству микросостояний, соответствующих данному макросостоянию системы(статистический вес)
![]()
Иначе говоря, формула Больцмана показывает отношение между энтропией и числом способов конструирования данной системы из атомов или молекул.
Правило, позволяющее определить, в каком именно направлении будет идти процесс при заданных условиях, называется вторым началом термодинамики. Разные состояния тела, соответствующие различному расположению молекул (атомов, ионов) и разным значениям их скоростей, осуществляются с очень разной вероятностью.
По самому смыслу понятия вероятности любая система, предоставленная сама себе (то есть изолированная), будет переходить из состояния с меньшей вероятностью в состояние, вероятность которого больше. Обратный переход в принципе возможен, но практически невероятен.
Учитывая формулу Больцмана, мы сразу приходим к формулировке второго начала термодинамики: все реальные процессы в изолированной системе происходят в сторону состояний с большей вероятностью, то есть с увеличением энтропии. Таким образом, второе начало является вероятностным законом.
Билет 14.
Хаотическое движение молекул в газе приводит к тому, что в объеме газа поддерживается равновесное состояние, которое характеризуется постоянством параметров состояния газа и концентрации молекул во всем его объеме.
При нарушении равновесия в газе хаотическое движение молекул приводит к возникновению макроскопических потоков, стремящихся восстановить нарушенное равновесное состояние. Явления, возникающие при протекании этих процессов, называются явлениями переноса.
К явлениям переноса относят диффузию, внутреннее трение (вязкость), теплопроводность.
Диффузия - взаимное проникновение соприкасающихся веществ друг в друга вследствие теплового движения частиц вещества. Диффузия это явление, обусловленное переносом массы.
Процесс диффузии описывается законом Фика:
m = D grad S,
где m масса газа, переносимая через площадь S в единицу времени; D коэффициент диффузии; grad = d / dz градиент плотности газа в направлении переноса.
Коэффицие́нт диффу́зии — количественная характеристика скорости диффузии.
(см.формулу в тетради).
![]() ;
;
Поток частиц и перенос массы.
(см. формулы в тетради)
Билет 15.
Общее уравнение перноса
Тогда общее уравнение переноса для любой величины через площадку единичной площади, перпендикулярную направлению переноса, будет следующим:
![]()
где
![]() – концентрация молекул,
– концентрация молекул,
![]() – средняя скорость молекул,
– средняя скорость молекул,
![]() – расстояние свободного пробега.
– расстояние свободного пробега.
Коэффициент переноса – физ.величина, являющаяся характеристикой какого-либо явления переноса.
Поток качества
Качество – параметр, которым обладет частица (импульс, масса, энергия)
Потоки характеризуют скорость переноса физ. величины.
Билет 16.
Вязкость - внутреннее трение, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой.
Внутреннее трение это явление, обусловленное переносом импульса.
Сила трения, возникающая между слоями газа, определяется законом Ньютона:
Fтр = S grad v,
где коэффициент внутреннего трения (вязкости); v скорость отдельных слоев газа; grad v градиент скорости в направлении, перпендикулярном к поверхности, разделяющей слои (в нашем случае grad v = dvx / dz); S площадь соприкасающихся слоев.
![]() ;
= D . – коэффициент
вязкости
;
= D . – коэффициент
вязкости
Перенос импульса
(см. в учебнике)
Билет 17.
Теплопроводность, один из видов переноса теплоты (энергии теплового движения микрочастиц) от более нагретых частей тела к менее нагретым, приводящий к выравниванию температуры.
![]()
Поток энергии - плотность теплового потока — количество энергии, проходящей в единицу времени через единицу площади, перпендикулярной каждой оси
Билет 18.
Нестационарный процесс –плотность потока тепла постоянно меняется.
Нестационарный перенос тепла теплопроводностью описывается дифференциальным законом Фурье:
Cd∂T / ∂t ) = δ (λ δ T) + qv, где где C - удельная теплоемкость; d - плотность; qv - объемная плотность потока тепла от внутренних источников; t - время. При независящих от температуры свойствах C, d и l выражение может быть переписано так:
∂T / ∂t ) = a δ2T + (qv / Cd), где a = λ / Cd - коэффициент температуропроводности, характеризующий скорость распространения тепла в веществе.
Билет 19.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
![]()
где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная.
Термин «сжимаемость» также используется в термодинамике для описания отклонений термодинамических свойств реальных газов от свойств идеальных газов. Коэффициент сжимаемости определяется как
![]()
Ур-ие Ван-дер-Ваальса для 1 моля газа:
![]()
поправка a учитывает силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь), поправка b — силы отталкивания (из общего объёма вычитаем объём, занимаемый молекулами).
Для исследования поведения реального газа рассмотрим изотермы Ван-дер-Ваальса – кривые зависимости p от Vm при заданных Т, - определяемые уравнением Ван-дер-Ваальса для моля газа. Эти кривые, полученные для четырёх различных температур имеют довольно своеобразный характер: при высоких температурах (Т>Тк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением её формы, оставаясь монотонно спадающей кривой; при некоторой температуре, на изотерме имеется лишь одна точка перегиба; при низких температурах (Т<Тк) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
Для пояснения характера изотерм реального газа преобразуем уравнение Ван-дер-Ваальса к виду: pV3m-(RT+pb)V2m+aVm-ab=0. Это уравнение при заданных р и Т Является уравнением третьей степени относительно Vm; следовательно, оно может иметь либо три вещественных корня, либо один вещественный и два мнимых, причём физический смысл имеют лишь вещественные положительные корни. Поэтому первому случаю соответствуют изотермы при низких температурах, второму случаю – изотермы при высоких температурах.
Критическая изотерма
При некоторой температуре Тк на изотерме имеется лишь одна точка перегиба К - Эта изотерма называется критической, соответствующая ей температу- температура Тк — критической температурой. Критическая изотерма имеет лишь одну точку перегиба К, называемую критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vк и давление Pк называются также критическими. Состояние с критическими параметрами (Pк Vк, Tк)называется критическим состоянием.
Сжижение газов включает в себя несколько стадий, необходимых для перевода газа в жидкое состояние.
Сжижение газов — сложный процесс, который включает в себя множество сжатий и расширений газа для достижения высокого давления и низких температур.
Абсолютный газ – который невозможно превратить в жидкость.
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул и из потенциальной энергии межмолекулярного взаимодействия. Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами.
Наличие сил притяжения приводит к возникновению внутреннего давления на газ
![]()
Работа, которая затрачивается для
преодоления сил притяжения, действующих
между молекулами газа, как известно из
механики, идет на увеличение потенциальной
энергии системы, т. е.
![]() или
или
![]() откуда
откуда
![]()
(постоянная интегрирования принята равной нулю). Знак минус означает, что молекулярные силы, создающие внутреннее давление р', являются силами притяжения. Учитывая оба слагаемых, получим, что внутренняя энергия моля реального газа
![]()
растет с повышением температуры и увеличением объема.
