
- •Термодинамика - отдел теоретической физики, изучающий явления исключительно с точки зрения превращения энергии из одного вида в другой, не рассматривая их по существу.
- •Билет 1.
- •Билет 2,3,4,5,6.
- •1Ое начало термодинамики
- •Билет 7.
- •Билет 8.
- •Билет 9.
- •Билет 10.
- •Билет 11.
- •Билет 12.
- •Билет 13.
- •Билет 14.
Билет 8.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
![]()
где
![]() — подведённая к телу теплота, измеренная
в джоулях
— подведённая к телу теплота, измеренная
в джоулях
![]() —
работа, совершаемая телом против внешних
сил, измеренная в джоулях
—
работа, совершаемая телом против внешних
сил, измеренная в джоулях
В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией движения всех его молекул. Средняя энергия движения одной молекулы равна
![]()
Так как в одном киломоле содержится
![]() молекул, то внутренняя энергия одного
киломоля газа будет
молекул, то внутренняя энергия одного
киломоля газа будет
![]()
Учитывая, что
![]() , получим
, получим
![]()
Для любой массы m газа, т.е. для любого
числа киломолей
![]() внутренняя энергия
внутренняя энергия
![]()
Из этого выражения следует, что внутренняя энергия является однозначной функцией состояния и, следовательно, при совершении системой любого процесса, в результате которого система возвращается в исходное состояние, полное изменение внутренней энергии равно нулю.
Равномерное распределение энергии по степеням свободы газовой молекулы:
В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы.
![]()
![]()
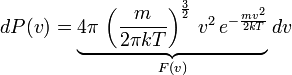
Так, мы получили
![]() -
функцию плотности вероятности, которая
и называется распределением Максвелла.
-
функцию плотности вероятности, которая
и называется распределением Максвелла.
Условия применимости распределения Максвелла:
1. Равновесное состояние системы, состоящей из большого числа частиц.
2. Изотропная система.
3. Классическая система. Это значит, что система должна быть не релятивистской и не квантовой (взаимодействие частиц допускается, но только зависящее от относительного положения частиц).
Постоянная Больцмана - физическая постоянная, определяющая связь между температурой и энергией.
![]() Дж/К
Дж/К
Универсальная газовая постоянная определяется как произведение постоянной Больцмана на число Авогадро, R = kNA. Газовая постоянная более удобна, когда число частиц задано в молях.
Молярные теплоемкости идеального газа
Молярная теплоемкость — теплоемкость 1 моля идеального газа.
![]()
![]()
Билет 9.
Равнове́сный тепловой процесс — тепловой процесс, в котором система проходит непрерывный ряд бесконечно близких равновесных термодинамических состояний. Термодинамическое равновесие — состояние системы, при котором остаются неизменными по времени макроскопические величины этой системы (температура, давление, объем, энтропия) в условиях изолированности от окружающей среды.
Равновесный тепловой процесс называется обратимым, если его можно провести обратно и в телах, окружающих систему, не останется никаких изменений.
Реальные процессы изменения состояния системы всегда происходят с конечной скоростью, поэтому не могут быть равновесными. Реальный процесс изменения состояния системы будет тем ближе к равновесному, чем медленнее он совершается, поэтому равновесные процессы называют квазистатическими.
Квазистатический процесс в термодинамике — идеализированный процесс, состоящий из непрерывно следующих друг за другом состояний равновесия.
Неравновесные процессы, в термодинамике и статистической физике — физические процессы, включающие неравновесные состояния.
Неравновесное состояние, в термодинамике состояние системы, выведенной из равновесия термодинамического; в статистической физике — из состояния статистического равновесия. В системе, находящейся в Н. с., происходят необратимые процессы, которые стремятся вернуть систему в Состояние термодинамического (или статистического) равновесия, если нет препятствующих этому факторов.
Термодинами́ческие ци́клы — круговые процессы в термодинамике, то есть такие процессы, в которых начальные и конечные параметры, определяющие состояние рабочего тела (давление, объём, температура, энтропия), совпадают.
Термодинамические циклы являются моделями процессов, происходящих в реальных тепловых машинах для превращения тепла в механическую работу, а также для отъема тепла от более холодного тела и передачи его более горячему (охлаждения) под действием механической работы.
Теплова́я маши́на — устройство, преобразующее тепловую энергию в механическую работу (тепловой двигатель) или механическую работу в тепло (холодильник). Преобразование осуществляется за счёт изменения внутренней энергии рабочего тела — на практике обычно пара или газа.
Идеальная тепловая машина — машина, в которой произведённая работа и разница между количеством подведённого и отведённого тепла равны. Работа идеальной машины описывается циклом Карно.
![]()
Заметим, что мощность тепловой машины Карно равна нулю, так как передача тепла в отсутствие разности температур идёт бесконечно медленно.
Цикл Карно - обеспечивает максимальную величину к.п.д., если заданы максимальная температура нагревателя и минимальная температура холодильника.
Холодильный коэффициент
Холодильный коэффициент, определяется как отношение отнятой от охлаждаемого тела теплоты Q2/A’=Q2/(Q’1-Q2)
![]()
![]()
Холодильный коэффициент, безразмерная величина (обычно больше единицы), характеризующая энергетическую эффективность работы холодильной машины; равна отношению холодопроизводительности к количеству энергии (работе), затраченной в единицу времени на осуществление холодильного цикла.
eк = T0/(Т — Т0), где T0 и Т — абсолютные температуры охлаждаемого объекта и окружающей среды (кипения и конденсации хладагента). При заданной температуре окружающей среды Т на единицу полученного искусственного холода затрачивается тем большая энергия, чем ниже температура охлаждаемого объекта. Последняя характеризует термодинамическую ценность холода.
В течение цикла рабочее тело теплового двигателя получает от нагревателя количество теплоты Q1, совершает работу А и отдает некоторое количество теплоты Q2 < Q1 холодильнику. Все процессы совершаются квазистатически, что обеспечивает их обратимость.
