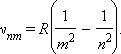- •Уравнение Шредингера
- •7)Некоторые задачи квантовой механики: движение свободной частицы, движение частицы в бесконечно глубокой потенциальной яме. Туннельный эффект. Области и границы применения квантовой механики.
- •10) Состояние электрона в многоэлектронных атомах, квантование физических характеристик электрона, квантовые числа, распределение электронов по слоям и оболочкам, принцип Паули.
- •Строение атомов и принцип Паули
- •11) Физические принципы работы квантовых генераторов (лазеров).
6) Волновые свойства микрочастиц. Гипотеза де Бройля. Соотношения неопределенностей. Представление о микрочастицах в квантовой механике, волновая функция. Нестационарное уравнение Шредингера, стационарное уравнение Шредингера в общем случае.
Волновые
свойства микрочастиц. Гипотеза де
Бройля
В
1923 французский физик Л. де Бройль
выдвинул гипотезу об универсальности
корпускулярно-волнового дуализма.
Де Бройль утверждал, что не только
фотоны, но и электроны и любые другие
частицы материи наряду с корпускулярными
обладают также и волновыми свойствами.
Согласно де Бройлю, с каждым
микрообъектом связаны, с одной
стороны, корпускулярные
характеристики –
энергия E и импульс p, а с другой
стороны, волновые
характеристики –
частота ν и длина волны λ, причем
соотношения, связывающие волновые и
корпускулярные характеристики частицы
остаются такими же, как и в случае
электромагнитного излучения. Напомним,
что энергия ![]() и
импульс
и
импульс ![]() фотона
связаны с круговой частотой
фотона
связаны с круговой частотой ![]() и
длиной волны
и
длиной волны ![]() соотношениями
соотношениями
![]()
По
гипотезе де Бройля движущейся частице,
обладающей энергией
и
импульсом
,
соответствует волновой процесс, частота
которого равна:
![]() а
длина волны
а
длина волны

Волна де Бройля – частный случай фундаментального понятия о квантовой физике – волновой функции.
Соотношения неопределенностей Шредингера Поведение микрочастиц показывает, что существует принципиальный предел точности, с которой могут быть указаны и измерены их динамические параметры, момент импульса, энергия, скорость и др.
Соотношение неопределенностей – следствие корпускулярно – волнового дуализма 1)ограничивает точности одновременного изменения координаты и соответствующей проекции импульса частиц где
2)устанавливает неопределенность измененния энергии за данный промежуток времени т.е для изменения энергии с погрешностью ∆Е необходимо время Выводы:
1)Невозможно состояние при котором бы частица находилась в покое 2)Рассматривая движения квантовых объектов необходимо отказаться от понятия «траектория» 3)Часто инеет смысл разделение энергии на потенциальную и кинетическую. Потенц. Зависит ит координаты, а кин. – от импульса, которые не могут одновременно иметь определенные значения.
Волновая
функция (или
вектор состояния) – комплексная функция,
описывающая состояние квантовомеханической
системы. Её знание позволяет получить
максимально полные сведения о системе,
принципиально достижимые в микромире.
Так с её помощью можно рассчитать все
измеряемые физические характеристики
системы, вероятность пребывания её в
определенном месте пространства и
эволюцию во времени. Волновая функция
может быть найдена в результате решения
волнового уравнения Шредингера.
Волновая функция ψ(x, y, z, t) ≡
ψ(x,t) точечной бесструктурной частицы
является комплексной функцией координат
этой частицы и
времени.
Свойства:
1)Гладкая
2)Неприрывная
В
любой момент времени волновая функция
должна быть непрерывной функцией
пространственных координат. Кроме того,
непрерывными должны быть также частные
производные волновой
функции ![]() ,
, ![]() ,
, ![]() .
3)Нормируется
.
3)Нормируется
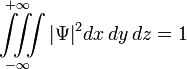
Это
условие выражает тот факт, что вероятность
обнаружить частицу с данной волновой
функцией где-либо во всём пространстве
равна единице. В общем случае интегрирование
должно производиться по всем переменным,
от которых зависит волновая функция в
данном представлении.
Физический
смысл пси функции в том, что квадрат ее
модуля определяет вероятность того,
что микрообъект будет обнаружен в
пределах объема
![]()
Уравнение Шредингера


7)Некоторые задачи квантовой механики: движение свободной частицы, движение частицы в бесконечно глубокой потенциальной яме. Туннельный эффект. Области и границы применения квантовой механики.
Потенциальная яма – область пространства, где присутствует локальный минимум потенциальной энергии частицы.
Если в потенциальную яму попала частица, энергия которой ниже, чем необходимая для преодоления краёв ямы, то возникнут колебания частицы в яме. Амплитуда колебаний будет обусловлена собственной энергией частицы. Частица, находящаяся на дне потенциальной ямы, пребывает в состоянии устойчивого равновесия, то есть при отклонении частицы от точки минимума потенциальной энергии возникает сила, направленная в противоположную отклонению сторону. Если частица подчиняется квантовым законам, то даже несмотря на недостаток энергии она с определённой вероятностью может покинуть потенциальную яму (явление туннельного эффекта).
Тунне́льный эффект, туннели́рование — преодоление микрочастицей потенциального барьера в случае, когда её полная энергия (остающаяся при туннелировании неизменной) меньше высоты барьера.
Потенциальный барьер — противоположное понятие. Это область пространства, где присутствует локальный максимум потенциальной энергии.
6. Простейшим атомом является атом водорода, содержащий один единственный электрон, движущийся по замкнутой орбите в кулоновском поле ядра. В первом приближении ядро атома можно считать неподвижным, а электронные орбиты - круговыми орбитами.
При этих предположениях Бор сформулировал основные положения теории атома водорода в виде трех постулатов.
1. Электрон
в атоме может двигаться только по
определенным стационарным орбитам,
каждой из которых можно приписать
определенный номер ![]() .
Такое движение соответствует стационарному
состоянию атома с неизменной полной
энергией
.
Такое движение соответствует стационарному
состоянию атома с неизменной полной
энергией ![]() .
Это означает, что движущийся по
стационарной замкнутой орбите электрон,
вопреки законам классической
электродинамики, не излучает энергии.
.
Это означает, что движущийся по
стационарной замкнутой орбите электрон,
вопреки законам классической
электродинамики, не излучает энергии.
2. Разрешенными
стационарными орбитами являются только
те, для которых угловой момент
импульса ![]() электрона
равен целому кратному величины постоянной
Планка
электрона
равен целому кратному величины постоянной
Планка ![]() .
Поэтому для
.
Поэтому для ![]() -ой
стационарной орбиты выполняется условие
квантования
-ой
стационарной орбиты выполняется условие
квантования
|
|
3. Излучение
или поглощение кванта излучения
происходит при переходе атома из одного
стационарного состояния в другое.
При этом частота ![]() излучения
атома определяется разностью энергий
атома в двух стационарных состояниях,
так что
излучения
атома определяется разностью энергий
атома в двух стационарных состояниях,
так что
|
|
Ква́нтовый генератор — общее название источников электромагнитного излучения, работающих на основе вынужденного излучения атомов и молекул. В зависимости от того, какую длину волны излучает квантовый генератор, он может называться по разному: лазер, мазер, разер, газер. Впервые на возможность создания квантового генератора указал советский физик В. А. Фабрикант в конце 40-х годов.
Квантовый генератор оптического диапазона - лазеры. (оптические квантовые генераторы, ОКГ) появились в 1960. Лазеры работают в широком диапазоне длин волн от ультрафиолетовой до субмиллиметровой областей спектра, в импульсном и непрерывном режимах. Существуют лазеры на кристаллах и стеклах, газовые, жидкостные и полупроводниковые. В отличие от др. источников света, лазеры излучают высококогерентные монохроматические световые волны, вся энергия которых концентрируется в очень узком телесном угле.
8)Ядерная модель атома. Опыты Резерфорда по рассеянию α – частиц. Состояние электрона в атоме водорода с точки зрения теории Бора. Экспериментальные подтверждения постулатов Бора – опыты Франка и Герца.
Планетарная Модель Атома
На основании результатов своих экспериментов Э. Резерфорд предложил модель атома, по которой в центре атома расположено положительно заряженное ядро диаметром порядка 10 15 м, в котором сосредоточена почти вся масса атома. Вокруг ядра, подобно планетам солнечной системы, обращаются электроны. Так как атом в обычном состоянии электрон нейтрален, то суммарный заряд электронов равен по модулю заряду ядра.
Опыт Резерфорда
Для
экспериментального исследования
распределения положительного заряда,
а значит, и массы внутри атома Э. Резерфорд
(1871 - 1937) предложил, применить зондирование
атома с помощью ![]() частиц
(полностью ионизированные атомы гелия,
скорость
частиц
составляет 1/15 скорости свет).
частиц
(полностью ионизированные атомы гелия,
скорость
частиц
составляет 1/15 скорости свет).
Этими частицами Резерфорд бомбардировал атомы тяжелых элементов. Электроны вследствие своей малой массы не могут заметно изменить траекторию частицы. Рассеяние (изменение направления движения) частиц может вызвать только положительно заряженная часть атома. Таким образом, по рассеянию частиц можно определить характер распределения положительного заряда и массы внутри атома. Резерфорд попытался обнаружить отклонение частиц на большие углы. Совершенно неожиданно оказалось, что небольшое число частиц (примерно одна из двух тысяч) отклонились на углы, большие 90. Положительный заряд, распределенный по объему всего атома, не может создать достаточно интенсивное электрическое поле, способное отбросить частицу назад. Очевидно, что частица могла быть отброшена назад лишь в том случае, если положительный заряд атома и его масса сконцентрированы в очень малой области пространства. Так Резерфорд пришел к идее атомного ядра - тела малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома.
Подсчитывая
число
частиц,
рассеянных на различные углы, Резерфорд
смог оценить размеры ядра. Оказалось,
что имеет диаметр порядка ![]() см.
Впоследствии удалось определить и заряд
ядра. При условии, что заряд электрона
принят за единицу, заряд ядра в точности
равен порядковому номеру данного
химического элемента в таблице Менделеева.
см.
Впоследствии удалось определить и заряд
ядра. При условии, что заряд электрона
принят за единицу, заряд ядра в точности
равен порядковому номеру данного
химического элемента в таблице Менделеева.
ФРАНКА - ГЕРЦА ОПЫТ - опыт, показавший, что внутр. энергия атома не может изменяться непрерывно, а принимает определённые дискретные значения (квантуется). Впервые поставлен в 1913 нем. физиками Дж. Франком (J. Franck) и Г. Герцем (G. Hertz). Сыграл важную роль в эксперим. подтверждении теории атома Бора (см. Атомная физика).
В опыте исследовалась зависимость силы тока I от ускоряющего потенциала V между катодом К (рис. 1) и сеткой C1; между сеткой С2 и анодом А приложен замедляющий потенциал. Электроны, ускоренные в области I, испытывают в области II соударения с атомами паров ртути, заполняющими трубку Л. На анод А попадают только те электроны, энергия к-рых после соударения с атомом достаточна для преодоления замедляющего потенциала в области III. При увеличении ускоряющего потенциала от 0 до 4,9 В гальванометр показал монотонный рост I; т.о., в этой области V соударения электронов с атомами носят упругий характер, внутр. энергия атомов не меняется. При значении V>=4,9 B (и кратных ему значениях V>=9,8; 14,7 B,...)на кривой I(V)появляются спады (рис. 2): соударения электронов с атомами становятся неупругими- внутр. энергия атомов растёт за счёт энергии электронов.


Таким образом, Ф.- Г. о. показал, что спектр поглощаемой атомом энергии не непрерывен, а дискретен, мин. порция энергии (квант энергии), к-рую может поглотить атом Hg, равна 4,9 эВ. Значение длины волны l=253,7 нм свечения паров Hg, возникавшее при V>=4,9 B, оказалось в соответствии со вторым постулатом Бора
![]() где
где ![]() -энергии
основного и возбуждённого уровней
энергии; в
Ф.- Г. о.
-энергии
основного и возбуждённого уровней
энергии; в
Ф.- Г. о. ![]()
3. Простейшим атомом является атом водорода, содержащий один единственный электрон, движущийся по замкнутой орбите в кулоновском поле ядра. В первом приближении ядро атома можно считать неподвижным, а электронные орбиты - круговыми орбитами.
При этих предположениях Бор сформулировал основные положения теории атома водорода в виде трех постулатов.
1. Электрон в атоме может двигаться только по определенным стационарным орбитам, каждой из которых можно приписать определенный номер . Такое движение соответствует стационарному состоянию атома с неизменной полной энергией . Это означает, что движущийся по стационарной замкнутой орбите электрон, вопреки законам классической электродинамики, не излучает энергии.
2. Разрешенными стационарными орбитами являются только те, для которых угловой момент импульса электрона равен целому кратному величины постоянной Планка . Поэтому для -ой стационарной орбиты выполняется условие квантования
. |
|
3. Излучение или поглощение кванта излучения происходит при переходе атома из одного стационарного состояния в другое. При этом частота излучения атома определяется разностью энергий атома в двух стационарных состояниях, так что
. |
4.
В теории дифференциальных уравнений
доказывается, что уравнения типа
![]() имеют
решения, удовлетворяющие требованиям
однозначности, конечности и
непрерывности волновой функции , только
при собственных значениях энергии
имеют
решения, удовлетворяющие требованиям
однозначности, конечности и
непрерывности волновой функции , только
при собственных значениях энергии
![]() т.
е. для дискретного набора отрицательных
значений энергии.
т.
е. для дискретного набора отрицательных
значений энергии.
Таким образом, как и в случае «потенциальной ямы» с бесконечно высокими «стенками» и гармонического осциллятора, решение уравнения Шредингера для атома водорода приводит к появлению дискретных энергетических уровней. Возможные значения Е1, E2, Е3,... показаны на рис. 302 в виде горизонтальных прямых. Самый нижний уровень Е1, отвечающий минимальной возможной энергии, — основной, все остальные (Еn >Е1, n = 2, 3, ...) —возбужденные. При Е<0 движение электрона является связанным — он находится внутри гиперболической «потенциальной ямы». Из рисунка следует, что по мере роста главного квантового числа n энергетические уровни располагаются теснее и при n= E = 0. При Е>0 движение электрона является свободным; область непрерывного спектра Е>0 (заштрихована на рис. 302) соответствует ионизованному атому. Энергия ионизации атома водорода равна
![]()
Выражение совпадает с формулой, полученной Бором для энергии атома водорода. Однако если Бору пришлось вводить дополнительные гипотезы (постулаты), то в квантовой механике дискретные значения энергии, являясь следствием самой теории, вытекают непосредственно из решения уравнения Шредингера.

9)Уравнение Шредингера для электрона в атоме водорода, квантование физических характеристик электрона, квантовые числа. Излучение атома водорода, вывод формулы Бальмера – Ридберга. Спектральные серии. Правило отбора.
Квантовые
числа. В
квантовой механике доказывается, что
уравнению Шредингера удовлетворяют
собственные функции ![]() ,определяемые
тремя квантовыми числами:
главным п, орбитальным l и
магнитным тl.
,определяемые
тремя квантовыми числами:
главным п, орбитальным l и
магнитным тl.
Главное
квантовое число n,
согласно, определяет энергетические
уровни электрона в
атоме и может принимать любые целочисленные
значения начиная с единицы:![]()
Из
решения уравнения Шредингера вытекает,
что момент
импульса (механический
орбитальный момент) электрона
квантуется, т.
е. не может быть произвольным, а принимает
дискретные значения, определяемые
формулой
![]()
где l — орбитальное
квантовое число,
которое при заданном n принимает
значения
![]() т. е. всего n значений,
и определяет момент импульса электрона
в атоме.
т. е. всего n значений,
и определяет момент импульса электрона
в атоме.
Из
решения уравнений Шредингера следует
также, что вектор Ll момента
импульса электрона может иметь лишь
такие ориентации в пространстве, при
которых его проекция Llx на
направление z внешнего
магнитного поля принимает квантованные
значения, кратные ћ:
![]() где тl — магнитное
квантовое число, которое
при заданном l может
принимать значения
где тl — магнитное
квантовое число, которое
при заданном l может
принимать значения![]() т. е. всего 2l+1
значений. Таким образом, магнитное
квантовое число ml определяет проекцию
момента импульса электрона на заданное
направление,причем
вектор момента импульса электрона в
атоме может иметь в пространстве 2l+1
ориентации.
т. е. всего 2l+1
значений. Таким образом, магнитное
квантовое число ml определяет проекцию
момента импульса электрона на заданное
направление,причем
вектор момента импульса электрона в
атоме может иметь в пространстве 2l+1
ориентации.
Наличие квантового числа ml должно привести в магнитном поле к расщеплению уровня с главным квантовым числом п на 2l+1 подуровней. Соответственно в спектре атома должно наблюдаться расщепление спектральных линий. Действительно, расщепление энергетических уровней в магнитном поле было обнаружено в 1896 г. голландским физиком П. Зееманом (1865—1945) и получило название эффекта Зеемана. Расщепление уровней энергии во внешнем электрическом поле, тоже доказанное экспериментально, называется эффектом Штарка*.
5. Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона и пространстве, в котором он находится.
Состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами:
1. основное квантовое число n (n = 1, 2 ...).
2. Орбитальное (азимутальное) квантовое число l (l = 0, 1, 2, ... n-1).
3. Магнитное квантовое число m (m = 0, +/-1, +/-2, +/-... +/-l).
4. Спиновое квантовое число ms (ms = +/-1/2 ).
Для одного фиксированного значения главенствующего квантового числа n существует 2n2 разных квантовых состояний электрона.
Один из законов квантовой механики, называемый принципом Паули, утверждает:
В одном и том же атоме не может быть двух электронов, владеющих одинаковым набором квантовых чисел, (т.Е. Не может быть двух электронов в одинаковом состоянии).
6. Простейший из атомов, атом водорода явился своеобразным тест-объектом для теории Бора. Ко времени создания теории он был хорошо изучен экспериментально. Было известно, что он содержит единственный электрон. Ядром атома является протон – положительно заряженная частица, заряд которой равен по модулю заряду электрона, а масса в 1836 раз превышает массу электрона. Еще в начале XIX века были открыты дискретные спектральные линии в видимой области излучения атома водорода (так называемый линейчатый спектр). Впоследствии закономерности, которым подчиняются длины волн (или частоты) линейчатого спектра, были хорошо изучены количественно (И. Бальмер, 1885 г.). Совокупность спектральных линий атома водорода в видимой части спектра была названа серией Бальмера. Позже аналогичные серии спектральных линий были обнаружены в ультрафиолетовой и инфракрасной частях спектра. В 1890 году И. Ридберг получил эмпирическую формулу для частот спектральных линий:
|
Для
серии Бальмера m = 2, n = 3, 4, 5, ... .
Для ультрафиолетовой серии (серия
Лаймана) m = 1, n = 2, 3, 4, ... .
Постоянная R в
этой формуле называется постоянной
Ридберга.
Ее численное значение R = 3,29·1015 Гц.
До Бора механизм возникновения линейчатых
спектров и смысл целых чисел, входящих
в формулы спектральных линий водорода
(и ряда других атомов), оставались
непонятными.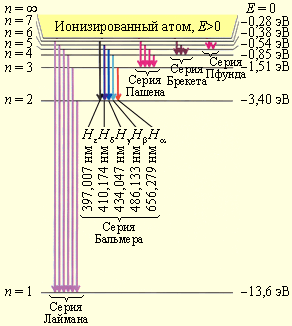
Правила отбора – правила, которые на основе законов сохранения квантовых чисел устанавливают допустимые процессы с участием микросистем (молекул, атомов, ядер, элементарных частиц). Любая микросистема характеризуется определённым набором квантовых чисел. В изолированном состоянии эти квантовые числа у микросистемы остаются неизменными, поскольку являются проявлением соответствующих законов сохранения. Так электрический заряд или полный угловой момент (момент количества движения) изолированной системы не изменяются, так как существуют законы сохранения электрического заряда и углового момента. Рассмотрим примеры.
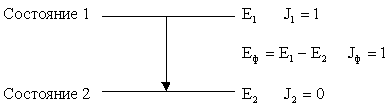
Пусть атом находится в одном из своих дискретных состояний с энергией Е1 и угловым моментом J1 = 1 (в единицах ). В атоме есть другое состояние с энергией Е2 < Е1 и J2 = 0. Атом может перейти из состояния 1 в состояние 2, испустив фотон с энергией Еф = Е1 – Е2 (отдачей атома пренебрегаем). Каков будет угловой момент фотона Jф? Полный угловой момент с учётом того, что это вектор должен сохраняться, т.е. 1 = 2 + ф или = + ф. Откуда Jф = 1. Фотон с таким угловым моментом называют дипольным. Таким образом, правила отбора допускают излучение в рассмотренном процессе лишь дипольного фотона.
Другой пример относится к нуклонам – протону и нейтрону. В свободном состоянии протон стабилен, а нейтрон распадается: n p + e- + e, где e- - электрон, а e - электронное антинейтрино и только этот сценарий распада допустим правилами отбора.
n p + e- + e
B 1 = 1 +0 +0
Q 0 = 1 -1 +0
Le 0 = 0 +1 -1
Нейтрон и протон – барионы и наделены барионным числом В = + 1. e- и e - лептоны и наделены лептонным числом Lе (+ 1 для e- и –1 для e). Барионное и лептонное числа сохраняются. Кроме того, масса нейтрона больше суммарной массы конечных частиц. Вышеприведённый распад нейтрона – единственный его распад, допустимый законом сохранения энергии и правилами отбора, требующими сохранения электрического заряда, барионного и лептонного квантовых чисел.