
- •Химия как раздел естествознания.
- •Значение химии для народного хозяйства. Понятие о материи и веществе.
- •Основное содержание атомно-молекулярного учения. Простое вещество и химический элемент.
- •Атом. Молекула. Ион.
- •Законы стехиометрии. Закон сохранения массы веществ.
- •Важнейшие классы и номенклатура неорганических веществ.
- •Ядерная модель строения атома. Квантово-механические представления о строении атома.
- •Квантовые числа.
- •Формы электронных облаков. Атомная электронная орбиталь.
- •Энергия связи. Дефект массы.
- •Периодический закон. Порядковый номер элемента.
- •«Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
- •Размеры атомов и ионов. Энергия ионизации.
- •Сродство к электрону. Электроотрицательность.
- •Типы химической связи.
- •Метод валентных связей.
- •Гибридизация атомных электронных орбиталей.
- •1877 Году Людвиг Больцман установил связь энтропии с вероятностью данного состояния. Позднее эту связь представил в виде формулы Макс Планк:
- •Основные понятия термохимии.
- •Термодинамические функции: внутренняя энергия, энтальпия.
- •Энергия Гиббса. Направленность химических процессов.
- •Скорость химических реакций в гетерогенных и гомогенных системах.
- •Зависимость скорости реакции от концентрации реагирующих веществ.
- •Зависимость скорости реакции от природы реагирующих веществ и температуры.
- •Энергия активации. Активированный комплекс.
- •Катализ. Гомогенный и гетерогенный катализ.
- •Факторы, определяющие направление протекания химических реакций.
- •Смещение химического равновесия. Принцип Ле Шателье.
- •Закон распределения. Экстракция.
- •Экстракция растворителем
- •Осмос. Закон Вант-Гоффа.
- •Давление пара растворов. Закон Рауля.
- •Составление уравнений окислительно-востановительных реакций.
- •Электрохимические процессы. Гальванический элемент Якоби-Даниэля.
- •Электронные потенциалы. Уравнение Нернста. Стандартный электродный потенциал.
- •Водородный электрод. Измерение электродных потенциалов.
- •Электролиз. Реакции на катоде и аноде при электролизе.
- •Законы Фарадея. Применение электролиза.
- •1.2. По механизму реакций взаимодействия металла со средой (химическая и электрохимическая коррозия).
- •1.3. По типу коррозионной среды
- •1.4.По характеру дополнительных воздействий
Составление уравнений окислительно-востановительных реакций.
Составление уравнения реакции меди с раствором нитрата палладия (II). Запишем формулы исходных и конечных веществ реакции и покажем изменения степеней окисления:
![]()
Медь, образуя ион меди, отдает два электрона, ее степень окисления повышается от 0 до +2. Медь - восстановитель. Ион палладия, присоединяя два электрона, изменяет степень окисления от +2 до 0. Нитрат палладия (II) -окислитель. Эти изменения можно выразить электронными уравнениями
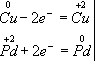
из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение реакции:
Cu + Pd(NO3)2 = Cu(NO3)2 + Pd
Как видно, в суммарном уравнении реакции электроны не фигурируют.
Чтобы проверить правильность составленного уравнения, подсчитываем число атомов каждого элемента в его правой и левой частях. Например, в правой части 6 атомов кислорода, в левой также 6 атомов; палладия 1 и 1; меди тоже 1 и 1. Значит, уравнение составлено правильно.
Переписываем это уравнение в ионной форме:
Cu + Pd2+ + 2NO3- = Cu2+ + 2NO3- + Рd
И после сокращения одинаковых ионов получим
Cu + Pd2+ = Cu2+ + Pd
Электрохимические процессы. Гальванический элемент Якоби-Даниэля.
Химические окислительно-восстановительные процессы, которые сопровождаются возникновением электрического тока, или сами называются им, называют электрохимическими.
Гальванический элемент - это устройство, в котором на основе окислительно-восстановительных реакций получают электрический ток, т.е. химическая энергия реакции превращается в энергию электрического тока.
Максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции называется электродвижущей силой данного элемента.
Электрод, на котором протекает процесс восстановления, называется катодом.
Причиной возникновения электрического тока в гальваническом элементе является разность потенциалов, возникающих на металлических электродах, которую называют разностью электродных потенциалов.
Электронные потенциалы. Уравнение Нернста. Стандартный электродный потенциал.
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: большой отрицательный потенциал означает, что данная форма является сильным восстановителем. Например, F2 имеет 2,87 В, а Li+ имеет −3,05 В, фтор — окислитель, литий — восстановитель. Таким образом, Zn2+, стандартный восстановительный потенциал которого равен −0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше −0,76 В. (напр., H+(0 В), Cu2+(0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше −0,76 В (напр., H−(−2,23 В), Na+(−2,71 В), Li+(−3,05 В)).
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия Гиббса ΔGo должна быть отрицательной, в соответствии со следующим уравнением:
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
![]()
