
 Содержание
Содержание
1 Аннотация……………………………………………………………………………………..3
2 Введение……………………………………………………………………………………….4
3 Требования к стартерному аккумулятору…………………………………………………...5
4 Выбор конструкции и способа изготовления электродов………………………………….6
5 Теория выбранного способа………………………………………………………………….8
6 Выбор и описание стадий технологического процесса………………………………........22
7 Выбор и описание основного оборудования……………………………………………….29
8 Конструкционный расчёт положительного электрода…………………………………….34
9 Материальный расчёт положительного электрода………………………………………...43
10 Энергетический расчёт……………………………………………………………………..45
11 Список литературы………………………………………………………………………...48
 1
Аннотация
1
Аннотация
В данной работе описана теория и технология изготовления положительного электрода свинцового аккумулятора. Описаны процессы, протекающие на положительном и отрицательном электродах в аккумуляторе при заряде, разряде и хранении. Произведен выбор стадий технологического процесса получения положительных пластин и выбор типа электродов. Произведен конструктивный, материальные и энергетические расчеты положительного электрода свинцово-кислотной стартерной батареи 6СТ-190.
2 Введение
За период, прошедший с момента создания (1859 г.), свинцовые аккумуляторы и батареи стали массовыми химическими источниками тока. Обладая сравнительно высокой удельной мощностью в сочетании с надежностью и относительно низкой стоимостью, эти аккумуляторы находят разнообразное практическое применение. Своей популярностью и широким масштабом производства они обязаны стартерным батареям. В этой области их монопольное положение устойчиво [1].
 Сохранение
столь высокого удельного веса производства
свинцовых аккумуляторов обусловлено
не столько принципиальной невозможностью
их замены другими типами аккумуляторов,
сколько существенными достижениями за
последние 10—15 лет в их развитии. В
результате фундаментальных исследований,
стало возможным заметное увеличение
удельной (весовой и объемной) энергии
и мощности, срока службы, снижение
саморазряда и скорости газовыделения,
расширение температурного диапазона
работоспособности свинцовых аккумуляторов.
В
первую очередь следует отметить усиленное
развитие теории свинцового аккумулятора,
особенно таких разделов, как термодинамика,
теория пористых электродов, процессы
анодного поведения свинца и его
сплавов в серной кислоте, влияние
поверхностно-активных веществ (ПАВ) на
окислительно-восстановительные процессы
на свинцовом электроде.
Сохранение
столь высокого удельного веса производства
свинцовых аккумуляторов обусловлено
не столько принципиальной невозможностью
их замены другими типами аккумуляторов,
сколько существенными достижениями за
последние 10—15 лет в их развитии. В
результате фундаментальных исследований,
стало возможным заметное увеличение
удельной (весовой и объемной) энергии
и мощности, срока службы, снижение
саморазряда и скорости газовыделения,
расширение температурного диапазона
работоспособности свинцовых аккумуляторов.
В
первую очередь следует отметить усиленное
развитие теории свинцового аккумулятора,
особенно таких разделов, как термодинамика,
теория пористых электродов, процессы
анодного поведения свинца и его
сплавов в серной кислоте, влияние
поверхностно-активных веществ (ПАВ) на
окислительно-восстановительные процессы
на свинцовом электроде.
К наибольшим достижениям в области конструирования свинцовых аккумуляторов следует отнести замену межэлементных соединений на крышках аккумуляторов на соединения через стенки моноблоков в батарее, а также попытки создания основ проектирования аккумуляторов вообще. Замена межэлементных соединений на соединения внутри стенок моноблоков привели к экономии свинца (2 % на батарею), уменьшению омических потерь напряжения на стартерных режимах, т. е увеличению мощности и энергии аккумуляторов. [2].
3 Требования предъявляемые к стартерным аккумуляторным батареям
 Типы
и обозначения. Стартерные аккумуляторные
батареи предназначены для пуска
двигателей и питания электрического
оборудования автомобилей, автобусов,
тракторов, катеров и других машин. В
нашей стране стартерные АБ выпускаются
в соответствии с ГОСТ 959-2002.
Типы
и обозначения. Стартерные аккумуляторные
батареи предназначены для пуска
двигателей и питания электрического
оборудования автомобилей, автобусов,
тракторов, катеров и других машин. В
нашей стране стартерные АБ выпускаются
в соответствии с ГОСТ 959-2002.
Батареи классифицируют[1]:
по основным параметрам (по номинальному напряжению: на 6- и 12-вольтовые и номинальной емкости);
по конструктивно-функциональному признаку:
батареи обычной конструкции (в моноблоке с ячеечными крышками и перемычками над крышками);
батареи с общей крышкой (в моноблоке с общей крышкой и перемычками под крышкой);
батареи необслуживаемые (батареи с общей крышкой, не требующие ухода в процессе эксплуатации) — залитые электролитом и полностью заряженные или сухозаряженные. [1].
X X X X X
Батарея
Количество последовательно
соединенных аккумуляторов
в батарее (3 и 6)
Назначение батарей по
функциональному
признаку (СТ — стартерная)
Номинальная емкость (А • ч)
Исполнение:
А — с общей крышкой
Материал сосуда: Э — эбонит;
Т — термопласт.
Тип сепаратора: М — мипласт;
Р — мипор, П-полиэтилен
6 СТ-190 ТП — батарея для колесных и гусеничных машин многоцелевого назначения емкостью 190 А • ч с в качестве сепаратора конверт из полиэтилена в моноблоках из термопласта.
 Общими
требованиями для стартерных батарей
различной емкости, назначения и
габаритов являются следующие[1].
Общими
требованиями для стартерных батарей
различной емкости, назначения и
габаритов являются следующие[1].
Батареи выдерживают испытания при повышенном или пониженном давлении по сравнению с атмосферным давлением на (20,0 ± ± 1,3) кПа. Конструкция АБ обеспечивает невыливаемость электролита при наклонах на угол 45°. Батареи являются стойкими к внешним воздействующим факторам, поэтому изготавливаются в климатических исполнениях УХЛ или ТУ категорий размещения 2 поГОСТ 15150-69*. При этом температура окружающего воздуха при эксплуатации должна быть от -50 до +60 °С для вида УХЛ, а для ТУ — от -40 до +60 °С. При изменении температур в указанных пределах сохраняется герметичность батареи.
Батареи являются механически прочными при испытании по I степени жесткости в следующем режиме:
ускорение— 147 м/с2 (15 g);
длительность импульсов — 2—15 мс (только в вертикальном положении);
число ударов — 10 тыс.;
ориентировочное число ударов в минуту 40—80.
Переносные устройства (места крепления и ручки) выдерживают нагрузку, равную двукратной массе батарей с электролитом. Батареи являются вибропрочными при кратковременном испытании по IV степени жесткости при ускорении 3 g (для легковых автомобилей) и 5 g (для грузовых автомобилей и тракторов) в диапазоне частот от 20 до 30, Гц. При этом батареи подвергаются вертикальной, синусоидальной вибрации.
3.1 Конструкция стартерных АКБ
Батареи состоят из последовательно соединенных между собой секций аккумуляторов. Номинальное напряжение каждого аккумулятора составляет 2В. Обычно аккумуляторы состоят из трех ( общее напряжение батареи 6В ) и шести аккумуляторов(общее напряжение 12В) [1].
Батареи обычно собираются в пластмассовом сосуде– моноблоке обычно из полипропилена. Материалом моноблока может служить также эбонит, полистирол, полиэтилен. Пластина каждой полярности состоит из активной массы и решетки, которая служит токоотводом и удерживает активную массу. Положительные пластины имеют темно-коричневый цвет ( двуокись свинца), отрицательные (губчатый свинец) темно-серый цвет. В аккумуляторах применяются два вида электродов: поверхностные и пастированные.
Поверхностный электрод состоит из
свинцовой пластины, на поверхности
которой электрохимическим способом
формируется слой активной массы.
Пастированные электроды  подразделяются
на решетчатые(намазные), коробчатые и
панцирные. В коробчатых пластинах
решетки с активной массой закрываются
с двух сторон перфорированными свинцовыми
листами. Панцирные пластины состоят из
свинцово-сурьмяных штырей, которые
помещаются внутри пластмассовых
перфорированных трубок, заполненных
активной массой. Намазные пластины
состоят из решеток, отлитых из различных
свинцовых сплавов и из пасты, которая
изготавливается из свинцового порошка,
серной кислоты и добавок.
подразделяются
на решетчатые(намазные), коробчатые и
панцирные. В коробчатых пластинах
решетки с активной массой закрываются
с двух сторон перфорированными свинцовыми
листами. Панцирные пластины состоят из
свинцово-сурьмяных штырей, которые
помещаются внутри пластмассовых
перфорированных трубок, заполненных
активной массой. Намазные пластины
состоят из решеток, отлитых из различных
свинцовых сплавов и из пасты, которая
изготавливается из свинцового порошка,
серной кислоты и добавок.
Сепараторы служат для предотвращения замыкания разноименных пластин и представляют собой тонкие листы из пористого кислотостойкого материала. В качестве сепараторов применяется: мипор, поливинилхлорид ( мипласт), стекловолокна.
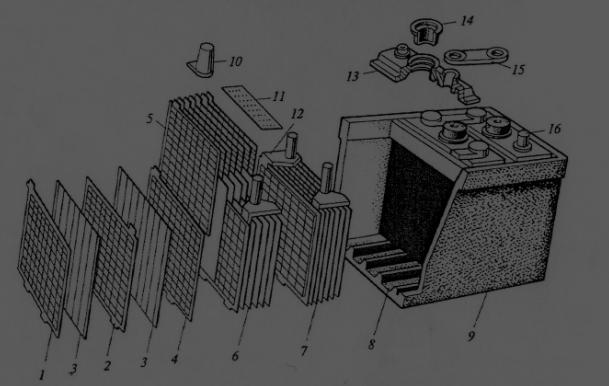
Рисунок 1 – Схема устройства стартерном аккумуляторной батареи[1]:
1 — электрод отрицательный крайний; 2—электрод положительный; 3 — сепаратор; 4 — электрод отрицательный; 5—полублок электродов отрицательных; 6—полублок электродов положительных; 7—блок электродов; 8—опорная призма; 9—моноблок; 10— борн; 11 — щиток предохранительный; 12— мостик; 13 — крышка аккумулятора; 14— пробка вентиляционная; 15— межэлементные соединения; 16— полюсный вывод
Средний срок службы стартерных АБ зависит от их конструктивного исполнения. Для обычных батарей он составляет не менее 12 мес при наработке транспортного средства в пределах этого срока не более 150 тыс. км пробега или 24 мес при наработке не более 90 тыс. км пробега или 3000 мото-часов. Для необслуживаемых батарей средний срок службы составляет не менее 48 мес при наработке транспортного средства не более 100 тыс. км пробега или 4000 мото-часов. [1].
 4
Теория свинцового аккумулятора
4
Теория свинцового аккумулятора
Свинцовые аккумуляторы, в принципе, состоят из следующих основных частей: положительных пластин из диоксида свинца, нанесенного на решетки-токоотводы из свинцово-сурьмяного сплава, отрицательных пластин из свинцовой губки, также нанесенной на токоотводы-решетки, электролита—раствора серной кислоты, сепараторов — микропористых изоляторов, разделяющих положительные и отрицательные пластины, и сосудов с крышками.
Действие свинцовых аккумуляторов основано на реакциях:
(+) PbO2 + HSO4- + 3H+ = PbSO4 + 2H2O – 2e (1)
Потенциал отвечающий данному равновесию равен
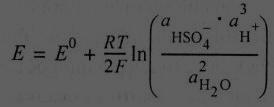 (2)
(2)
(- ) Pb + HSO4 - = PbSO4 + H+ + 2e (3)
Потенциал отвечающий равновесию равен
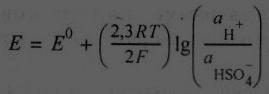 (4)
(4)
При разряде аккумуляторов процессы идут слева направо, при заряде — наоборот.
Основная токообразующая реакция выражается реакцией:
разряд
PbO2 + Pb + 2 H2SO4 = 2PbSO4 + 2H2O (5) заряд
Стандартный потенциал свинцового электрода по отношению к водородному электроду равен E0=-0,356B, диоксидносвинцового E0=1,685B.
Электродвижущая сила (ЭДС) аккумулятора, т. е. разность его потенциалов в отсутствие протекания тока во внешней цепи в зависимости от концентрации серной кислоты в электролите, равна
ЭДС=Eрк-Eра=2,041+2,3*R*T/F*lg(aH+2/aH2o) (6)
Поскольку серная кислота при разряде расходуется как на положительном, так и на
 отрицательном
электродах, то описанные процессы в
аккумуляторах называют теорией двойной
сульфатации, согласно которой при
разряде активные вещества на обоих
электродах превращаются в сульфат
свинца. Теоретически на 1 А-ч получаемого
в аккумуляторах количества электричества
требуется 3,66 г Н2S04;
4,46 г Рb02
и 3,86 г Рb
[7].
отрицательном
электродах, то описанные процессы в
аккумуляторах называют теорией двойной
сульфатации, согласно которой при
разряде активные вещества на обоих
электродах превращаются в сульфат
свинца. Теоретически на 1 А-ч получаемого
в аккумуляторах количества электричества
требуется 3,66 г Н2S04;
4,46 г Рb02
и 3,86 г Рb
[7].
Процесс разряда. Механизм процессов, протекающих на аккумуляторных электродах при разряде и заряде, сложен и к настоящему времени изучен недостаточно. Обсуждается возможность параллельного протекания реакций в растворе и в твердой фазе, причем соотношение скоростей этих реакций во многом зависит от условий поляризации [7].
При работе отрицательного электрода преимущество имеют жидкофазные процессы, проходящие по механизму «растворение — осаждение». Начальной стадией разряда свинцового электрода в сернокислотном электролите является ионизация свинца РbРb(II). При этом, наряду с ионами Рb2+ образуются растворимые комплексы двухвалентного свинца. Ток обмена равновесия РbРb(П) весьма велик, достигая 0,8 А/см2, но при наличии пассивирующего сульфатного слоя в сернокислом растворе величина i0 падает до 0,4-10-5 А/см2 [8]. Последующая стадия разряда — кристаллизация на электроде сульфата свинца, начинающаяся после достижения значительного пересыщения приэлектродного слоя. Этот процесс, как и растворение PbS04, является реакцией первого порядка и характеризуется скоростью Vкр=6*10-5 см/с (20 °С).
Снижение температуры вызывает рост удельного количества кристаллических зародышей PbS04 на поверхности электрода и, как следствие, уменьшение пористости, что ведет к ускоренной пассивации электрода [5].
Зарядно-разрядные процессы, протекающие на положительном электроде, могут протекать как в растворе, так и в твёрдой фазе. В первом случае предполагается, что электродная реакция происходит на границе раздела электрод-электролит, где при разряде имеет место восстановление Рbтв4+Рbр-р2+ с одновременным переходом восстановленных ионов свинца в раствор.
В результате ионизации электролита образуются положительные ионы H+ и отрицательные ионы S042-. Последующей стадией является образование PbS04 в результате взаимодействия ионов Рb2+ с ионами сульфата [8].
Наиболее распространён твёрдофазный механизм разрядного процесса. В процессе катодного восстановления (разряда) диоксид свинца РbОn (1,9<n<2,1) постепенно снижает
степень окисления в результате удаления кислорода из кристаллической решетки [8].
Процессы, протекающие в фазе двуокиси свинца при разряде, могут быть описаны уравнениями реакций:
PbO2 + 2(2-n)e PbOn + (2-n)O2- ; (7)
PbO2 + (2-n) H+ + 2(2-n)e PbOn + (2-n)OH- ; (8)
или
PbO2 + 2(2-n) H+ + 2(2-n)e PbOn + (2-n) H2O (9)
где n<2 – степень окисленности промежуточного окисла. Эти реакции представляют собой совокупность ряда последовательных стадий снижения степени окисленности исходного соединения [8].
Исследования последних лет показали вероятность промежуточного образования трехосновного сульфата свинца ЗРbО* PbS04* H2O. Таким образом, разрядный процесс на диоксидносвинцовом электроде может быть представлен схемой [7]
P

 bOn
→ PbOn-3
→
3PbO
· PbSO4
·
H2O
→ PbSO4
(10)
bOn
→ PbOn-3
→
3PbO
· PbSO4
·
H2O
→ PbSO4
(10)
Разряд кислотных аккумуляторов в зависимости от их назначения может производиться различными токами. Нормальным разрядным током для аккумуляторов является ток 10-часового режима. Разрядная кривая имеет три характерных участка (рисунок 1). В начале разряда наблюдается довольно резкое снижение напряжения, в дальнейшем напряжение уменьшается плавно вплоть до самого конца разряда, где оно вновь резко падает.
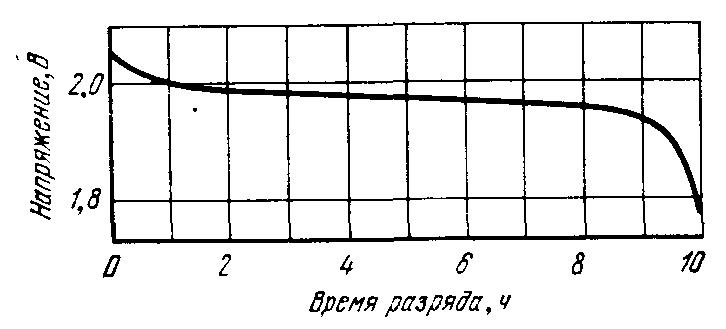
Рисунок 1 - Типичная разрядная кривая свинцового аккумулятора при 10-часовом режиме
Резкое падение напряжения, наблюдаемое после подключения нагрузки, объясняется быстрым уменьшением концентрации электролита в порах активных веществ.
 В дальнейшем напряжение изменяется
медленнее в результате того, что
концентрация серной кислоты в порах
активных веществ пополняется за счет
диффузии более концентрированного
раствора электролита из глубины
межэлектродного пространства.
Более резкое падение напряжения в конце
разряда является следствием ухудшения
условий диффузии электролита в глубь
пор из-за сужения сечения пор образовавшимся
сульфатом свинца. Этому способствует
то обстоятельство, что плотность сульфата
свинца значительно меньше плотности
двуокиси свинца. На всех трех участках
разряда протекает основная токообразующая
реакция.
В дальнейшем напряжение изменяется
медленнее в результате того, что
концентрация серной кислоты в порах
активных веществ пополняется за счет
диффузии более концентрированного
раствора электролита из глубины
межэлектродного пространства.
Более резкое падение напряжения в конце
разряда является следствием ухудшения
условий диффузии электролита в глубь
пор из-за сужения сечения пор образовавшимся
сульфатом свинца. Этому способствует
то обстоятельство, что плотность сульфата
свинца значительно меньше плотности
двуокиси свинца. На всех трех участках
разряда протекает основная токообразующая
реакция.
С увеличением разрядного тока разрядная кривая кислотного аккумулятора смещается в сторону меньших напряжений, а его емкость уменьшается. Это объясняется, во-первых, увеличением концентрационной и химической поляризаций, во-вторых, возрастанием величины падения напряжения на внутреннем сопротивлении, в-третьих, изменением структуры сульфата свинца. Последняя становится более плотной и как бы изолирует внутренние слои активных масс от участия в электрохимическом процессе.
Наблюдаемое при разряде разбавление кислоты способствует повышению сопротивления аккумулятора, что также снижает его напряжение. Практически разряд прекращается при снижении напряжения аккумулятора обычно до 1,7÷1,8В при нормальном режиме.
Процесс заряда. При заряде отрицательного электрода свинцового аккумулятора начальная стадия — растворение сульфата свинца протекает со скоростью, равной примерно Vкр=6*10-5 см/с . Последующая стадия — электровосстановление ионов Рb (II).
Энергия активации процесса восстановления PbS04Рb составляет 8 – 22 ккал/моль и снижается с ростом плотности тока процесса. Эти величины свидетельствуют о том, что поляризация процесса, протекающего при заряде отрицательного электрода, имеет, в основном, химический (активационный) характер. При высоких плотностях тока сказываются диффузионные ограничения, обусловленные замедленностью переноса реагирующего вещества к поверхности электрода. Наряду с ионами Рb2+ в растворе могут присутствовать ионы Pb(S04)22-, а также ионные пары Pb - S04. Не исключена возможность участия этих образований в зарядно-разрядном процессе [8].
Механизм заряда положительного электрода изучен недостаточно. Можно полагать, что в процессе заряда имеет место анодное окисление ионов Рb2+ на поверхности электрода с последующим образованием кристаллической решетки диоксида свинца. Сульфат свинца переходит в раствор и ионизируется. Вода также ионизируется.
 Двухвалентные
ионы свинца Рb2+
под действием
зарядного тока отдают два электрона и
переходят в четырехвалентное состояние
Рb4+
. Каждый из этих
ионов соединяется с двумя кислородными
ионами и образует двуокись свинца PbO2.
Ионы сульфата S042-
соединяются с двумя водородными
ионами, образуя серную кислоту. Наличие
ионов Рb2+
в растворе определяется конечной
растворимостью PbS04
[7].
Двухвалентные
ионы свинца Рb2+
под действием
зарядного тока отдают два электрона и
переходят в четырехвалентное состояние
Рb4+
. Каждый из этих
ионов соединяется с двумя кислородными
ионами и образует двуокись свинца PbO2.
Ионы сульфата S042-
соединяются с двумя водородными
ионами, образуя серную кислоту. Наличие
ионов Рb2+
в растворе определяется конечной
растворимостью PbS04
[7].
При заряде возможно протекание анодной реакции по твердофазному механизму с промежуточным возникновением малоокисленных оксидов свинца
PbS04 + nН2О → РЬОn + ( 2n − 1 ) + HSO4- 2 ( n − 1 ) e- (11)
которые в процессе заряда повышают степень окисления. Содержание кислорода в активной массе заряженного положительного электрода зависит от условий проведения заряда и особенно от конечного зарядного потенциала [8].
Нормальным зарядным током для большинства кислотных аккумуляторов является ток 10-часового режима. Типичная зарядная кривая кислотного аккумулятора для 10- часового режима изображена на рисунке 2
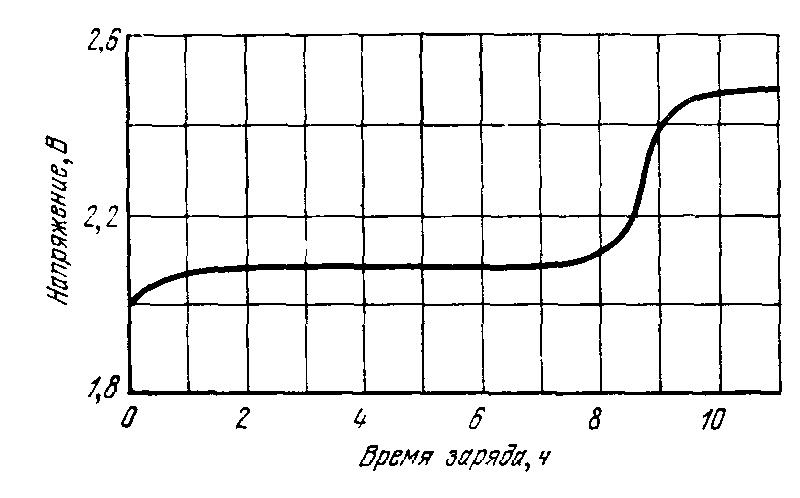
Рисунок 2 - Типичная зарядная кривая свинцового аккумулятора при 10-часовом режиме
Резкое повышение зарядного напряжения, наблюдаемое в начале заряда, происходит вследствие резкого увеличения концентрации электролита в порах активных масс. В дальнейшем напряжение возрастает медленнее, так как более концентрированная серная кислота диффундирует из пор активных веществ в межэлектродное пространство.
К десятому часу заряда еще
более резкое, чем вначале, увеличение
напряжения также связано с повышением
концентрации серной кислоты в порах
активных веществ,  происходящее
в результате затруднения диффузии,
образовавшейся в глубине пор серной
кислоты, в межэлектродное пространство.
происходящее
в результате затруднения диффузии,
образовавшейся в глубине пор серной
кислоты, в межэлектродное пространство.
При снижении силы зарядного тока увеличивается коэффициент использования тока, снижается разогрев электролита, но увеличивается время заряда аккумулятора.
Повышение силы зарядного тока приводит к росту суммарного внутреннего сопротивления батареи и увеличению потерь энергии на нагрев участков зарядной цепи (электролит, электроды, мостики и сепараторы). На всех трех участках протекает основной процесс заряда по реакции 5.
В процессе заряда плотность электролита должна повышаться из-за образования серной кислоты. В процессе заряда на второй ступени зарядной кривой наряду с протеканием основной реакции происходит электролиз воды с выделением на положительном электроде кислорода, а на отрицательном — водорода. Этот процесс может идти до полного «выкипания» электролита. Именно он и обеспечивает постоянство напряжения (около 2,5 В) в конце заряда.
Хотя с энергетической стороны процесс разложения воды является нежелательным, однако с эксплуатационной точки зрения, если он разумно ограничен временем, является положительным, т.к., во-первых, служит одним из признаков окончания заряда и, во-вторых, способствует перемешиванию электролита. Последнее весьма важно, так как имеющее место при разряде аккумулятора расслоение электролита из-за неравномерной нагрузки на отдельные части пластин приводит к образованию короткозамкнутых концентрационных пар, увеличивающих саморазряд электродов.
4.1 Коррозия токоотводов положительных электродов.
Коррозионное разрушение токоотводов положительных электродов ограничивает срок службы свинцовых аккумуляторов. Применение более тонких электродов в современных конструкциях аккумуляторов в еще большей мере обострило проблему повышения коррозионной стойкости материалов токоотводов.
Главной причиной коррозионного разрушения токоотводов является, как известно, термодинамическая неустойчивость свинца и его сплавов в условиях работы положительных электродов, когда свинец стремится перейти в соединения с различной степенью окисления.
 Существует
несколько точек зрения на механизм
анодной коррозии свинца. При слабой
анодной поляризации образуется сульфат
свинца по реакции[1]:
Существует
несколько точек зрения на механизм
анодной коррозии свинца. При слабой
анодной поляризации образуется сульфат
свинца по реакции[1]:
Pb + HSO4 - = PbSO4 + H+ + 2e (12)
При более значительных анодных поляризациях становится возможным протекание реакций с образованием оксида свинца[1]:
Pb + H2O = PbO + 2H+ + 2e (13)
Оксиды реагируют с серной кислотой, образуя сульфат свинца. Возможно также появление диоксида свинца по реакции[1]:
Pb + 2H2O = PbO2 + 4H+ + 4e (14)
Вполне понятно, что при значениях потенциала, меньших потенциала равновесия Рb02 PbS04, диоксид свинца термодинамически неустойчив, хотя может существовать некоторое время в качестве промежуточного продукта. Устойчивое существование диоксида свинца становится возможным, когда потенциал электрода превышает значение, отвечающее равновесию[1]:
PbSO4 + 2H2O = PbO2 +HSO4- 3H+ + 2e (15)
Б.Н. Кабанов считал анодную коррозию свинца процессом окисления металла кислородом, выделяющимся на поверхности Рb02. Известно, что кислород частично входит в кристаллическую решетку Рb02 в виде сверхстехиометрических атомов и поэтому диффундирует к поверхности свинца, где может окислять его до РЬО и а-РЬ02.
Исследованиями Д. Павлова, Р. Рютчи, И.А. Агуфа, А.И. Русина, Ю.Б. Каменева показано, что при определенных условиях анодной поляризации возможно образование сульфатов свинца различной основности.
Проведенные И.А. Агуфом и другими специалистами исследования показали, что скорость коррозии свинца, свинцово-сурьмяного сплава убывает с ростом концентрации серной кислоты в широком диапазоне потенциалов. Повышение плотности тока снижает скорость коррозии как при обычной, так и при повышенной температуре.
К числу элементов, замедляющих коррозию, относятся: мышьяк, серебро, медь, кобальт, селен, теллур, таллий[7].
 4.2
Пассивация положительного
электрода
4.2
Пассивация положительного
электрода
При разряде активная масса используется не полностью: при малых плотностях тока коэффициент использования составляет 40-60, при больших-5-10 процентов снижение коэффициента использования при больших токах обусловлено в основном концентрационной поляризацией - резким снижением концентрации серной кислоты в порах положительного электрода. При малых токах преждевременное снижение разрядного напряжения связано с пассивацией электродов. Пассивация вызвана тем, что образующийся при разряде в виде мелкокристаллического слоя сульфат свинца экранирует частички активной массы двуокиси свинца [6].
Склонность к пассивации зависит от модификации двуокиси свинца: α-двуокись свинца имеет меньшую удельную поверхность, чем β-двуокись свинца.
Кристаллические решётки α-двуокиси свинца и PbSO4 изоморфны и при разряде на α-двуокиси образуется плотный слой сульфата, препятствующий дальнейшему развитию поверхности. В связи с этим коэффициент использования α-двуокиси в 1,5-3 раза меньше, чем β-двуокиси. При циклировании α-двуокись постепенно переходит в более устойчивую β-двуокись, что сопровождается некоторым ростом емкости электрода [4].
4.3 «Оплывание» активной массы положительного электрода
«Оплывание» положительной активной массы намазного типа является одной из главных причин, ограничивающих срок службы свинцовых аккумуляторов.С применением более пористой пасты, исключением стеклосепараторов и уменьшением толщины электродов,то есть факторов без которых невозможно дальнейшее увеличение удельной разрядной емкости современных аккумуляторов, еще более острой становится проблема борьбы с этим нежелательным явлением [1].
Прочность активной массы зависит от морфологии частиц, характера их сцепления друг с другом, объемной пористости и других структурных параметров. В процессе работы аккумуляторов при чередующихся зарядах и разрядах вследствие объемных изменений происходят разупрочнение активных масс, потеря механических связей между частицами, в результате чего активная масса разжижается и «оплывает». Этому явлению способствует выделение кислорода на поверхности электродов в процессе зарядов. «Оплывание» активной массы ускоряется при наличии в электролите таких вредных примесей, как железо, хлор и др.
Скорость «оплывания» активной массы положительных электродов зависит и от условий эксплуатации аккумуляторов.
 Известно,
что снижение плотности электролита,
повышение температуры и снижение
плотности тока при разряде заметно
снижают скорость «оплывания». Очень
сильное влияние на скорость «оплывания»
активной массы оказывает сульфат
бария, являющийся составной частью
расширителя отрицательных электродов.
Из практики известно, что попадание
BaS04
в пасту положительного электрода в
небольших количествах способно
привести к быстрому «оплыванию» активной
массы уже через короткое время эксплуатации
аккумуляторов. Поэтому при производстве
аккумуляторов должна быть исключена
возможность попадания BaS04
в пасту положительного электрода[1].
Известно,
что снижение плотности электролита,
повышение температуры и снижение
плотности тока при разряде заметно
снижают скорость «оплывания». Очень
сильное влияние на скорость «оплывания»
активной массы оказывает сульфат
бария, являющийся составной частью
расширителя отрицательных электродов.
Из практики известно, что попадание
BaS04
в пасту положительного электрода в
небольших количествах способно
привести к быстрому «оплыванию» активной
массы уже через короткое время эксплуатации
аккумуляторов. Поэтому при производстве
аккумуляторов должна быть исключена
возможность попадания BaS04
в пасту положительного электрода[1].
Наиболее эффективным методом борьбы с явлением «оплывания» является введение в электродную пасту различного рода связующих веществ.
Их назначение, кроме того, сводится к сокращению технологического брака пластин. К основным требованиям, предъявляемым к связующим веществам, относятся: механическая прочность, стойкость к окислению, влияние на пористость пасты, экономичность, доступность сырьевой базы и др.Известные добавки, используемые зарубежными фирмами и отечественными заводами, можно разделить на три типа: порошки, волокна, суспензии. К порошковым добавкам можно отнести прежде всего порошки фторопластов (марки 4Д, 4Б и др.). В качестве волокнистых связующих используются волокна из полипропилена, перхлорвинила, поли винил хлорида и других полимеров. Полимерные волокна вследствие воздействия капиллярных сил улучшают доступ электролита к внутренним слоям активной массы. Волокна применяются как правило, в виде мелко нарезанных частиц длиной 3—5 мм в количестве до 1 % к массе свинцовых оксидов.
Эффективными связующими добавками являются водные суспензии фторопластов в сочетании с полимерными волокнами. За последние годы все больший интерес проявляется к электропроводящим волокнам, применение которых позволяет не только повысить прочность активных масс, но и сократить процесс формирования пластин и продолжительность заряда аккумуляторов [1].
4.4 Саморазряд
Саморазрядом называют снижение емкости аккумуляторов при разомкнутой внешней цепи, то есть при бездействии. Это явление вызвано окислительно-восстановительными процессами, самопроизвольно протекающими как на отрицательном, так и на положительном электродах.
Саморазряд свинцового аккумулятора в основном определяется скоростью саморастворения свинца по реакции:
Pb + H2SO4 PbSO4 + H2 (16)
На положительном электроде свинцового аккумулятора во время заряда и разряда наблюдается выделение кислорода. Во время заряда газовыделение происходит в результате неполного использования зарядного тока. После окончания заряда в течение некоторого времени происходит постепенное выделение газа, образовавшегося при заряде и задержавшегося в порах активных масс и сепараторов, а также в промежутках между электродами и сепараторами.
 Причиной
газовыделення в период разряда и
бездействия аккумулятора являются
реакции, связанные с процессом саморазряда
аккумулятора. Газовыделение в
бездействующем аккумуляторе приводит
к потере до 2% емкости ежесуточно [8].
Причиной
газовыделення в период разряда и
бездействия аккумулятора являются
реакции, связанные с процессом саморазряда
аккумулятора. Газовыделение в
бездействующем аккумуляторе приводит
к потере до 2% емкости ежесуточно [8].
Основная реакция саморазряда положительного электрода протекает по схеме [1]:
Pb02 + HS04- + Н+ = PbS04 + ½ 02 + Н20 (17)
Это уравнение описывает суммарный процесс, состоящий из двух сопряженных электрохимических реакций[1]:
а) катодной: Рb02 + HS04- + ЗН+ + 2е = PbS04 + 2Н20; (18)
б) анодной: ½ 02 + 2Н+ + 2е = 2Н20. (19)
Скорость саморазряда диоксидно-свинцового электрода определяется перенапряжением выделения кислорода. Относительно низкое кислородное перенапряжение на α-РЬ02 (по сравнению с β-РЬ02) обусловливает повышенную скорость самопроизвольного восстановления этой модификации. Саморазряд β-РЬ02 протекает вдвое медленнее саморазряда α-РЬ02. Учитывая, что в процессе циклирования свинцового аккумулятора происходит постепенное превращение α-РЬ02 в β-РЮ2, саморазряд положительного электрода должен снижаться по мере эксплуатации аккумуляторов[1].
Существенное влияние на скорость саморазряда положительного электрода оказывают примеси в электролите, и в первую очередь железо и хлор. Дж. Вайнел рассматривает «челночный» механизм действия железа — окисление его на положительном электроде и восстановление на отрицательном[1]:
Pb02 + 2FeS04 + 2H2S04 = PbS04 + Fe2(S04)3 + 2H20; (20)
Pb + Fe2(S04)3 = PbS04 + 2FeS04 (21)
Челночный» механизм не предусматривает внедрения железа в активные массы, хотя это явление обнаружено рядом авторов.
При содержании железа в электролите до 100 мг/л анодное поведение положительных электродов подобно их поведению в чистом электролите. При более высоких концентрациях железа заметно снижение перенапряжения выделения кислорода.
Саморазряд батарей в значительной мере зависит от температуры электролита. С понижением температуры саморазряд уменьшается. При температуре ниже 0 °С у новых батарей он практически прекращается. Поэтому хранение батарей рекомендуется в заряженном состоянии при низких температурах (до -30 °С).
4.5 Сульфатация и методы борьбы с ней
Под сульфатацией понимается такое состояние аккумуляторных пластин, когда они не заряжаются при пропускании обычного зарядного тока в течение нормального промежутка времени. Иногда это явление называют в литературе «необратимой сульфатацией», подчеркивая тем самым отличие его от образования сульфата при нормальном разряде. Характерными признаками сульфатации аккумуляторных электродов является повышенное напряжение и обильное газовыделение, наблюдаемые в самом начале заряда [4].
Обычно считается, что причиной сульфатации и связанного с ней снижения емкости является уменьшение растворимости сульфата свинца, вызванное его рекристаллизацией..
Рекристаллизация PbS04, ведущая к укрупнению размеров кристаллов, является следствием стремления поликристаллической системы к уменьшению свободной поверхностной энергии. Этот процесс происходит в результате того, что растворимость мелких кристаллов заметно превышает растворимость крупных, поэтому при благоприятных условиях может иметь место рост отдельных кристаллов PbS04 за счет растворения лежащих поблизости более мелких кристаллов[4].
Б. Н. Кабановым была выдвинута и экспериментально обоснована несколько иная точка зрения на природу сульфатации отрицательного электрода свинцового аккумулятора. По данным этих авторов основной причиной уменьшения скорости растворения сульфата свинца является адсорбция на нем поверхностно-активных веществ, присутствующих в качестве примеси в сернокислом электролите, а также выщелачиваемых из сеператоров, активных масс и других материалов, соприкасающихся с электролитом. Длительная выдержка (в течение 8 месяцев) разряженных отрицательных электродов в растворе H2S04, тщательно очищенном от каких-либо примесей, не вызывала затруднений при последующем заряде, хотя рекристаллизация и укрупнение кристаллов PbS04 имели место.
 Авторы
полагают, что адсорбированные примеси
резко увеличивают перенапряжение
процесса восстановления ионов свинца.
Авторы
полагают, что адсорбированные примеси
резко увеличивают перенапряжение
процесса восстановления ионов свинца.
Известно, что положительный электрод свинцового аккумулятора значительно меньше подвержен сульфатации, чем отрицательный. Это явление объясняется Т. И. Поповой и Б. Н. Кабановым тем, что поверхностно-активные вещества, как правило, окисляются при потенциалах, реализуемых на двуокисносвинцовом электроде, до воды и углекислого газа и не могут, поэтому оказывать заметного отравляющего действия.
Можно выделить следующие основные причины сульфатации[4].
1. Аккумулятор длительное время хранится в разряженном или недозаряженном состоянии. В этом случае в активной массе имеется значительное количество кристаллов PbS04, которые не подвергались электрохимическому восстановлению. Эти кристаллы способны расти и, кроме того, на их гранях может иметь место значительная адсорбция органических частиц.
Систематическое проведение глубоких разрядов до напряжения меньше1,75—1,80В ведет к накоплению в активной массе заметных количеств сульфата свинца, не восстанавливаемого при следующих зарядах.
Систематический неполный заряд аккумулятора приводит к аналогичным последствиям, являясь частой причиной сульфатации. Следует поэтому тщательно контролировать проведение зарядного процесса, особенно в том случае, если заряду предшествовал глубокий разряд аккумулятора.
Повышенная концентрация электролита ведет к ускоренному саморазряду отрицательного электрода, особенно, если аккумулятор хранится после проведения значительного числа зарядно-разрядных циклов, когда поверхность отрицательных пластин содержит большое количество перенесенной с анода сурьмы. В этом случае также возможно накопление в активной массе крупных кристаллов PbS04, содержащих на своей поверхности адсорбированные примеси, что, как было сказано выше, является непосредственной причиной сульфатации.
Хранение аккумуляторов при повышенных температурах способствует ускорению процесса рекристаллизации сульфата свинца, а также саморазряда отрицательного электрода, что благоприятствует сульфатации пластин. Отрицательно сказываются на состояние пластин резкие колебания температуры. Наилучшими условиями для хранения свинцовых аккумуляторов следует считать поэтому пониженные температуры.
Развитию сульфатации способствует систематическое проведение зарядов ускоренным режимом, т. е. относительно высокими плотностями тока.
 Короткие
замыкания способствуют сульфатации
пластин как в результате ускоренного
саморазряда (точнее, протекания разряда
через участки коротких замыканий), так
и вследствие недозаряда аккумулятора,
поскольку часть зарядного тока
расходуется не на проведение зарядного
процесса, а на разогрев аккумулятора.Эффективная
мера предотвращения коротких замыканий
— улучшение качества сепараторов,
применение сепараторных чехлов,
надеваемых на пластины одного знака
заряда.[4].
Короткие
замыкания способствуют сульфатации
пластин как в результате ускоренного
саморазряда (точнее, протекания разряда
через участки коротких замыканий), так
и вследствие недозаряда аккумулятора,
поскольку часть зарядного тока
расходуется не на проведение зарядного
процесса, а на разогрев аккумулятора.Эффективная
мера предотвращения коротких замыканий
— улучшение качества сепараторов,
применение сепараторных чехлов,
надеваемых на пластины одного знака
заряда.[4].
4.6 Электролит
Примеси. Существенное влияние на работоспособность и срок служб батарей оказывает химическая чистота электролита. При наличии примесей металлов увеличивается саморазряд, усиливается коррозия токоотводов, снижается отдаваемая ёмкость и срок службы. Поэтому для приготовления электролита применяется серная кислота согласно ГОСТ 667-73 [9] и дистиллированная вода согласно ГОСТ 6709-72 [10]. Пример допустимого содержания примесей в H2SO4 приведено в таблице 1.
Таблица 1 - Допустимое содержание примесей в H2SO4
Наименование примесей |
% (по массе) |
|
Сорт А |
Сорт Б |
|
Нелетучие остатки |
0,3 |
0,05 |
Марганец |
0,00005 |
0,0001 |
Железо |
0,006 |
0,012 |
Мышьяк |
0,00005 |
0,0001 |
Хлор |
0,0005 |
0,005 |
Окись азота |
0,00005 |
0,0001 |
Температура электролита аккумуляторной батареи определяется температурой окружающего воздуха и несколько возрастает при заряде и разряде. Температура окружающего воздуха определяется климатическим районом и колеблется от –600С до +500С. Рабочая температура электролита не должна превышать 50°С [4].
Повышенная температура электролита затрудняет перевод поверхностного слоя сульфата свинца в двуокись свинца. Повышение температуры снижает газонаполнение пластин вследствие уменьшения поверхностного натяжения, а также уменьшения количества растворённого газа в электролите и поровом пространстве пластин, но уменьшает перенапряжение выделения кислорода на PbO2, что при заряде приводит к увеличению доли тока, идущего на окисление молекул воды [4].
5 Выбор материала и конструкции токоотвода положительного электрода
5.1Выбор материала электрода
Решетки положительного электрода испытывают значительные механические нагрузки. Образующаяся на поверхности решетки окисная пленка оказывает давление на корродирующий металл, вызывая его деформацию. В процессе изготовления пластин (намазка, формировка, разрубка и т. д.) решетки также испытывают механические напряжения. Вследствие этого сплав, предназначенный для изготовления решеток, должен обладать определенной механической прочностью[2].
Добавление мышьяка как к свинцу, так и к свинцово-сурьмяному сплаву в количестве нескольких десятых долей процента повышает предел прочности на разрыв и твердость.
Добавление уже ~0,1% As к сплаву, содержащему 4,5% Sb, делает этот сплав сопоставимым по механическим свойствам с серийным сплавом (6,5% Sb). Это обстоятельство открывает возможность значительного сокращения расхода сурьмы при отливке аккумуляторных решеток[4].
Значительное влияние на прочностные характеристики мышьяковистых сплавов оказывает температурный режим отливки: температура металла tM и формы tф, а также режим охлаждения отливок. При изучении прочности и твердости РЬ— Sb—As-сплавов были было обнаружено, что при охлаждении на воздухе сплавы получаются менее твердыми, чем при закалке в воде, но зато менее подверженными образованию трещин. Оптимальным условием, обеспечивающим достаточно высокую твердость и отсутствие трещин, является некоторый промежуточный тип охлаждения, например обдувка воздухом.
 Температуру
формы при этом желательно поддерживать
равной ~ 150° С. Полученные данные
свидетельствуют о том, что сплавы,
легированные мышьяком, подвержены
более быстрому дисперсионному
твердению, особенно если отливки
подвергаются закалке в воде.
Механические свойства сплавов с 4—6%
сурьмы
и
0,1—0,2% мышьяка сопоставимы с механическими
свойствами сплава, содержащего 7—8% Sb.
Температуру
формы при этом желательно поддерживать
равной ~ 150° С. Полученные данные
свидетельствуют о том, что сплавы,
легированные мышьяком, подвержены
более быстрому дисперсионному
твердению, особенно если отливки
подвергаются закалке в воде.
Механические свойства сплавов с 4—6%
сурьмы
и
0,1—0,2% мышьяка сопоставимы с механическими
свойствами сплава, содержащего 7—8% Sb.
Хрупкость мышьяковистых сплавов и склонность к образованию трещин в отливках может быть существенно уменьшена путем правильного выбора конструкции решетки и литейной формы, а также введением в состав сплава малых примесей, улучшающих литейные свойства этих сплавов.
Согласно литературным данным, добавление малых количеств Сu и Sn к мышьяковистым сплавам способствует получению качественных отливок.
В литературе в течение многих лет обсуждается проблема использования в аккумуляторах решеток из свинцовых сплавов, содержащих кальций. Различными авторами предложены сплавы следующего состава: Pb +(0,01–0,10)% Са; Pb +(0,03–0,1)% Ca+(l–2)% Sn+ (0,01–0,1) % Al; Pb +(0,03–0,1) % Са+(0,1–1) % Ag; Pb+0,2% Са+0,2% Ag+ (0,3–3) % Sn др. Как видно из этих данных, свинцово-кальциевые сплавы исследовались в довольно широком диапазоне изменения концентраций кальция. По совокупности свойств оптимальными считаются сплавы, содержащие 0,06—0,09% Са, а также сплавы, содержащие, наряду с Са (0,03–0,1%), серебро (0,1%)[2].
Свинцово-кальциевые сплавы указанного состава по своим механическим свойствам сопоставимы с обычными свинцово-сурьмяными сплавами: твердость Pb—Са сплавов после отливки и охлаждения на воздухе составляет ~9 кгс/мм2. Применение водяного охлаждения повышает эту характеристику до ~13 кгс/мм2. Коррозионная стойкость кальциевых сплавов оценивается весьма противоречиво, что можно объяснить недостаточным контролем содержания кальция в сплаве. Кроме того, коррозионная стойкость свинцово-кальциевых сплавов связана с образованием интерметаллического соединения РbзСа. Возникновение этого соединения, появляющегося при определенных условиях затвердевания сплава, зависит от температуры и скорости охлаждения [4].Образование высокодисперсного интерметаллида способствует росту коррозионной стойкости сплава.
На основании большого количества опытных данных можно констатировать, что сплавы системы Pb—Са по коррозионной стойкости мало отличаются от обычных аккумуляторных сплавов системы Pb-Sb. Для повышения коррозионной стойкости свинцово-кальциевых сплавов их следует легировать серебром.
Кальциевые сплавы находят некоторое применение в производстве аккумуляторов. Они успешно используются в стационарных батареях, работающих в режиме постоянного подзаряда, в герметичных свинцовых аккумуляторах и в некоторых других случаях, когда первостепенно важным является сохранность заряда во времени, т. е. когда от батарей требуется минимальная скорость саморазряда.
Более широкому применению кальциевых сплавов препятствует сложность работы с ними, обусловленная быстрым выгоранием кальция и трудностью получения отливок с постоянным содержанием кальция.
Для устранения этих затруднений предложен электролитический способ получения Pb—Са-сплавов. По этому методу отливку решеток в литейную форму производят непосредственно из электролизера. Сплав получают на жидком свинцовом катоде.
Перспективным является также способ получения Pb—Са-сплавов в герметических магнитно-динамических печах и отливка решеток в инертной атмосфере, исключающей окисление сплава в процессе литья решеток [4].
Применение свинцово-кальциевых сплавов для токоотвода положительного электрода
сопряжено с некоторыми трудностями[2]:
1 Образование на границе токоотвод - активная масса трудноокисляемого сульфата свинца, затрудняющего зарядный процесс;
2 Ухудшением морфологии двуокиси свинца, что обусловлено исключением из состава электрода сурьмы, положительно влияющей на структуру PbO2. Это снижает ёмкость электрода
Таким образом, сплав низкосурьмянистый ( таблица 1) будет обладать достаточной прочностью, что не маловажно при его использовании в грузовых машинах при постоянных условиях тряски. То есть, этот сплав наилучшим образом подходит для изготовления положительных токоотводов аккумуляторной батареи 6СТ – 190 ТП
Таблица 1. Состав сплава для литья решеток положительных пластин
Химический состав[5]:
Свинец (Pb) |
|
Олово (Sn) |
0.10 – 0.13 % |
Мышьяк (As) |
0.11 – 0.15 % |
Селен (Se) |
0.024 – 0.032 % |
Медь (Cu) |
0.020 – 0.040 % |
Сурьма (Sb) |
1.70 – 1.90 % |
Примеси: |
|
Висмут (Bi) |
не более 0,015 % |
Серебро (Ag) |
не более 0,025 % |
Кадмий (Cd) |
не более 0,0002 % |
Цинк (Zn) |
не более 0,0002 % |
Никель (Ni) |
не более 0,0005 % |
Железо (Fe) |
не более 0,010 % |
Сера (S) |
не более 0,001 % |
Суммарно примесей не более 0,015 % |
Суммарный шлак - не более 2,2 %. |
 5.2
Выбор
конструкции электродов
5.2
Выбор
конструкции электродов
Основные детали свинцовых аккумуляторов—пластины имеют несколько разновидностей, применяемых в зависимости от условий работы, для которых предназначены аккумуляторы.
Положительные пластины бывают: поверхностные, панцирные и намазные (пастированные); отрицательные—коробчатые и намазные (пастированные).
Поверхностные пластины отливают из чистого свинца в виде листов толщиной 10—12 мм с большим числом прорезей, благодаря чему в 8—10 раз увеличивается поверхность соприкосновения свинца с электролитом (рис.1) [6].

Рис. 1 . Свинцовая поверхностная пластина[6].
Электрохимическим путем на поверхности свинца создается слой активного материала—двуокиси свинца. При работе аккумулятора по мере осыпания наружного активного слоя прорабатываются более глубоко лежащие слои свинца.
Значительная толщина обеспечивает поверхностным пластинам длительный срок службы (до 10 лет и более). ГОСТ 825—41 предусматривает три размера поверхностных пластин; Поверхностными эти пластины называют потому, что они работают только за счет своего наружного слоя. Иногда их называют пластинами типа Планте, по имеии изобретателя свинцового аккумулятора французского ученого Гастона Планте (I860 г.), предложившего способ изготовления аккумуляторов путем электрохимической формировки листов свинца в серной кислоте[6].
В панцирных пластинах активную массу (окислы свинца) набивают эбонитовые или пластмассовые панцири.
Чаще всего панцири имеют вид либо отдельных трубок, либо ряда трубок, скрепленных боковыми стенками в одну сплошную пластину. В эбонитовых трубках сделаны прорези шириной 0,2 мм, они пропускают электролит, но хорошо задерживают от оплывания набитую в них активную массу. Внутрь трубок панциря для подвода тока вставлены штыри из свинцово-сурьмяного сплава.В последнее время панцири стали изготовлять из винипластовых трубок. (рис. 3) 6].
Иногда панцири изготовляют из пластмассовой сетки Аккумуляторы с такими панцирями имеют меньшее внутреннее сопротивление, чем с эбонитовыми панцирями с прорезями. Панцирные пластины обеспечивают большой срок службы, однако несколько меньший, чем у поверхностных пластин. Их вес, при той же емкости, почти в 2 раза меньше. Панцирные пластины хорошо переносят тряску.

Рис. 3. Панцирная пластина с винипластовым панцирем [6].
Намазные пластины состоят из решеток, отлитых из различных свинцовых сплавов и из пасты, которая изготавливается из свинцового порошка, серной кислоты и добавок.
Решетки имеют важное назначение - поддерживать равномерное распределение тока по всей массе активного материала. В аккумуляторах, работающих в стартерных режимах разряда, как правило, применяют тонкие пластины. В аккумуляторах, предназначенных для длительной эксплуатации, в которых разряды ведутся с перерывами или же растягиваются на долгие периоды наоборот, применяют более толстые пластины.
Аккумуляторная решетка состоит из рамки, вертикальных и горизонтальных жилок, ушка, служащего для параллельного соединения путем пайки одноименных пластин в элементе, и двух ножек, которыми пластина опирается на призмы аккумуляторных сосудов.
К решеткам предъявляются следующие требования: они должны быть достаточно прочными, обладать минимальным весом при максимальном объеме для пасты и способностью обеспечивать хорошую связь с активной массой.
Материал решетки, особенно для положительного электрода, должен отличаться высокой коррозионной стойкостью.
Профиль ребер и жилок обеспечивает легкое извлечение решетки из литейной формы. Горизонтальные жилки по толщине обычно меньше вертикальных ребер и располагаются в шахматном порядке. Рамка, как правило, намного массивнее жилок Решетка электрода должна обеспечивать равномерное распределение тока по всей массе активных материалов, поэтому имеет форму, близкую к квадратной. Толщина решеток электродов выбирается в зависимости от режимов работы и установленного срока службы аккумуляторной, батареи. Решетки отрицательных электродов имеют меньшую толщину, так как они в меньшей степени подвержены деформации и коррозии. Масса решетки составляет до 40% массы электрода.
Намазные пластины обладают более высокими удельными характеристиками, чем коробчатые, но уступают им по сроку службы. Срок службы намазных положительных пластин не превышает 2—3 лет по времени, а по числу циклов составляет примерно 300—400 зарядов-разрядов[1].
Для стартерных аккумуляторов необходим минимальный вес, механическая прочность, достаточная для того, чтобы выдержать толчки, тряску и вибрацию, плотная укупорка, предохраняющая от разбрызгивания электролита, но допускающая выход газов при заряде.
Такие аккумуляторы собирают из намазных пластин и сборку их осуществляют в баках из эбонита или пластмассы с крышками.
