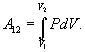- •Принцип независимости действия сил
- •Абсолютно упругий и неупругий удар
- •1)Идеальный газ
- •Классический идеальный газ
- •Квантовый идеальный газ
- •Ферми-газ
- •Бозе-газ
- •Электростатическая индукция в проводниках
- •Электростатическая индукция в диэлектриках
- •Плотность зарядов (линейная поверхностная, объемная)
- •Другие определения
- •[Править]Теплоёмкость для различных состояний вещества
- •[Править]Теория теплоёмкости
- •Майера уравнение
- •Теория теплоёмкости Эйнштейна
- •[Править]Недостатки теории
- •Модель Дебая
- •История
- •Физический смысл адиабатического процесса Работа газа
- •[Править]Внутренняя энергия идеального газа
- •[Править]Адиабатический процесс
- •[Править]Энтропия и обратимость
- •Уравнение Пуассона для идеального газа [править]Адиабата Пуассона
- •[Править]Вывод уравнения
- •Описание цикла Карно
- •[Править]кпд тепловой машины Карно
- •[Править]Связь между обратимостью цикла и кпд
- •Формулировки
- •[Править]Ограничения
- •[Править]Второе начало термодинамики и «тепловая смерть Вселенной»
- •[Править]Энтропия и критика эволюционизма
- •Общее описание
- •[Править]Уравнения Фика
- •[Править]Геометрическое описание уравнения Фика
- •Закон теплопроводности Фурье
- •[Править]Коэффициент теплопроводности вакуума
- •[Править]Связь с электропроводностью
- •[Править]Коэффициент теплопроводности газов
- •[Править]Обобщения закона Фурье
- •Сила вязкого трения
- •[Править]Вторая вязкость
- •[Править]Вязкость газов
- •[Править]Влияние температуры на вязкость газов
- •Вязкость жидкостей [править]Динамический коэффициент вязкости
- •[Править]Кинематическая вязкость
- •[Править]Ньютоновские и неньютоновские жидкости
- •[Править]Вязкость аморфных материалов
- •[Править]Физика реального газа
- •Уравнение состояния
- •Внутренняя энергия газа Ван-дер-Ваальса
- •Критические параметры
- •Приведённые параметры
- •Недостатки уравнения Ван-дер-Ваальса
- •Коэффициент k
- •[Править]Закон Кулона в квантовой механике
- •[Править]Закон Кулона с точки зрения квантовой электродинамики
- •[Править]История
- •[Править]Закон Кулона, принцип суперпозиции и уравнения Максвелла
- •[Править]Cтепень точности закона Кулона
- •[Править]Поправки к закону Кулона в квантовой электродинамике
- •[Править]Закон Кулона и поляризация вакуума
- •[Править]Закон Кулона и сверхтяжелые ядра
- •[Править]Значение закона Кулона в истории науки
- •Лектрический заряд, напряжение, потенциал
- •[Править]Принцип суперпозиции в электродинамике
- •[Править]Примеры нарушения электродинамического принципа суперпозиции
- •[Править]Отсутствие принципа суперпозиции в нелинейных теориях
- •Поток вектора напряженности электрического поля. Теорема Гаусса
- •Теорема Остроградского—Гаусса и ее применение для расчета электростатических полей
- •Равномерно заряженная бесконечная плоскость
- •Бесконечная равномерно заряженная нить
- •Разность потенциалов
- •32 Диэлектрики в электрическом поле. Вектор поляризации. Диэлектрическая восприимчивость вещества. Диэлектрическая проницаемость. Электрическое смещение.
- •Типы поляризации
- •[Править]Зависимость вектора поляризации от внешнего поля [править]в постоянном поле [править]в слабых полях
- •[Править]в сильных полях
- •[Править]в зависящем от времени поле
- •Зависимость от времени
- •[Править]Тензор поляризуемости
- •Практическое применение
- •[Править]Зависимость от частоты
- •Электроемкость. Конденсаторы
- •Проводники электричества
- •Электрические изоляторы
- •Гальванические элементы
- •Закон Ома для неоднородного участка цепи
[Править]Теория теплоёмкости
![]()
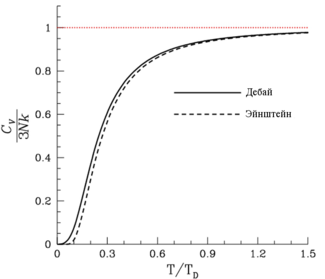
Сравнение моделей Дебая и Эйнштейна для теплоёмкости твёрдого тела
Существует несколько теорий теплоёмкости твердого тела:
Закон Дюлонга — Пти и закон Джоуля — Коппа. Оба закона выведены из классических представлений и с определенной точностью справедливы лишь для нормальных температур (примерно от 15 °C до 100 °C).
Квантовая теория теплоёмкостей Эйнштейна. Первое применение квантовых законов к описанию теплоёмкости.
Квантовая теория теплоёмкостей Дебая. Содержит наиболее полное описание и хорошо согласуется с экспериментом.
Теплоёмкость системы невзаимодействующих частиц (например, газа) определяется числом степеней свободычастиц.
Майера уравнение
МАЙЕРА УРАВНЕНИЕ
-
ур-ние, устанавливающее связь между
теплоёмкостями при пост, давлении Cp и
пост, объёме С V 1
кмоля идеального
газа:![]() где R- газовая
постоянная. Впервые
было получено Ю. P. Майером (J. R. Mayer) в 1842
и ещё до работ Дж. П. Джоуля (J. P. Joule)
использовано им для количеств,
определения механического
эквивалента теплоты. Для
произвольной массы т (кг)
вещества в состоянии идеального газа
M. у. записывается в виде:
где R- газовая
постоянная. Впервые
было получено Ю. P. Майером (J. R. Mayer) в 1842
и ещё до работ Дж. П. Джоуля (J. P. Joule)
использовано им для количеств,
определения механического
эквивалента теплоты. Для
произвольной массы т (кг)
вещества в состоянии идеального газа
M. у. записывается в виде: ![]() ,
где
,
где ![]() -
молекулярная масса газа. M. у. можно
получить из общего
соотношения
-
молекулярная масса газа. M. у. можно
получить из общего
соотношения ![]() (см.Термодинамика), если
учесть, что для идеального газа
справедливо Клапейрона
уравнение.
(см.Термодинамика), если
учесть, что для идеального газа
справедливо Клапейрона
уравнение.
Теория теплоёмкости Эйнштейна
[править]
Материал из Википедии — свободной энциклопедии
Квантовая теория теплоёмкостей Эйнштейна − была создана Эйнштейном в 1907 году, при попытке объяснить экспериментально наблюдаемую зависимость теплоёмкости от температуры.
При разработке теории Эйнштейн опирался на следующие предположения:
Атомы в кристаллической решетке ведут себя как гармонические осцилляторы, не взаимодействующие друг с другом.
Частота колебаний всех осцилляторов одинакова.
Число осцилляторов в 1 моле вещества равно 3Na, где Na - число Авогадро.
Энергия их квантована:
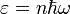 ,
, 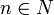
Число осцилляторов с различной энергией определяется распределением Больцмана:
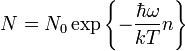
Внутренняя энергия 1 моля вещества:
![]() .
.
![]() находится
из соотношения для среднего значения:
находится
из соотношения для среднего значения:
![]()
и составляет:
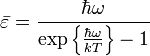 ,
,
отсюда:
 .
.
Определяя теплоёмкость как производную внутренней энергии по температуре, получаем окончательную формулу для теплоёмкости:
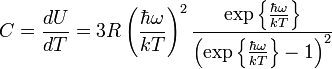 .
.
Согласно модели, предложенной Эйнштейном, при абсолютном нуле температуры теплоёмкость стремится к нулю, при больших температурах, напротив, выполняется закон Дюлонга-Пти.
[Править]Недостатки теории
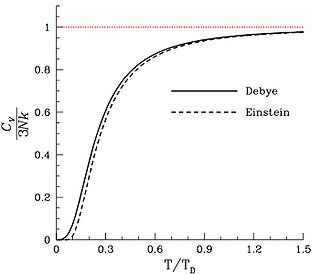
Расхождение теорий Эйнштейна и Дебая
Однако теория Эйнштейна недостаточно хорошо согласуется с результатами экспериментов в силу неточности некоторых предположений Эйнштейна, в частности, предположения о равенстве частот колебаний всех осцилляторов.Более точная теория была создана Дебаем в 1912 году.
Модель Дебая
[править]
Материал из Википедии — свободной энциклопедии
(Перенаправлено с Квантовая теория теплоёмкостей Дебая)
В термодинамике и физике твёрдого тела модель Дебая — метод, развитый Дебаем в 1912 г. для оценки фононного вклада втеплоёмкость твёрдых тел. Модель Дебая рассматривает колебания кристаллической решётки как газ квазичастиц — фононов. Эта модель правильно предсказывает теплоёмкость при низких температурах, которая пропорциональна T3. В пределе высоких температур теплоёмкость стремится к 3R, согласно закону Дюлонга — Пти.
При
тепловом равновесии энергия E набора
осцилляторов с различными частотами ![]() равна
сумме их энергий:
равна
сумме их энергий:
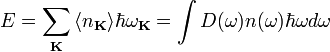
где D(ω) — число мод нормальных колебаний на единицу длины интервала частот, n(ω) — количество осцилляторов в твёрдом теле, колеблющихся с частотой ω.
Функция плотности D(ω) в трёхмерном случае имеет вид:
![]()
где V — объём твёрдого тела, v — скорость звука в нём.
Значение квантовых чисел вычисляются по формуле Планка:
![]()
Тогда энергия запишется в виде
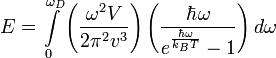
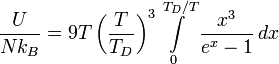
где TD — температура Дебая, N — число атомов в твёрдом теле, kB — постоянная Больцмана.
Дифференцируя внутреннюю энергию по температуре получим:
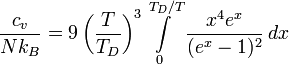
21 .Работа газа. Работа газа при различных изопроцессах.
Рассмотрим газ, находящийся в цилиндре с поршнем, позволяющем менять объем газа (рис 9.2). Отметим, что слово «газ» здесь совершенно условно. Это может быть жидкость, кристалл и вообще любое тело. Цилиндр контактирует с нагревателем или холодильником, который может сообщать газу тепло или отбирать его.
Пусть на поршень оказывается внешнее давление, величина которого может быть любой.
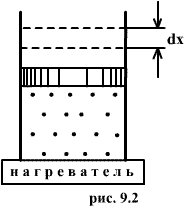
Все процессы, которые будем рассматривать ниже, будут квазистатическими, т.е. медленными настолько, чтобы можно было считать, что в каждый момент газ находится в состоянии т.д.р. Если очень быстро сжать газ, то давление его у поршня окажется на какой-то момент больше, чем в стальном объеме, и тогда нельзя будет говорить о давлении газа вообще. Такой процесс не является квазистатическим. Приближенно квазистатическими являются и процессы, достаточно быстрые с технической точки зрения, например процессы, происходящих в цилиндрах двигателя автомашины во время работы мотора (оказывается, для приближенной квазистатичности требуется, чтобы скорость поршня была мала по сравнению со скоростью звука в газе).
Работа
над газом выполняется внешними силами
при его сжатии. Работа самого газа
выполняется при его расширении. Пусть
газ расширяется так, что поршень на
рис.9.2 поднимается на величину dx. Тогда
газ выполнит работу ![]() (S
– площадь поршня). Получим
(S
– площадь поршня). Получим
|
(9.8) |
Эта величина называется элементарной работой газа. Работа при расширении газа от объема V1 до V2будет равна
|
(9.9) |
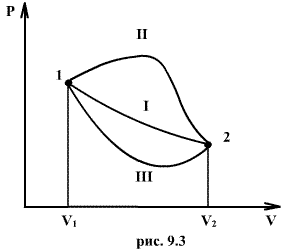
Если по одной оси отложить объем газа, по другой – его давление (плоскость P – V), то работа (9.9) будет изображаться площадью под кривой P(V) (рис.9.3).
Процесс расширения от объема V1 до объема V2 может происходить различным образом: например, можно при этом изолировать газ от нагревателя или, наоборот, нагревать газ и т.д. Иначе говоря, при перемещении из точки 1 в точку 2 в газе могут происходить различные процессы, даже если зафиксировано начальное и конечное состояния. В каждом процессе работа будет иметь свое значение, так как площадь под кривой процесса будет различной (кривые I, II, и III на рис.9.3). Таким образом, выполняемая газом работа зависит от процесса, который с ним происходит. Обычно (хотя это и не совсем точное выражение) говорят, что «работа газа есть функция процесса».
Заметим, что работа положительна, если она выполняется газом, и отрицательна, если внешние силы выполняют ее над газом.
Заметим, что когда мы выводили формулу для элементарной работы газа, мы
зачем-то сказали, что изменение объёма очень мало и давление не меняется.
Почему? А потому что если давление в сосуде будет меняться, полученную
выше формулу использовать нельзя! Ведь в этом случае сила будет меняться от
точки к точке, т.е. будет зависеть от положения поршня. И работа, совершаемая
в разных местах положения поршня будет разной при одном и том же расшире-
нии газа на ∆V . В этом случае работу газа можно найти с помощью интегриро-
вания, и если у нас будет время, мы это сделаем.
Изобарический процесс ( P= cons ). Газ в этом случае всё время находится
при одном и том же давлении. Это, например, возможно, если при расшире-
нии он одновременно нагревается. Или, например, при сжатии часть газа
вытекает наружу. В этом случае работа газа всегда равна A = P*∆V
.
Изохорический процесс (V=const ). Если объем газа не меняется, газ не мо-
жет сдвинуть поршень, следовательно работа равна нулю: A= 0 .
Изотермический процесс (T= const ). В этом случае газ расширяется, а его
температура не меняется. А раз не меняется его температура, то не меняется
и его внутренняя энергия. Следовательно работа газа в изотермическом
процессе в точности равна теплоте, полученной газом извне A=Q .
Адиабатический процесс ( ∆Q =0). В этом процессе нет передачи тепла из-
вне, т.е. газ совершает работу только за счёт «внутренних резервов». Значит
A =∆U
22 Адиабатный процесс. Уравнений Пуассона.
Адиабатический
процесс — термодинамический
процесс в
макроскопической системе, при котором
система не получает и не отдаёттепловой
энергии.
![]() Серьёзное
исследование адиабатических процессов
началось с XVIII века[1].
Серьёзное
исследование адиабатических процессов
началось с XVIII века[1].
Адиабатический процесс является частным случаем политропного процесса. Адиабатические процессы обратимы, только тогда, когда в каждый момент времени система остаётся равновесной (например, изменение состояния происходит достаточно медленно) и изменения энтропии не происходит. Некоторые авторы (в частности, Л. Д. Ландау) называли адиабатическими только квазистатические адиабатические процессы[2].
Адиабатический процесс для идеального газа описывается уравнением Пуассона. Линия, изображающая адиабатный процесс на какой-либо термодинамической диаграмме, называется адиабатой. Существует ряд явлений природы, которые могут считаться адиабатическим процессом, кроме того, он получил применение в технике.