
- •Обратимые ионные реакции. С участием малорастворимых солей,слабых электролитов и комплексных соедининий. Константа равновесия.
- •Обратимые ионные реакции. Константа равновесия ионных обменных реакций
- •Окислительно-востановительные реакции.Окислители,восстановители,соединения с двойственной функцией.
- •Окислительно-востановительные реакции. Окислительно-востановительная двойственность. Количественная характеристика окислительно-востановительной способности веществ.
- •Основные положения теории кислот и оснований Аррениуса. Зависимость кислотно-основных свойств соединений от степени окисления центрального атома.
- •Основные положения кристаллического поля(на примере октаэдрических комплексов). Низко- высокоспиновые комплексные ионы.
- •Квантово-механическая модель атома
Основные положения кристаллического поля(на примере октаэдрических комплексов). Низко- высокоспиновые комплексные ионы.
Теория кристаллического поля — квантохимическая модель, в которой электронная конфигурация соединений переходных металлов описывается как состояния иона либо атома, находящегося в электростатическом поле, создаваемым окружающими его ионами, атомами или молекулами. Концепция кристаллического поля была предложена Беккерелем для описания состояния атомов в кристаллах и затем развита Гансом Бете и Джоном Ван Флеком для описания низших состояний катионов переходных металлов, окруженных лигандами - как анионами, так и нейтральными молекулами. Теория кристаллического поля была в дальнейшем объединена с теорией молекулярных орбиталей в более общую теорию поля лигандов, учитывающую частичную ковалентность связи металл-лиганд в координационных соединениях[1].
Теория кристаллического поля позволяет предсказать или интерпретировать оптические спектры поглощения и спектры электронного парамагнитного резонанса кристаллов и комплексных соединений, а также энтальпий гидратации и устойчивости в растворах комплексов переходных металлов.
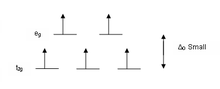
Лиганды, вызывающее большое расщепление d-уровней, например CN− и CO, называются лигандами сильного поля. В комплексах с такими лигандами электронам невыгодно занимать орбитали с высокой энергией. Следовательно, орбитали с низкой энергией полностью заполняются до того, как начинается заполнение орбиталей с высокой энергией. Такие комплексы называются низкоспиновыми. Например, NO2− — лиганд сильного поля, создающий большое расщепление. Все 5 d-электронов октаэдрического иона [Fe(NO2)6]3−будут располагаться на нижнем уровне t2g.
![]()
Распределение d-электроноввысокоспинового комплекса [FeBr6]3−
Напротив, лиганды, вызывающие малое расщепление, например I− и Br−, называются лигандами слабого поля. В этом случае легче поместить электроны в орбитали с высокой энергией, чем расположить два электрона в одной орбитали с низкой энергией, потому что два электрона в одной орбитали отталкивают друг друга, и затраты энергии на размещение второго электрона в орбитали выше, чем Δ. Таким образом, прежде чем появятся парные электроны, в каждую из пяти d-орбиталей должно быть помещёно по одному электрону в соответствии с правилом Хунда. Такие комплексы называются высокоспиновыми. Например, Br− — лиганд слабого поля, вызывающий малое расщепление. Все 5 d-орбиталей иона [FeBr6]3−, у которого тоже 5 d-электронов, будут заняты одним электроном.
Энергия расщепления для тетраэдрических комплексов Δтетр примерно равна 4/9Δокт (для одинаковых металла и лигандов). В результате этого разность энергетическими уровнями d-орбиталей обычно ниже энергии спаривания электронов, и тетраэдрические комплексы обычно высокоспиновые.
Диаграммы распределения d-электронов позволяют предсказать магнитные свойства координационных соединений. Комплексы с непарными электронами являются парамагнитными и притягиваются магнитным полем, а без — диамагнитными и слабо отталкиваются.
37
Периодические и не периодические свойства атомов элементов. Полные и неполные электронные аналоги.
38
Планетарная модель атома водорода. Постулаты Бора. Квантовомеханическая модель атома. Волновая функция.
Первый постулат: Атомы имеют ряд стационарных состояний соответствующих определенным значениям энергий: Е1, Е2...En. Находясь в стационарном состоянии, атом энергии не излучает, несмотря на движение электронов. Второй постулат: В стационарном состоянии атома электроны движутся по стационарным орбитам, для которых выполняется квантовое соотношение: m·V·r = n·h/2· (1) где m·V·r =L - момент импульса, n=1,2,3..., h-постоянная Планка. Третий постулат: Излучение или поглощение энергии атомом происходит при переходе его из одного стационарного состояния в другое. При этом излучается или поглощается порция энергии (квант), равная разности энергий стационарных состояний, между которыми происходит переход: = h·= Em-En (2)
|
|
Рис. 1. |
Схемы перехода атома: 1.из
основного стационарного состояния в
возбужденное, 2.из возбужденного стационарного состояния в основное.
Рис. 2. |
|
Постулаты Бора противоречат законам классической физики. Они выражают характерную особенность микромира - квантовый характер происходящих там явлений. Выводы, основанные на постулатах Бора, хорошо согласуются с экспериментом. Например, объясняют закономерности в спектре атома водорода, происхождение характеристических спектров рентгеновских лучей и т.д. На рис. 3 показана часть энергетической диаграммы стационарных состояний атома водорода.
Стрелками показаны переходы атома, приводящие к излучению энергии. Видно, что спектральные линии объединяются в серии, различающиеся тем, на какой уровень с других (более высоких) происходит переход атома. |
Волнова́я
фу́нкция,
или пси-функция ![]() — комплекснозначная
функция,
используемая вквантовой
механике для
описания чистого состояния системы.
Является коэффициентом разложения вектора
состояния по
базису (обычно координатному):
— комплекснозначная
функция,
используемая вквантовой
механике для
описания чистого состояния системы.
Является коэффициентом разложения вектора
состояния по
базису (обычно координатному):
![]()
где ![]() —
координатный базисный вектор, а
—
координатный базисный вектор, а ![]() —
волновая функция в координатном
представлении.
—
волновая функция в координатном
представлении.
Физический смысл волновой функции заключается в том, что согласно копенгагенской интерпретации квантовой механики плотность вероятности нахождения частицы в данной точке пространства в данный момент времени считается равной квадрату абсолютного значенияволновой функции этого состояния в координатном представлении.

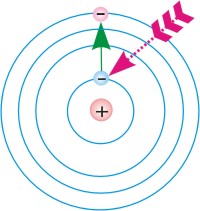
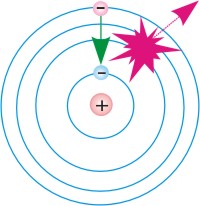
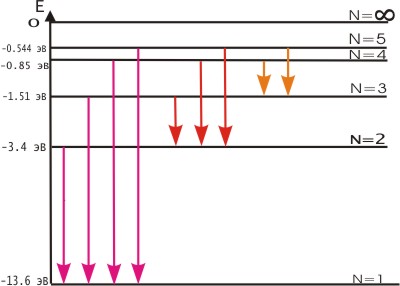 Рис. 3.
Рис. 3.