
Определение теплоты Образования кристаллогидрата
Цель работы — определение теплоты образования кристаллогидрата CuSO4∙5Н2О из CuSO4 и Н2О.
Краткие теоретические положения.
Теплотой образования кристаллогидрата называется тепловой эффект образования 1 моля твердого кристаллогидрата из твердой безводной соли и соответствующего количества воды.
Растворение безводного сульфата меди протекает по уравнению:
CuSO4(кр.) + n Н2О(жид.) = CuSO4 ∙ n Н2О H1
Однако данный процесс сопровождается гидратацией безводного сульфата меди и переходом его в растворенное состояние:
CuSO4(кр.) + 5 Н2О(жид.) = CuSO4∙5Н2О(кр) Hгидр
CuSO4∙5Н2О(кр)+ (n-5) Н2О(жид.) = CuSO4 ∙ n Н2О H2
По закону Гесса
H1= Hгидр + H2 (3)
Теплота образования кристаллогидрата Hгидр не может быть измерена в калориметре непосредственно, так как скорость образования кристаллогидрата мала. Эту величину вычисляют по разности интегральных теплот растворения безводной соли H1 и кристаллогидрата H2:
Hгидр= H1 - H2
Пример: Энтальпии растворения в воде кристаллогидрата и безводного сульфата меди равны соответственно
H2 = +11,7 кДж; H1 = - 66,1 кДж
Рассчитать энтальпию присоединения 5 молекул воды к молекуле сульфата меди по реакции в расчете на 1 моль.
Ответ:
CuSO4 + 5H2O → CuSO4∙5H2O
Hгидр= - 66,1 кДж – (+11,7 кДж) = - 77,8 кДж/моль
Приборы и реактивы.
Калориметр.
Весы аналитические.
Секундомер.
Термометр с ценой деления 0,1°С.
Стеклянная воронка.
Мерный цилиндр на 250 см3.
Сульфат меди безводный.
Сульфат меди кристаллогидрат.
Дистиллированная вода.
Порядок выполнения работы.
Определение теплоты растворения безводной соли сульфата меди
Во внутренний сосуд калориметра налить 25 см3 дистиллированной воды комнатной температуры из бюретки.
Опустить в воду (не касаясь дна сосуда) термометр и закрепить его в зажиме штатива.
Отвесить на технических весах на листке пергаментной бумаги 1-1,2г безводного сульфата меди с точностью до 0,01г.
Измерить температуру воды в калориметре с точностью до 0,1 °С - начальная температура опыта tнач.
Сделать из листка пергаментной бумаги маленькую воронку, вставить ее в отверстие в пробке, аккуратно высыпать через нее отвешенную соль в воду. Закрыть отверстие пробкой.
Осторожно перемешивая раствор мешалкой, следить за изменением температуры в течение 5-7 мин.
Записать показания термометра с точностью до 0,1° первые 3 мин с интервалами в 0,5 мин, дальше через 1 мин по приведенной ниже форме
Время от начала опыта, мин |
0 |
0,5 |
1 |
1,5 |
2 |
2,5 |
3 |
4 |
5 |
6 |
7 |
Температура, 0С |
|
|
|
|
|
|
|
|
|
|
|
По полученным данным построить кривую "температура-время", откладывая по оси абсцисс время в минутах, по оси ординат - температуру.
Определить по графику наивысшую температуру раствора tмак и вычислить разность температур t=tмак - tнач.
Определить количество теплоты Q1 = - Н1, выделяющейся при растворении безводной соли сульфата меди в пересчете на 1 моль безводной соли по формуле
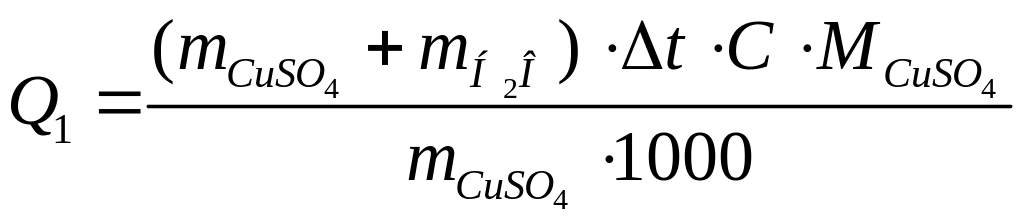 ,
кДж/моль
,
кДж/моль
где
![]() и
и
![]() соответственно масса соли и масса воды,
г;
соответственно масса соли и масса воды,
г;
С = 4,184 Дж/г∙град - удельная теплоемкость раствора, принятая равной теплоемкости воды;
![]() -
молярная масса сульфата меди.
-
молярная масса сульфата меди.
Определение теплоты растворения кристаллогидрата сульфата меди
1. Во внутренний сосуд калориметра налить 25 см3 дистиллированной воды комнатной температуры из бюретки.
2. Опустить в воду (не касаясь дна сосуда) термометр и закрепить его в зажиме штатива.
3.Отвесить на технических весах на листке пергаментной бумаги 1,6-1,8 г кристаллогидрата сульфата меди с точностью до 0,01г.
4. Далее продолжать работу согласно пунктам 4 - 10. Определить количество теплоты Q2 = - Н2, выделяющейся при растворении кристаллогидрата сульфата меди.
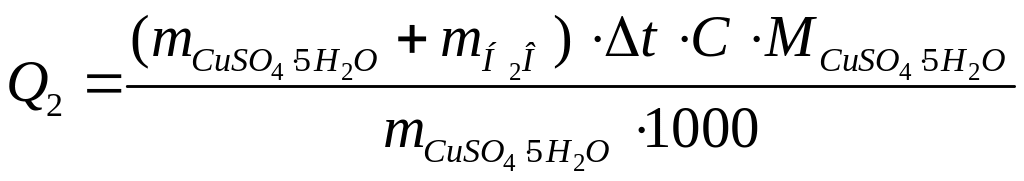 ,
кДж/моль
,
кДж/моль
где
![]() и
соответственно масса кристаллогидрата
и масса воды, г;
и
соответственно масса кристаллогидрата
и масса воды, г;
С = 4,184 Дж/г∙град - удельная теплоемкость раствора, принятая равной теплоемкости воды;
![]() -
молярная масса кристаллогидрата сульфата
меди.
-
молярная масса кристаллогидрата сульфата
меди.
5. Рассчитать теплоту образования кристаллогидрата Hгидр= H1 - H2
6. Полученное значение сравнивают с табличной величиной гидратообразования Hгидр= - 77,8кДж/моль и находят относительную ошибку по формуле:
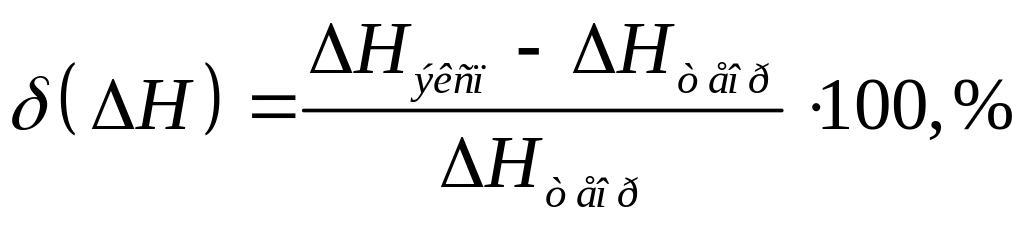
7. Анализируют результаты, формулируют выводы
Контрольные вопросы
Что изучает термодинамика?
Сформулируйте первый закон термодинамики.
Что такое термодинамическая система?
Какие системы называются гомогенными, гетерогенными, изолированными, закрытыми, открытыми, закрытыми?
Что называют термодинамическим процессом, циклом?
Какие процессы называются изохорными, изобарными, изотермическими, адиабатными, обратимыми, необратимми, самопроизвольными, несамопроизвольными?
Дайте определения понятиям внутренняя энергия, энтальпия, теплота, работа.
Какие характеристики термодинамического процесса относят к функциям пути?
Какие характеристики термодинамического процесса относят к функциям состояния?
Что называется теплоемкостью?
В чем заключается закон Кирхгофа?
Что изучает термохимия?
Что такое тепловой эффект процесса?
Дайте определения понятиям энтальпии образования и сгорания веществ.
Что называется теплотой растворения, теплотой нейтрализации?
Сформулируйте закон Гесса и его следствия.
Опишите устройство калориметра.
Как определить теплоту нейтрализации?
Как определить теплоту растворения соли?
Сформулируйте второй закон термодинамики.
Что такое энтропия?
В чем заключается третий закон термодинамики?
Какие выводы можно сделать о конкретной химической реакции, если изменение следующих термодинамических функций отрицательно:
а) энтропии;
б) свободной энергии Гиббса;
в) энергии Гельмгольца?
Изменением какой термодинамической функции определяется возможность самопроизвольного протекания процесса:
а) при постоянных давлении и температуре;
б) при постоянных объеме и температуре;
в) в изолированной системе?
