Лекция 7. ОСНОВЫ ЭЛЕКТРОХИМИИ
Понятия и основные законы
Реакции, протекающие за счет подведенной извне электрической энергии или же, наоборот, служащие источником ее получения, называются ЭЛЕКТРОХИМИЧЕСКИМИ РЕАКЦИЯМИ.
ЭЛЕКТРОХИМИЯ занимается исследованием закономерностей, связанных со взаимным превращением химической и электрической форм энергии.
Для осуществления электрохимической реакции необходима некоторая система – ЭЛЕКТРОХИМИЧЕСКАЯ ЦЕПЬ.
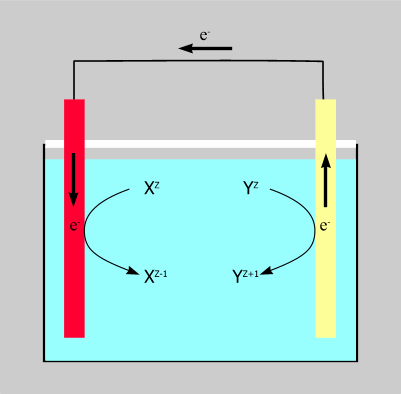
Общая схема электрохимической цепи, в которой протекает реакция
Xz + Yz' = Xz-1 + Yz'+1
Существенные элементы такой системы:
1) два электрода, состоящие из электронопроводящих материалов (металла, графита и т.п.), контактирующих с ионными проводниками (электролитами);
ЭЛЕКТРОД ДОЛЖЕН:
ПРОВОДИТЬ ЭЛЕКТРИЧЕСТВО,
СОДЕРЖАТЬ АТОМЫ, КОТОРЫЕ ИЗМЕНЯЮТ СВОЮ СТЕПЕНЬ ОКИСЛЕНИЯ.
2) металлический проводник (проводник I рода), соединяющий электроды и обеспечивающий прохождение электрического тока между ними, он представляет собой внешнюю цепь;
3) раствор электролита, его расплав или твердый электролит (проводники II рода), эта часть системы есть внутренняя цепь.
Электрохимическая цепь работает как химический источник тока (гальванический элемент), если в ней электрический ток возникает в результате самопроизвольно идущей реакции.
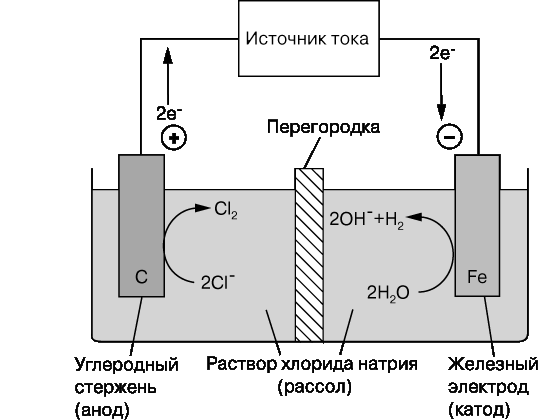
При помощи электрохимической цепи и внешнего источника тока можно осуществить различные химические превращения веществ. Такая цепь работает как электролизер.
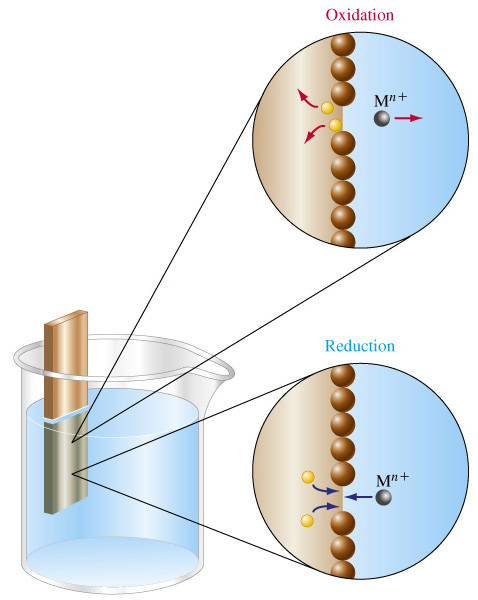
МЕЖДУ МЕТАЛЛОМ И ОКРУЖАЮЩЕЙ СРЕДОЙ (т.е. на границе раздела электроно- и ионопроводящих фаз) ВОЗНИКАЕТ ОПРЕДЕЛЕННАЯ РАЗНОСТЬ ПОТЕНЦИАЛОВ, КОТОРУЮ НАЗЫВАЮТ ЭЛЕКТРОДНЫМ ПОТЕНЦИАЛОМ МЕТАЛЛА.
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ может принимать:
ПОЛОЖИТЕЛЬНОЕ ЗНАЧЕНИЕ, если металлические ионы получают электроны от электрода, образуют атомы металла, и электрод заряжается положительно.
Me2+(ж) + 2 ē → Me(т)
ОТРИЦАТЕЛЬНОЕ ЗНАЧЕНИЕ, если металл электрода окисляется, растворяется, образуются положительно заряженные ионы металла (катионы); излишек электронов остается на поверхности электрода, и электрод заряжается отрицательно.
Me(т) → Me2+(ж) + 2 ē
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ – УСТРОЙСТВО, где в результате окислительно-восстановительной реакции возникает электрический ток.
Элемент Вольта — первый гальванический элемент - был создан в 1799 г. физиком Вольта.
Схема http://ru.wikipedia.org

Вольтов столб— применявшееся на заре электротехники (1800) устройство для получения электричества.
Zn ↔ Zn2+ + 2 ē окисление
2 H+ + 2 ē = H2↑ восстановление
В 1800 году итальянский учёный Алессандро Вольта опустил в банку с кислотой две пластинки — цинковую и медную — и соединил их проволокой. После этого цинковая пластина начала растворяться, а на медной стали выделяться пузырьки газа. Вольта предположил и показал, что по проволоке протекает электрический ток.
Для удобства Вольта придал ему форму вертикального цилиндра (столба), состоящего из соединённых между собой колец цинка, меди и сукна, пропитанных кислотой.
Вольтов столб высотою в полметра развивал напряжение, чувствительное для человека.
В 1803 русский физик Василий Петров создал самый мощный в мире вольтов столб, составленный из 4 200 медных и цинковых кругов и развивающий напряжение до 2 500 вольт. С помощью этого прибора ему удалось открыть такое важное явление, как электрическая дуга, применяемая в электросварке; а в Российской армии стал применяться электрический запал пороха и взрывчатки.
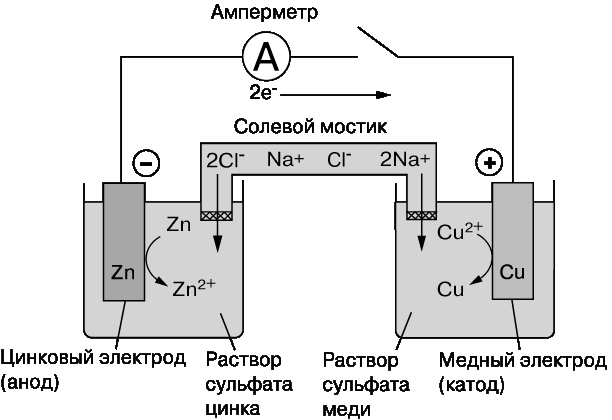
Элемент ДАНИЭЛЯ – ЯКОБИ
или медно-цинковый элемент
SO42-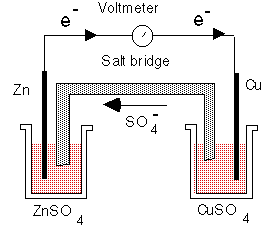
НА ОТРИЦАТЕЛЬНОМ НА ПОЛОЖИТЕЛЬНОМ ЭЛЕКТРОДЕ, АНОДЕ: ЭЛЕКТРОДЕ, КАТОДЕ:
Мет. цинк окисляется, Катионы меди Cu2+ ионы Zn2+ восстанавливаются;
переходят в раствор: осаждение меди:
Zn ↔ Zn2+ + 2 ē Cu2+ + 2 ē = Cu
(окисление) (восстановление)
Электрод, на котором происходит ОКИСЛЕНИЕ, является анодом,
а ВОССТАНОВЛЕНИЕ – катодом.
Электрохимические ячейки часто представляют схематически, обозначая границу между электродом и электролитом вертикальной чертой (|), а солевой мостик – двумя черточками (||).
СХЕМА ЭЛЕМЕНТА:
(-) Zn│ ZnSO4 ║ CuSO4│ Cu (+)
В элементе протекает суммарная окислительно-восстановительная реакция:
Cu2+(ж) + Zn(т) = Cu (т) + Zn2+(ж)
Разность равновесных потенциалов двух электродов, из которых составлен гальванический элемент, представляет собой его электродвижущую силу (э.д.с.).
В общем виде, э.д.с. гальванического элемента:
E = Eкатода – Eанода
Э.д.с. гальванического элемента Даниэля:
E = ECu2+/Cu - EZn2+/Zn = ECu - EZn
E° = ECu°- EZn° = 0,34 – (-0,76) = 1,1 В
СТАНДАРТНЫЙ ПОТЕНЦИАЛ (Е°) – это э.д.с. гальванического элемента, составленного из водородного электрода и исследуемого электрода.
Схема стандартного водородного электрода:
www.wikipedia.org
платиновый электрод
подводимый газообразный водород
раствор кислоты (обычно HCl), СH+ = 1моль/л
водяной затвор,
электролитический мост (состоящий из концентрированного р-ра KCl).
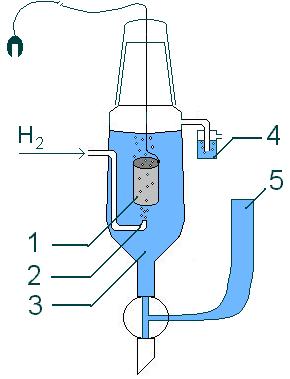
По договоренности, э.д.с. стандартного водородного электрода принимается равной 0 (ЕН+° = 0,00 В)
Потенциалы других электродов, измеренные относительно водородного электрода в стандартном состоянии называют стандартными окислительно-восстановительными потенциалами (E0 или e0, В) или стандартными потенциалами.
Стандартные условия: 25 °C (298,15 K)
Электролит – раствор 1 M HCl (H+, 1 M)
Давление водорода 1 атм
Концентрация ионов Men+ составляет 1 M

На поверхности платины, Pt:
2 H+(ж) + 2 ē ↔ H2(г)
Zn(тв) ↔ Zn2+(ж) + 2 ē
СХЕМА ЭЛЕМЕНТА:
(-) Zn│1 М Zn2+║ Н+│H2 (1 atm)│Pt(тв) (+)
Если [Zn2+] = 1 моль/дм3, то EZn = EZn°
СТАНДАРТНЫЕ ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
Вещество |
E◦, V |
Вещество |
E◦, V |
Li |
-3,04 |
Ni |
-0,25 |
K |
-2,92 |
Sn |
-0,14 |
Ca |
-2,87 |
Pb |
-0,13 |
Na |
-2,71 |
2 H+ + 2 ē |
0,00 |
G |
-2,38 |
Cu |
0,34 |
Al |
-1,66 |
Ag |
0,80 |
Zn |
-0,76 |
Au |
1,50 |
Fe |
-0,44 |
Ce4+ + 2 ē |
1,61 |
Cr |
-0,41 |
|
|
Электродвижущая сила гальванического элемента, в котором реакция протекает самопроизвольно, есть величина положительная и Еk > Еa,
то есть электрод, на котором совершается процесс восстановления, имеет более положительный потенциал, чем электрод, на котором идет процесс окисления.
H:\YKI3030_09\Galvanic_serie.doc
Гальваническая серия сплавов металлов в морской воде
Most cathodic, noble, or resistant to corrosion
Platinum
Gold
Graphite
Titanium
Silver
/ Chlorimet 3
\ Hastelloy C
/ 18-8 Mo stainless steel (passive)
| 18-8 stainless steel (passive)
\ Chromium steel >11 % Cr (passive)
/ Inconel (passive)
\ Nickel (passive)
/ Silver solder
| Monel
| Bronzes
| Copper
\ Brasses
/ Chlorimet 2
\ Hastelloy B
/ Inconel (active)
\ Nickel (active)
Tin
Lead
Lead-tin solders
/ 18-8 Mo stainless steel (active)
\ 18-8 stainless steel (active)
Ni-resist
Chromium steel >11 % Cr (active)
/ Cast iron
\ Steel or iron
2024 Aluminum
Cadmium
Commercially pure aluminium
Zinc
Magnesium and its alloys
Most anodic or easy to corrode
Гальваническая серия сплавов металлов в морской воде
Катод, (nobel) устойчивый к коррозии
платина
золото
графит
титан
серебро
/ хлоримет 3
\ хастеллой C
/ 18-8 Mo нерж.сталь (пассивир.)
| 18-8 нерж.сталь (пассивир.)
\ хромистая сталь >11 % Cr (пассивир.)
/ инконель (пассивир.) ( 73%Ni, 15%Cr, 3,5%Ti, 1,5%Nb)
\ никель (пассивир.)/ серебряный припой
| монель ( 66%Ni, 30%Cu, 3,5%Al, 1,5%Fe)
| бронзы
| медь
\ латуни
/ хлоримет 2 (63%Ni, 3%Cr, 32%Mo)
\ хастеллой B
/ инконель (актив.)
\ никель (актив.)
олово
свинец
свинцово-оловянный припой / 18-8 Mo нерж.сталь (актив.)
\ 18-8 нерж.сталь (актив.)
Ni-resist (аустенитные стали)
Хромистые (ферритные) стали >11 % Cr (актив.)
/ чугун
\ сталь или железо
2024 Алюминий
кадмий
чистый алюминий
цинк
магний и сплавы Mg
Анод; легко корродирует
УРАВНЕНИЕ НЕРНСТА (1889г.)
Электродный потенциал Е зависит от концентрации окисленной и восстановленной форм в растворе и температуры и связан с ними и стандартным потенциалом E° уравнением Нернста:
![]() ,
,
где R – 8,314 Дж/(моль·К), универсальная газовая постоянная,
T – температура, К,
n – число электронов в электродной полуреакции,
F – число Фарадея, 96485 Кл/моль.
При Т = 298 К
![]()
Химический источник тока (ХИТ) — источник тока, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию.
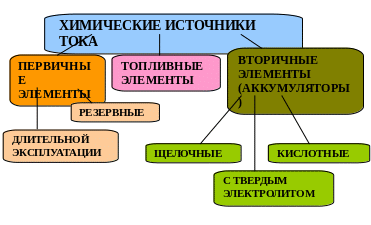
Классификация ХИТ
Элементы первого рода, или гальванические элементы - это одноразовые батареи, которые производят электроэнергию за счет химических реакций, в результате которых анод, катод и электролит претерпевают необратимые изменения.
Перезарядка таких батарей невозможна или очень нерациональна.
Элементы второго рода чаще называют аккумуляторами. Это значит, что они могут заряжаться, если к электродам подключить источник постоянного тока.
Химические реакции, протекающие в аккумуляторах, являются обратимыми.
Батареи второго рода не производят, а лишь сохраняют энергию.
Топливные элементы - электрохимические генераторы - относятся к первичным элементам, но конструктивно выполняются так, что активные вещества подаются, а продукты реакции отводятся по мере работы элемента.
Топливные элементы нуждаются в различных вспомогательных системах, обеспечивающих подготовку и подвод реагентов, отвод продуктов реакции, поддержание теплового режима, хранилище активных веществ.
Параметры ХИТ:
1) напряжение разомкнутой цепи. Если величина напряжения недостаточна, то проводится оценка количества последовательно включенных элементов в батарею, необходимого для получения требуемого напряжения;
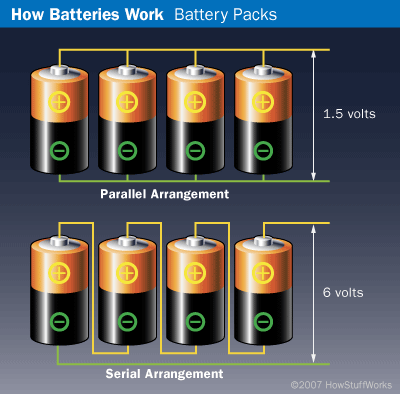
Например, в 9-вольтовой батарейке обычно объединены 6 элементов с э.д.с. 1,5 В:


2) емкость батареи электропитания в ампер-часах равна произведению предельного тока на продолжительность разрядки.
3) удельная емкость, то есть количество электрической энергии (обычно в ампер-часах) на единицу веса или объема ХИТ;
4) удельная мощность, то есть произведение силы тока на напряжение, отнесенное к единице веса или объема ХИТ;
5) срок годности;
6) величина саморазряда, обусловленного наличием побочных электрохимических процессов на электродах, приводящих к расходованию активных масс (коррозия) и потере удельной емкости ХИТ;
7) стоимость.
Элемент ЛЕКЛАНШЕ, СУХОЙ элемент
СОЛЕВАЯ батарейка
Первыми серийно выпускаемыми элементами питания стали именно сухие. И поныне они являются самыми распространенными в мире.
Одна лишь компания Energizer продает более 6 миллиардов таких батарей ежегодно.
Они имеют самую низкую удельную емкость из всех "массовых" типов, но дешевы.
Основные типы сухих элементов:
цинк-хлоридные,
марганцево-цинковые батареи (элементы Лекланше),
щелочные
Марганцево-цинковый: электролит - смесь хлорида аммония и хлорида цинка, разбавленная водой.
Цинк-хлоридный: электролит почти на 100% представляет собой хлорид цинка.
Различие в номинальном напряжении у них минимально: 1,55В и 1,6В соответственно.
Цинк-хлоридные имеют большую емкость по сравнению с элементами Лекланше, но это преимущество пропадает при малой нагрузке. Поэтому на них часто пишут "heavy-duty", то есть элементы с повышенной мощностью.
У
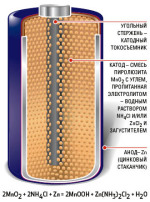 ГОЛЬНЫЙ
СТЕРЖЕНЬ -
ГОЛЬНЫЙ
СТЕРЖЕНЬ -
КАТОДНЫЙ ТОКОСЪЕМНИК
КАТОД – СМЕСЬ ПИРОЛЮЗИТА (MnO2) С УГЛЕМ, ПРОПИТАННЫМ ЭЛЕКТРОЛИТОМ – ВОДНЫМ РАСТВОРОМ NH4OH+NH4Cl ИЛИ ZnCl2 И ЗАГУСТИТЕЛЕМ.
АНОД – ЦИНКОВЫЙ СТАКАНЧИК (Zn)
Полуреакции ячейки Лекланше:
Zn(s) → Zn2+(aq) + 2ē
Eo = -0,76 B
2MnO2(s) + H2O + 2ē → Mn2O3(s) + 2OH-(aq)
Eo = +0,32 B
Цинк окисляется до Zn2+ ионов
Ионы Mn(IV) восстанавливаются до Mn(III) во время разрядки батарейки
Суммарная реакция во время разрядки:
Zn(s) + 2MnO2(s) + H2O → Mn2O3(s) + Zn(OH)2(s)
Стандартный окислительно-восстановительный потенциал элемента:
Eocell = Eocatode - Eoanode
Eocell = 0.32 – (-0.76) = 1.08 B
На практике разность потенциалов составляет 1,55 В из-за того, что концентрации ионов в элементе не являются стандартными.
Щелочной элемент
Alcaline
При замене хлористого аммония на щелочь (KOH) удается значительно снизить саморазряд элемента и повысить срок его годности.
В зависимости от области применения, щелочные батарейки могут прослужить в 4-5 раз дольше, чем обычные угольно-цинковые.
В конструкции различия существенны. Можно сказать, что щелочная батарея это сухой элемент, „вывернутый наизнанку”.

АНОД – внутренний цилиндр - желеобразная смесь цинкового порошка вперемешку с электролитом (водным раствором гидроксида калия, KOH).
КАТОД –паста из MnO2 и маленьких частиц графита (С) - окружает анод и электролит. Он отделяется от анода слоем нетканого материала (полиэстер).
Внешний корпус не является анодом, это просто защитная оболочка.
На аноде: Zn + 2OH– → ZnO + H2O + 2e–
На катоде: 2MnO2+H2O+2e–→ Mn2O3+2OH–
Элемент не является перезаряжаемым! Если солевую или щелочную батарейку поставить в зарядное устройство, то она будет вести себя не как аккумулятор, а как резистор – начнет нагреваться. Если ее оттуда вовремя не вынуть, то она нагреется достаточно сильно, чтобы взорваться.
СРЕДНИЙ СРОК СЛУЖБЫ СТАКАНЧИКОВЫХ ЭХГ |
|||
Тип |
Применение |
Особенности |
|
|
карманный фонарь, мин |
радиоприемник, ч |
|
Лекланше |
250 |
85 |
Для нормальных условий работы |
Цинкхлоридный |
730 |
135 |
Для жестких и сверхжестких условий работы |
Марганцево-цинковый |
1500 |
250 |
Щелочной |
АККУМУЛЯТОРЫ
Характеризуется как источник и потребитель электрического тока c поочередной работой в режиме заряда-разряда.
Основной показатель - номинальная емкость батареи (А(Ампер)-час), т.е. количество электричества, которое отдает полностью заряженная батарея.
Другой показатель для заряженной батареи - напряжение на клеммах (В). Если номинальное напряжения первичной ячейки аккумулятора равно 2 В, то номинальное напряжение батареи Uном = (число последовательно соединенных элементов) х 2
Аккумуляторы подразделяются на:
Кислотные
Щелочные.
СВИНЦОВЫЙ АККУМУЛЯТОР (КИСЛОТНЫЙ) или СТАРТЕРНЫЙ АВТОМОБИЛЬНЫЙ АККУМУЛЯТОР
http://www.akb-service.ru/
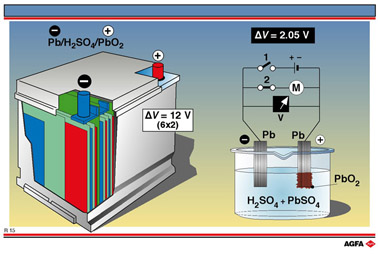
Электролит – раствор серной кислоты,
ρH2SO4 = 1,18 – 1,27 g/cm3 (28 – 30%)
РЕЖИМ РАЗРЯДКИ:
- пластина(губчатый свинец, Pb):
Pb(т) + SO4(ж)2- → PbSO4(т) + 2 ē
Pb → Pb2+ + 2 ē окисление свинца
E° = - 0,36 V
+ пластина (оксид свинца, PbO2):
PbO2(т) + 4 H(ж)+ + SO4(ж)2-+ 2 ē → →PbSO4(т) + 2 H2O(ж)
PbIV + 2 ē → PbII восстановление
E° = +1,69 V
При разрядке аккумулятора на электродах образуется труднорастворимый сульфат свинца, (PbSO4), а концентрация серной кислоты понижается.
СУММАРНО:
Pb(тв) + PbO2(тв) + 2 H2SO4(ж) → → 2 PbSO4(тв) + 2 H2O(ж)
Каждый элемент свинцовой аккумуляторной батареи дает э.д.с. при стандартной температуре и давлении
E° = 1,69 – (- 0,36) = 2,05 V
Свинцово-кислотные аккумуляторы разделяют на четыре основные группы:
стартерные,
стационарные,
тяговые,
портативные (герметизированные), для UPS-ов (Uninterruptible Power Supply).
В автомобилях используются стартерные свинцово-кислотные батареи. Такие батареи способны кратковременно отдавать ток большой величины за несколько секунд, что необходимо при пуске двигателя стартером.
В последние годы в основном используются аккумуляторы, не требующие ухода.
Для этого применяют т.н. связанный электролит, который внутри имеет поры, позволяющие ионам водорода и кислорода свободно перемещаться от одного электрода к другому. Основные способы связывания электролитов — это применение пропитанного жидким электролитом пористого заполнителя (технология Absorptive Glass Mat — AGM) или использование гелеобразного электролита (технологии Dryfit и Gelled Electrolite — GEL). Герметичные аккумуляторы снабжаются клапанами для сброса избыточного давления.
К недостаткам кислотных аккумуляторов относят невысокие удельную энергию, плохую сохранность заряда, выделение водорода.
В ЩЕЛОЧНЫХ АККУМУЛЯТОРАХ электролитом служит раствор щелочи (КОН, NaOH).
Наиболее распостранены щелочные
никель-кадмиевые НК
никель-железные НЖ
Никель-металлогидридные аккумуляторы (Ni-MH). значительно меньше
серебряно-цинковые
серебрянно-кадмиевые аккумуляторы.
Все батареи предназначены для многократного глубого заряда-разряда.
Никель-кадмиевый аккумулятор
(Ni-Cd)
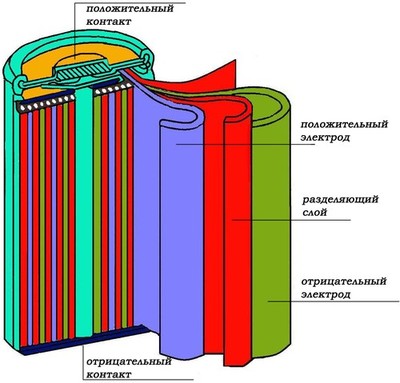
Положительный электрод (катод) содержит оксид-гидрооксид никеля NiOOH с графитовым порошком (5-8%), а отрицательный (анод) — металлический кадмий Cd в виде порошка.
Аккумуляторы этого типа часто называют рулонными, так как электроды скатаны в цилиндр (рулон) вместе с разделяющим слоем, помещены в металлический корпус и залиты электролитом. Разделитель (сепаратор), увлажненный электролитом, изолирует пластины друг от друга. Он изготавливается из нетканого материала, который должен быть устойчив к воздействию щелочи. Электролитом чаще всего выступает гидроксид калия KOH с добавкой гидроксида лития LiOH, способствующего образованию никелатов лития и увеличения емкости на 20%.
На аноде: Cd (тв) + 2OH– (ж) → Cd(OH)2 (тв) + 2e–
На катоде: 2NiIIIO(OH) (тв) + 2H2O (ж) + 2e– → 2NiII(OH)2 (тв) + 2OH– (ж)
Суммарное уравнение разряда для никель-кадмиевого аккумулятора:
2 NiOOH + Cd + 2 H2O ↔ 2 Ni(OH)2 + Cd(OH)2
Напряжение на клеммах 1,2 В
Преимущества:
• дает относительно сильный ток, почему используется, например, в аккумуляторных рабочих инструментах,
• возможность быстрого и простого заряда, даже после длительного хранения аккумулятора; • большое количество циклов заряд/разряд: при правильной эксплуатации - более 1000 циклов; • хорошая нагрузочная способность и возможность эксплуатации при низких температурах; • продолжительные сроки хранения при любой степени заряда.
Недостатки: токсичность кадмия; эффект „памяти".

http://www.ixbt.com/mobile/accumulators-mem.shtml
Никель-металлoгидридный аккумулятор (NiMH)

Анодом служит сплав никеля с каким-то другим металлом (La, Li); сплав в целом обозначают буквой М. Такой материал позволяет в пустотах кристаллической решетки сохранять атомы водорода (Н).
Катодом является смесь основного оксида и гидроксида никеля.
Напряжение на клеммах около 1,2 В.
Использовались в мобильных телефонах старых типов. В продаже имеются NiMH аккумуляторы типоразмера стандартной батарейки (АА и пр.), которые в последнее время в этой области вытеснили NiCd аккумуляторы.
Преимущества: большая удельная емкость, относительно легкие, менее токсичны по сравнению с NiCd аккумулятором.
Недостатки: относительно быстрый саморазряд; дороже вышеназванных аккумуляторов.
Рекомендации по зарядке Ni-Cd и Ni-MH аккумуляторов:
заряжайте только полностью разряженные аккумуляторы;
не следует помещать заряженный аккумулятор на дополнительную подзарядку, так как это значительно сокращает срок его использования;
не рекомендуется извлекать из зарядного устройства недозаряженный аккумулятор;
не следует оставлять Ni-Cd и Ni-MH аккумуляторы в ЗУ после окончания заряда надолго, так как зарядное устройство и после полного заряда продолжает их заряжать, но только значительно меньшим током. Длительное нахождение Ni-Cd- и Ni-MH аккумуляторов в ЗУ приводит к их перезаряду и ухудшению параметров;
перед зарядкой аккумуляторы должны быть комнатной температуры. Наиболее эффективна зарядка при температуре окружающей среды от +10°С до +25°С.
Хранить Ni-MH аккумуляторы нужно в сухом прохладном месте при температуре немного ниже комнатной, заряженным на 40%. Раз в 1-2 месяца следует проводить дозаряд, разряд и снова заряд на 30-60% емкости. Допустимо хранение сроком до 5-ти лет.
Литий-ионные аккумуляторы
Литий является химически самым активным металлом и используется именно в самых компактных системах для мобильной техники. Литиевые катоды используются практически во всех батареях с большой емкостью. Эти батареи имеют самое высокое номинальное напряжение. В зависимости от катода, литий-содержащие элементы имеют выходное напряжение от 1,5 В до 3,6 В!
В литий-ионных элементах ионы лития связаны молекулами других материалов. Типичный Li-Ion-аккумулятор имеет угольный анод и катод из литийкобальтдиоксида, LiCoO2, или оксида лития-марганца. Литий-кобальтовые пластины служат дольше, а литий-марганцевые значительно дешевле. Электролит в своей основе имеет раствор солей лития.
Наиболее продвинутая технология, используемая сегодня при создании аккумуляторов - ЛИТИЙ-ПОЛИМЕРНАЯ.
Главным преимуществом литий-полимерных батарей является отсутствие жидкого электролита. Анод отделен от катода полимерной перегородкой, композитным материалом, таким как полиакрилонитрит, который содержит литиевую соль.
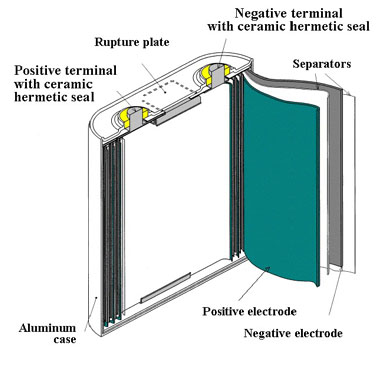


Обычными формами упаковки для литий-полимерных элементов являются плоские пластины или бруски
(призматический корпус).
При разрядке и заряде ионы лития Li+ перемещаются через разделительный слой с одного электрода на другой.
На аноде: Lix/графит → Li+ + e– + Lix-1/графит
На катоде: Li+ + e– + Li1-xCoO2 → LixCoO2
При разряде аккумулятора на положительном электроде происходит интеркаляция лития в оксид и деинтеркаляция из углеродного материала на отрицательном. Таким образом, процессы заряда-разряда сводятся к переносу ионов лития с одного электрода на другой, отсюда и название "литий-ионные" аккумуляторы.
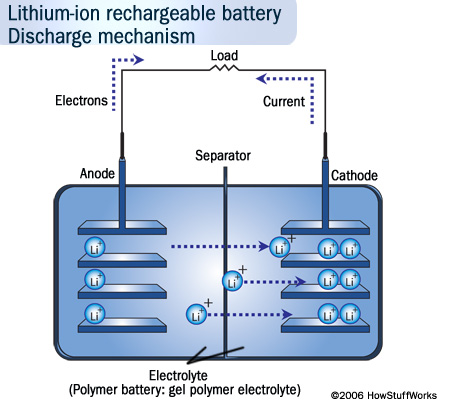
Один элемент Li-ионного аккумулятора дает на клеммах напряжение 3,7 В, поэтому во многих приложениях достаточно одного единственного элемента. Примерно такое же напряжение вырабатывают три NiCd или NiMH элемента.

www.howstuffworks.com
Преимущества литиевого аккумулятора: легкий; не содержит токсичных материалов; отсутствует эффект »памяти»; большая удельная емкость по сравнению с ранее рассмотренными элементами.
Недостатки:
дорогой; литий и его соединения –
агрессивные вещества; т ребуется
электронное устройство контроля внутри
аккумулятора от перезарядки; бракованные
аккумуляторы могут взрываться.
ребуется
электронное устройство контроля внутри
аккумулятора от перезарядки; бракованные
аккумуляторы могут взрываться.
ТОПЛИВНЫЕ элементы
Топливные элементы представляют собой специализированные химические реакторы, предназначенные для прямого преобразования энергии, высвобождающейся в ходе реакции окисления топлива, в электрическую энергию.
Топливные элементы питания - электрохимические элементы, требующие в процессе работы постоянного расходования электродного вещества.
Принципиальные отличия от гальванических батарей:
Во-первых, в топливных элементах используются не расходуемые в процессе работы электроды,
во-вторых, необходимые для проведения реакции вещества подаются извне, а не закладываются внутрь элемента изначально
Теория топливных элементов была разработана в 1839 году английским ученым Вильямом Гроувом,
в 60-х годах ХХ века НАСА начало использовать топливные элементы в космосе.
Принцип действия топливного аккумулятора на примере элемента на кислороде и водороде. В таком элементе происходит поглощение водорода и кислорода в присутствии щелочного раствора.
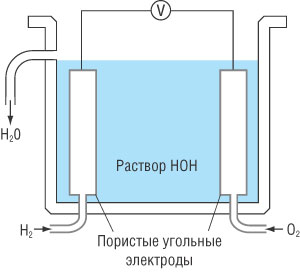
Кислород и водород поступают в элемент сквозь пористые угольные электроды, а электродные реакции описываются уравнениями:
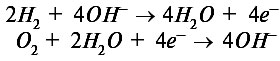
В результате окислительно-восстановительных необратимых реакций образуется вода.
Реакция окисления-восстановления происходит она не на электродах, а в топливе. Масса электродов в процессе работы никогда не меняется, а топливо служит в качестве источника свободных электронов.
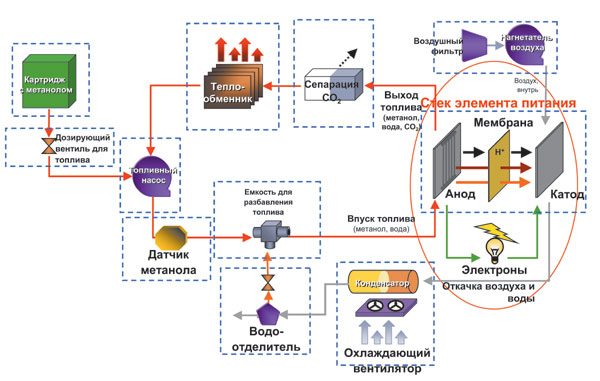
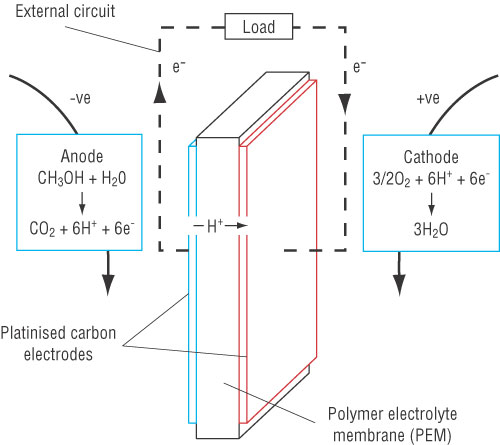
Технология топливных батарей на метаноле (Direct Methanol Fuel Cell, DMFC) - самая перспективная технология топливных элементов в настоящее время.
Топливо - метиловый спирт, или метанол (CH3OH).
На аноде топливного элемента, выполненного из пластинчатого углерода, происходит реакция окисления метанола, в результате которой образуются электроны, необходимые для создания постоянного тока. Побочными продуктами реакции окисления являются углекислый газ и протоны (H+):
CH3OH + H2O → CO2 + 6H+ + 6ē
На катоде из пластинчатого углерода происходит реакция восстановления кислорода воздуха, в результате которой образуется вода:
![]()
В DMFC-топливном элементе окислительная и восстановительная реакции физически разделены с помощью ионной полимерной мембраны (Polymer Electrolyte Membrane, PEM), пропускающей протоны от анода к катоду. Структурная схема DMFC-топливного элемента:
В метаноловом топливном элементе метанол разлагается на углекислый газ и воду:
![]()
Типичная схема DMFC-элемента содержит несколько субкомпонентов, таких как картридж с топливом, датчик метанола, насос для обеспечения циркуляции топлива, воздушный насос, теплообменник и т.д