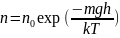- •Макроскопическая система, макроскопические параметры. Идеальный газ, уравнение состояния идеального газа.
- •Законы идеальных газов: Бойля-Мариотта, Гей-Люссака, Авогадро, Дальтона.
- •Внутренняя энергия идеального газа. Степени свободы. Теорема о равномерном распределении кинетической энергии по степеням свободы.
- •Основное уравнение молекулярно-кинетической теории. Средняя кинетическая энергия молекул, молекулярно-кинетический смысл температуры.
- •Ф ункция распределения молекул по скоростям. Распределение Максвелла.
- •Идеальный газ в поле силы тяжести. Барометрическая формула. Распределение Больцмана.
- •Явления переноса. Среднее число столкновений и средняя длина свободного пробега молекул.
- •Явления переноса. Вязкость, теплопроводность и диффузия газов.
- •Макроскопическая работа, количество тепла. Первое начало термодинамики.
- •Первое начало термодинамики. Применение его для различных процессов.
- •Теплоемкость. Теплоемкость идеальных газов. Уравнение Майера.
- •Адиабатический процесс. Уравнение Пуассона.
- •Круговые процессы. Тепловой двигатель. Цикл Карно и теорема Карно.
- •Второе начало термодинамики. Равенство Клаузиуса, энтропия. Энтропия идеального газа.
- •Реальные газы. Уравнение Ван-дер-Ваальса.
- •Электрический заряд, его свойства. Закон Кулона. Электрическое поле, напряженность электрического поля, принцип суперпозиции. Напряженность поля точечного заряда и системы зарядов.
- •Энергия взаимодействия электрических зарядов. Энергия и плотность энергии электрического поля.
- •Конденсаторы. Емкость и энергия конденсатора. Емкость плоского, цилиндрического и сферического конденсаторов. Последовательное и параллельное соединение конденсаторов.
- •Поляризация диэлектриков, типы поляризации. Вектор поляризации. Объемные и поверхностные поляризационные заряды, их связь с вектором поляризации.
- •Работа сил электрического поля. Закон Джоуля-Ленца (в дифференциальной и интегральной формах).
- •Переходные процессы в цепи с конденсатором. Разрядка и зарядка конденсатора. Время релаксации (установления).
- •Классическая электронная теория металлов. Основные положения и обоснование законов Ома и Джоуля-Ленца. Затруднения теории.
- •Электрический ток в вакууме. Термоэлектронная эмиссия. Формула Ричардсона-Дешмана. Закон “трех вторых”.
Макроскопическая система, макроскопические параметры. Идеальный газ, уравнение состояния идеального газа.
Макроскопическая система - система, состоящая из большого числа частиц.
Макроскопические параметры – параметры значения, которых можно определить с помощью приборов, ничего не зная об атомно-молекулярном строении вещества (давление, объем, температура).
Идеальным называют газ, взаимодействием, между молекулами которого можно пренебречь.
У![]()
![]() равнения
состояния идеального газа:
равнения
состояния идеального газа:
Законы идеальных газов: Бойля-Мариотта, Гей-Люссака, Авогадро, Дальтона.
Закон Бойля-Мариотта: При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно. Формула: pV = const
Закон Гей-Люссака: при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуре. Формула: V/T=const
Закон Авогадро: в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
З![]() акон
Дальтона: Давление смеси химически не
взаимодействующих идеальных газов
равно сумме парциальных давлений.
акон
Дальтона: Давление смеси химически не
взаимодействующих идеальных газов
равно сумме парциальных давлений.
Внутренняя энергия идеального газа. Степени свободы. Теорема о равномерном распределении кинетической энергии по степеням свободы.
В теории идеального
газа потенциальная энергия взаимодействия
молекул считается равной нулю. Поэтому
внутренняя энергия идеального газа
определяется кинетической энергией
движения всех его молекул. Формула:
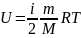
Степени свободы — характеристики движения механической системы. Число степеней свободы определяет минимальное количество независимых переменных, необходимых для полного описания движения механической системы.
В состоянии термодинамического равновесия на каждую степень свободы движения частиц вещества приходится кинетическая энергия в среднем, равная kT/2.
Основное уравнение молекулярно-кинетической теории. Средняя кинетическая энергия молекул, молекулярно-кинетический смысл температуры.
О![]() сновное
уравнение МКТ связывает макроскопические
параметры газовой системы с
микроскопическими.
сновное
уравнение МКТ связывает макроскопические
параметры газовой системы с
микроскопическими.
Средняя кинетическая
энергия молекул:
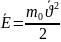
Температура определяется через микроскопические характеристики системы и служит мерой энергии неупорядоченного движения частиц.
Ф ункция распределения молекул по скоростям. Распределение Максвелла.
Распределение Максвелла - распределение вероятности, встречающееся в физике и химии. Оно лежит в основании кинетической теории газов, которая объясняет многие фундаментальные свойства газов, включая давление и диффузию.
Идеальный газ в поле силы тяжести. Барометрическая формула. Распределение Больцмана.
В идеальном газе, находящемся во внешнем поле сил, каждая отдельная частица приобретает импульс в направлении силы, а также соответствующую потенциальную энергию. Однако в газе наряду с упорядоченным движением в направлении действия силы существует хаотическое тепловое движение. В результате конкуренции между этими двумя типами движений возникает неравномерное распределение макроскопических параметров: плотности частиц, давления, температуры по объему, занимаемому газом.
Б![]() арометрическая
формула — зависимость давления или
плотности газа от высоты в поле тяжести.
арометрическая
формула — зависимость давления или
плотности газа от высоты в поле тяжести.
В присутствии
гравитационного поля (или, в общем
случае, любого потенциального поля) на
молекулы газа действует сила тяжести.
В результате, концентрация молекул газа
оказывается зависящей от высоты в
соответствии с законом распределения
Больцмана: