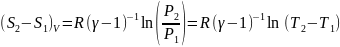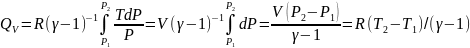- •Физика коллоквиум 19.12.11
- •Уравнение состояние идеального газа.
- •Давление. Основное уравнение молекулярно-кинетической теории.
- •Температура.
- •Внутренняя энергия. Теплота и работа. Первое начало термодинамики.
- •Распределение молекул газа по скоростям. Функция распределения Максвелла.
- •Наиболее вероятная, средняя квадратичная и средняя арифметическая скорости молекул газа.
- •Распределение Максвелла по значениям кинетической энергии.
- •Формула Максвелла по значениям кинетической энергии.
- •Изобарный процесс.
- •Изотермический процесс.
- •Адиабатный процесс.
- •Обратимый цикл Карно.
Внутренняя энергия. Теплота и работа. Первое начало термодинамики.
Процесс перехода механической энергии, расходуемой на сжатие или расширение идеального газа, во внутреннюю энергию его молекул.
При расширении V
газа на малую величину dV
последний совершает работу
δ
A
над внешними телами или окружающей
средой:
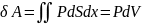
Газ может совершать работу только за счет расходования своей внутренней энергии и возможного притока тепловой энергии δQ в него из внешней силы.
Закон сохранения энергии – Первое начало термодинамики:
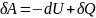
Внутренняя энергия U данной массы M идеального одноатомного газа – суммарная кинетическая энергия молекул, которая определяется температурой:
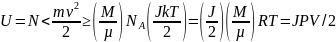
Если какая-либо система меняет свои макроскопические параметры без теплообмена с внешними силами, то такой процесс называется адиабатным.
Теплота — мера энергии, переходящей от одного тела к другому теплопередачей.
Распределение молекул газа по скоростям. Функция распределения Максвелла.
Если газ находится в равновесии, молекулы движутся хаотически, и все направления их движения равновероятны. Скорости молекул могут быть самыми различными по модулю и при каждом соударении с другими молекулами изменяются случайным образом.
В газе, находящемся в состоянии равновесия, устанавливается стационарное распределение молекул по скоростям, подчиняющееся определенному статистическому закону. Этот закон был выведен теоретически Дж. Максвеллом. Максвелл предполагал, что вещество состоит из очень большого числа тождественных молекул, находящихся в состоянии беспорядочного теплового движения при одинаковой температуре. Также предполагалось, что силовые поля на газ не действуют.
Закон Максвелла описывается некоторой функцией f(v), называемой функцией распределения молекул по модулям скоростей. Если разбить диапазон скоростей молекул на малые интервалы, равные dv, то на каждый интервал скорости будет приходиться некоторое число молекул dN(v), скорости которых заключены в этом интервале.
Функция f(v) определяет относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv, то есть:
dN(v)/N=f(v)dv, откуда f(v)=dN(v)/Ndv (28)
Применяя методы теории вероятностей, Дж. Максвелл нашел вид функции распределения молекул идеального газа по модулям скоростей хаотического движения:
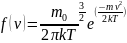
Наиболее вероятная, средняя квадратичная и средняя арифметическая скорости молекул газа.
Средняя квадратичная скорость : равна квадратному корню из среднего квадрата скорости молекул:

Наиболее
вероятная скорость:  —
вероятность обладания которой любой
молекулой системы максимальна, и которая
соответствует максимальному значению f(v):
—
вероятность обладания которой любой
молекулой системы максимальна, и которая
соответствует максимальному значению f(v):
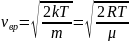
Средняя арифметическая скорость:
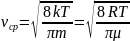
Распределение Максвелла по значениям кинетической энергии.
Формула Максвелла по значениям кинетической энергии.
Используя соотношения
 получаем распределение
по кинетической энергии:
получаем распределение
по кинетической энергии:

Поскольку в равновесии все направления движения молекул равновероятны, то следует выражение для средней кинетической энергии:

Хаотическая энергия движения микрочастиц в равновесии равномерно распределяется по всем возможным степеням свободы движения микрочастиц.
В основе классической статистической физики лежит постулат о равномерном распределении энергии по всем степеням свободы. Постулат гласит, что на каждую степень свободы сложной системы, находящейся в равновесном состоянии, приходится в среднем энергия, равная kt/2. Средняя энергия одной молекулы газа:

Барометрическая формула.
Если выделенный V газа находится в покое, то действующая на него суммарная сила должна быть равна нулю. Это значит, то разность давлений на двух высотах должная быть равна весу газа, находящегося между этими высотами:
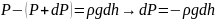
Из уравнения состояния получим:
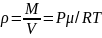
Подставив и проинтегрируем, получим Барометрическое уравнение:
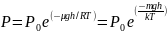
Распределение Больцмана.
В присутствии гравитационного поля (или, в общем случае, любого потенциального поля) на молекулы газа действует сила тяжести. В результате, концентрация молекул газа оказывается зависящей от высоты в соответствии с законом распределения Больцмана:
n = n0exp( -mgh / kT )
Теплоемкость газа. Формула Майера.
Теплоемкость – величина, равная количеству подводимой к телу тепловой энергии, необходимой для изменения его температуры на один кельвин:
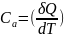
Теплоемкость – характеристика не только вещества, но и процесса подвода тепла.
Уравнение Майера – связь между двумя теплоемкостями идеального газа:

Через показатель адиабаты:
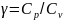
Изохорный процесс
Поскольку состояние данной массы газа характеризуется тремя параметрами, связанными уравнением состояния, то можно один из параметров фиксировать, а два других при этом будут связаны однозначной зависимостью.
Изохорный процесс – процесс, происходящий при постоянном объеме, а давление и температура подчиняются закону Шарля.
Подведенное тепло в изохорическом процессе идет на увеличение внутренней энергии газа, что выражается в росте его температуры.
Т.к не изменяется объем, произведенная работа равна нулю. Изменение энтропии и подведенное количество тепла равны: