
3.1. Протеїнази.
- пепсин - гідролізує переважно пептидні зв’язки, що утворені аміногрупою тирозину та фенілаланіну.
Міститься в слизовій оболонці шлунку; кристалічний препарат має дуже високу активність: 1 г його за 2 години розкладає 50 кг звареного білку яйця та створожує 100 000 л молока. В організмі знаходиться у вигляді пепсиногену, вивільняється під впливом соляної кислоти. 10(206) Пепсин використовують для підкорми поросят віком 2 – 4 місяців, у яких ферментативні системи, що здійснюють травлення, розвинені недостатньо;
- трипсин - розщеплює пептидні зв’язки, утворені карбоксильною групою лізину та аргініну.
Міститься у соці підшлункової залози. В організмі знаходиться у вигляді трипсиногену. Вивільняється під впливом ентерокінази.
Пепсин і трипсин використовують для лікування захворювань травного тракту;
- ренін - розщеплює пептидні зв’язки між фенілаланіном та метіоніном в казеїні.
Міститься в четвертому відділі шлунку теляти (сичузі), називається сичужним ферментом. Застосовується для створожування молока у виробництві сиру шляхом перетворення розчиненного білка казеїногену в нерозчинний осад казеїнату кальцію. 1 г сичужного ферменту досить для створожувння 4 550 л молока;
- хімотрипсин - розщеплює пептидні зв’язки, утворені карбоксильною групою тирозину та фенілаланіну
Міститься в підшлунковій залозі, діє на пептидні зв’язки, утворені карбоксильною групою тирозину та фенілаланіну. 13(66) Трипсин і хімотрипсин вживають для обробки ран, опіків, гангренозних уражень. Хімотрипсин – при гнійному запаленні легень. Ці ферменти розщеплюють білки загиблих клітин, що утворюють гній.
- папаїн - рослинний протеолітичний фермент. Отримують у вигляді сухого порошку з соку плодів динного дерева (Carica papaya). Міститься також в дріжджах. Активується сульфгідрильними сполуками. Особливу роль відіграє при цьому відновлений глутатіон. Він передає водень до окисленої форми ферменту, і, відновлюючи його, переводить у активний стан, що негативно впливає на зберігання дріжджів. відновлений глутатіон підвищує протеолітичну активність дріжджів, прискорюючи процес їх автолізу і зменшуючи цим їх термін зберігання. Для попередження цього необхідне переведення глутатіону в окислену форму шляхом підвищення кислотності середовища та додавання окислювачів.
3.2. Пептидази.
- амінопептидази – розщепляють пептидний зв’язок, що знаходиться поряд із вільною аміногрупою. Для дії амінопептидаз необхідна наявність в молекулі субстрату вільної -аміногрупи.
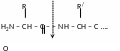
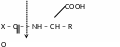
- карбоксипептидази – розщепляють пептидний зв’язок, що знаходиться поряд із вільною карбоксильною групою.
- дипептидази – каталізують гідролітичне розщеплення дипептидів на вільні амінокислоти.

дипептидаза
H2N – CH2 – CO – – NH – CH2 – COOH + H2O 2CH2(NH2) – COOH
гліцингліцил глікокол
За допомогою протеолітичних ферментів змінюють якісні показники борошна. Борошно з високим вмістом клейковини з твердих сортів пшениці найкраще для випікання хліба, але з нього не можна виготовити печиво або бісквіти. Обробка такого борошна протеазами приводить до часткового розщеплення білка, тому розширюється можливість використання борошна для кондитерських виробів, поліпшується їх якість, скорочується процес замішування.
Протеолітичні ферменти використовуються у м’ясній промисловості. Вони частково розщеплюють білки і прискорюють дозрівання м’яса, роблять його більш м’яким і ніжним, поліпшують смак, підвищують соковитість. Тривалість дозрівання м’яса скорочується в декілька разів.
4. Амідази – каталізують гідроліз амідів (уреаза, аргіназа, аспарагіназа, глютаміназа).
- уреаза – розщеплює сечовину на аміак та діоксид вуглецю;
- аспарагіназа – каталізує гідролітичне розщеплення аспарагіну на аспарагінову кислоту та аміак;
- глютаміназа – каталізує гідролітичне розщеплення глютаміну на глютамінову кислоту та аміак;
- аргіназа – каталізує гідролітичне розщеплення L-аргініну на орнітин та сечовину.
Четвертий підклас: амідази – діють на CN зв’язки, уреаза – діє на сечовину.
NH2
– CO – NH2
+ H2O
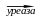 2NH3
+ CO2
2NH3
+ CO2
Аспарагіназа, глутаміназа – розщеплюють аспарагін і глутамін до аспарагінової та глутамінової кислоти і аміаку
ІV. Ліази.
Каталізують реакції негідролітичного розщеплення органічних сполук, тобто приєднання груп по місцю приєднання подвійного зв’язка, чи відщеплення груп з утворенням подвійного зв’язка.
С-С-ліаза С-О-ліаза
С-N-ліаза С-S-ліаза
Ліази.
Ці ферменти поділяються на підкласи в залежності від типу зв’язку на який вони діють.
Перший підклас: ліази, які діють на зв’язок між двома атомами вуглецю –С – С-
Декарбоксилази
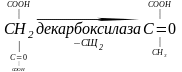
Піруватдекарбоксилаза відщеплює СО2 від кислоти, декарбоксилює піровиноградну кислоту. Відщеплення СО2 перетворює її у оцтовий альдегід.
Кокарбоксилаза – є активною групою декарбоксилази, вона являє собою дифосфат (пірофосфат) тіаміну (вітаміну В1).
Другий підклас: ліази, які діють на зв’язок – С – О - .
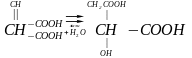
фумарова яблучна
кислота кислота
Ліази цього підкласу називаються гідротази.
Найбільш важливим ферментом цього класу є альдолаза. Цей фермент утворює гексозу (фруктозу) двох тріоз і цей же фермент у процесі життєдіяльності розкладає гексози на тріози.
альдолаза


Фруктозо –1,6 – Р 3-Р –гліцериновий альдегід + р – диоксиацетон
Енолаза створює енальні форми речовин. Він утворює еналпіровиноградну кислоту з гліцеринової кислоти.
V. Ізомерази.
(каталізують реакції ізомерізації, тобто перетворення органічних сполук в їх ізомери).
Ізомерази.
Процес утворення ізомерів. Під дією цих ферментів ідуть реакції перетворення моносахаридів та інших сполук.
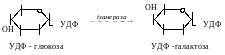
VІ. Лігази (синтетази).
Каталізують реакції синтезу з використання енергії макроергічних сполук (АТФ). При цьому утворюються зв’язки С-С, С-N, С-О).
Лігази ( синтетази).
Ці ферменти поділяються на підкласи в залежності від типу зв’язку, який утворюється.
Перший підклас: каталізують утворення зв’язку між С і N.
Пептидсентитази – каталізує утворення пептидного зв’язку, ця реакція потребує багато енергії.
Другий підклас: каталізує утворення зв’язку – С – С – . Карбоксилази – затрата енергії.
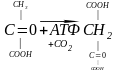
щавлевооцтова кислота
Третій підклас: ферменти, які каталізують утворення зв’язку– С – S – , в цих реакціях приймає участь К0А.
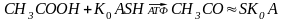
ацетил К0А
Лігази
Лігази – ферменти, що каталізують з’єднання двох молекул, що супроводжується розщепленням пірофосфатного зв’язку в АТФ та інших нуклеозидтрифосфатах.
1. Лігази, що утворюють C–N-зв’язок.
- глютамінсинтетаза – каталізує реакцію синтезу глютаміну з глютамінової кислоти та аміаку.
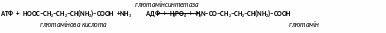
- аспарагінсинтетаза – каталізує реакцію синтезу аспарагіну з аспарагінової кислоти та аміаку.
2. Лігази, що утворюють C–S-зв’язок – ферменти, що утворюють C–S-зв’язок між залишком карбонової кислоти та КоА.
- ацетилкоензим А -синтетаза – каталізує приєднання залишків різних органічних кислот до коензиму А.
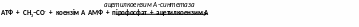
3. Лігази, що утворюють C–C-зв’язок – карбоксилази.
Карбоксилази при участі АТФ каталізують приєднання діоксиду вуглецю до різних органічних кислот, тобто реакцію подовження вуглецевого ланцюгу.
- піруваткарбоксилаза каталізує синтез щавелевооцтової кислоти з піровиноградної:
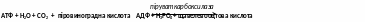
4. Лігази, що утворюють C–O-зв’язок – ферменти, що каталізують приєднання залишків амінокислот до т-РНК (відіграють віжливу роль в біосинтезі білка).
- аланіл-тРНК-синтетаза
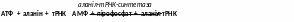
Ліази
Ліази каталізують негідролітичне відщеплення від субстрату певних груп з утворенням подвійного зв’язку, або приєднання групи до подвійного зв’язку.
Найбільше значення мають енолаза, альдолаза, піруватдекарбоксилаза. Здійснюють найважливіші етапи розкладу глюкози в процесі бродіння та дихання.
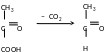
– піруватдекарбоксилаза каталізує розщеплення ПВК на оцтовий альдегід та вуглекислий газ.
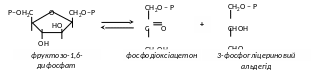
– альдолаза каталізує розпад фруктозодифосфата на фосфодіоксіацетон та фосфогліцериновий альдегід та зворотну реакцію.
12(156) – енолаза каталізує перетворення 2-фосфофгліцеринової кислоти у фосфоенолпіровиноградну:
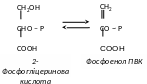
Ізомерази
Ізомерази – каталізують перетворення органічних сполук в їх ізомери.
1. Рацемази – діють на субстрати з одним асиметричним атомом, наприклад бактеріальна рацемаза перетворює L-амінокислоти в D-амінокислоти.
2. Епімерази – діють на субстрати з декількома асиметричними атомами.
– тріозофосфат-ізомераза бере участь у процесі бродіння, каталізує перетворення 3-фосфогліцеринового альдегіду в фосфодіоксіацетон:
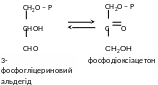
- глюкозофосфат-ізмераза каталізує взаємне перетворення глюкопіранозо-6-фосфату та фруктофуранозо-6-фосфату.

Локалізація ферментів у клітині
Ферменти виявлено у всіх структурних компонентах клітини. Внутрішньоклітинна локалізація ферментів безпосередньо пов’язана з функцією, яку виконує дана структура і природою хімічних процесів, які в ній відбуваються.
Мітохондрії – протікають аеробні процеси, що забезпечують клітину енергією, тому знаходяться ферменти дихального ланцюга, ферменти циклу Кребса та β-окислення жирних кислот.
Ядро – відбувається синтез нуклеотидів та НК, містить ферменти, що відповідають за їх синтез (ДНК-полімераза).
Рибосоми – ферменти, що каталізують синтез білка.
Лізосоми – містять гідролази, оскільки там відбуваються процеси деструкції органічних сполук.
Цитоплазма – ферменти гліколізу, біосинтезу ліпідів, вуглеводів, амінокислот.
Ферменти
Фермент
Апофермент
Кофермент
Кофактор
Вітамін.Відмінності між коферментами (НАД+) та кофакторами(ФМН)
Використання ферментів.
Вони застосовуються в усіх галузях харчової промисловості.
при випіканні хліба – це поліпшує його якість та смак і аромат. Прискорюють процеси визрівання тіста і значно зменшують витрати цукру на виготовлення булочних виробів. Наприклад: амілаза застосовується у виробництві спирту із зерно-картопляної сировини (для перетворення крохмалю в цукор раніше застосовували солод (в будь-якій сировині, в тому числі у житі є багато амілаз, але вони знаходяться у вигляді неактивної форми у зв”язаному вигляді, коли зерно пророщують комплекс руйнується і амілаза активізується). Цей спосіб оцукрування крохмалю дорогий, тому за допомогою мікробів роблять дешеві амілази і застосовують їх для цього. Ці продукти називаються амінолітичні препарати, вони мають різні ступені очистки. Дуже чистих препаратів немає.
Преперати амілази використовують у хлібопекарському виробництві для розкладу зернового крохмалю.
В молочній промисловості – при виготовлені кефірів, ряжанок, сметани. Хімозин – зумовлює зсідання молока, використовується в сироварінні.
В м’ясній промисловості – застосовуються протеолітичні ферменти (пептидгідролази), які розщеплюють білки і прискорюють визрівання м’яса. При дозріванні яловичини (10-14 діб), а при застосуванні ферментів 1-2 доби. При дозріванні м”яса необхідно щоб білки трохи розкладались. Ці ферменти також використовують при варці м”яса. Данні ферменти застосовують у технології шкір (для зневоложення шкір). У деяких країнах для зняття волосся використовують кератиназу.
При зберіганні м’яса, фруктових соків та інших продуктів застосовують фермент глюзооксидазу – антиокислювач., Інвертаза використовується для виготовлення кондитерських виробів.
В пивоварінні та виробництві спирту застосовують амілази. В пивоварінні за рахунок ферментів зберігається 160гр. ячменю при виробництві кожного декалітру пива.
В тваринництві, при силосуванні кормів.
В хімічній промисловості.
В медицині, з метою лікування і діагностики.
6. ВИКОРИСТАННЯ ФЕРМЕНТІВ У ХАРЧОВИХ ТЕХНОЛОГІЯХ
Використання ферментів
Препарати амілази використовують при випіканні хліба для прискорення дозрівання тіста, зменшення витрат цукру на виготовлення булочних виробів.
Ферменти, які спричиняють молочнокисле бродіння, застосовують при виготовленні кисломолочних продуктів: кефіру, ряжанки тощо.
Протеолітичні ферменти застосовують у м'ясній промисловості для розщеплення білка і прискорення дозрівання м'яса (замість 10-14 днів до 1-2 днів).
Фермент хімозин, який виділяють із слизової оболонки сичуга, зумовлює зсідання білків молока і використовується у сироварінні.
Глюкозооксидаза використовується для зберігання м'яса, фруктових соків та інших продуктів, що швидко псуються.
Пектиназа використовується для підвищення виходу соку з плодів і ягід.
Ряд ферментів - пепсин, трипсин, лізоцим, фібринолізин, стрептокіназа, урокіназа, гіалуронідаза та ін. застосовують в медичній практиці
Нові терміни, поняття: водо- та жиророзчинні вітаміни, антивітаміни, вітаміноподібні речовини, авітаміноз, гіповітаміноз, гіпервітаміноз, гормони
Ферменты в пищевых технологиях: вчера, сегодня, завтра
Человечество использует ферменты для приготовления продуктов питания с незапамятных времен. Эмпирическим путем люди выяснили, что существуют природные субстраты, которые при внесении их в тот или иной вид сырья вызывают в нем желательные изменения. Такими субстратами были соки растений и ткани животных, содержащие ферменты, а также виноградный сок, молоко, тесто, самопроизвольно сбродившие в результате попадания в них микроорганизмов. Например, для получения сыра использовали соки растений, содержащие фермент фицин, или ткани желудка птиц и животных, содержащие фермент ренин. Для тендеризации мяса (размягчения мышечной ткани) использовали сок папайи, содержащий фермент папайи.
Изучать ферменты начали в XVIII в.. когда были открыты пищеварительные ферменты, выделены ферменты из биологических объектов: пероксидаза из хрена, и α-амилаза из зерна и др. В ХIX в. получены первые чистые формы ферментов и предложен термин «энзим» (от греч, enzymos - связанный с брожением теста). Возникновение энзимологии как самостоятельной научной дисциплины стало возможным с развитием химии, биологии и медицины.
При изучении механизма действия ферментов было высказано предположение, что ферменты образуют комплексы с субстратами. Для объяснения пространственного взаимодействия между ферментом и субстратом Э. Фишер предложил модель «ключ к замку».
Наибольший вклад в развитие энзимологии был сделан в XX в. Были разработаны теория фермент-субстратного комплекса и первая математическая модель для описания ферментативной кинетики.
Однако вопрос о том. как ферменты ускоряют химические реакции, оставался не выясненным до возникновения теории переходного состояния. В 1948 г. Л. Полинг предположил, что каталитическое действие ферментов достигается стабилизацией переходного состояния химических реакций путем взаимодействия с активным центром фермента, что было в дальнейшем подтверждено экспериментально. В 50-60 гг. XX в. был пересмотрен вопрос субстратной специфичности ферментов. Согласно гипотезе «индуцированного соответствия» (модель Кошланда) ферментная активность может регулироваться небольшими молекулами, отличными от молекул субстрата или продуктов реакции. Было показано существование аллостеричных ферментов, разработаны методы регуляции активности ферментов.
Было установлено, что катализ тесно связан с молекулярными взаимодействием между молекулами субстрата и компонентами молекул фермента, а природа и последовательность этих взаимодействий определяются механизмом реакции.
Начало изучения структуры ферментов было положено работой Д. Самнера, который впервые установил белковую природу ферментов. За 20 лет, прошедших после его открытии, было описано более 130 кристаллических ферментов.
В середине XX в. методы рентгеновской кристаллографии и ядерно-магнитного резонанса стали использовать для изучения каталитических свойств ферментов и особенностей фермент-субстратных взаимодействий.
В конце столетия появилась возможность открывать и создавать новые ферменты, ранее не существовавшие в природе, получать микроорганизмы-продуценты ферментов с необходимыми для человека свойствами, идентифицировать ранее неизвестные ферменты, изучить их и модифицировать: изменять аминокислотную последовательность первичной структуры ферментов, а также модифицировать химические группы ферментов, участвующие в образовании фермент-субстратного комплекса.
Достижения современной энзимологии значительно расширили возможности применения ферментов в первую очередь в медицине и пищевой промышленности, где их используют практически во всех отраслях (табл. 1). Это обусловлено их преимуществами по сравнению с химическими катализаторами: избирательностью и стерео-специфичностью действия, возможностью достижения высоких скоростей превращения субстратов при относительно мягких условиях технологии, безвредностью для окружающей среды и человека.
Ферменты не являются чужеродными для организма человека веществами. В пищевых технологиях используют в основном ферменты, присутствующие в пищевом сырье, которые поступают в организм человека при потреблении свежих фруктов и овощей, орехов, молока, сброженных и консервированных продуктов. В пищевых продуктах ферментов содержится мало - миллиграммы на килограмм продукта. При кулинарной и технологической обработке пищевых продуктов ферменты, как правило, инактивируются.
Продолжается поиск новых возможностей использования ферментов в пищевой промышленности. Основными направлениями исследования являются:
модификация свойств индивидуальных ферментов с целью повышения их активности и удешевления целевых продуктов;
скрининг новых микроорганизмов-продуцентов ферментов;
получение новых рекомбинантных ферментов с заданными свойствами;
применение ферментативных реакций для получения ценных пищевых ингредиентов и биологически активных веществ;
разработка пищевых нанотехнологий с использованием ферментов.
Современные методы модификации ферментов позволяют увеличивать стойкость ферментов к действию различных химических реагентов и ингибиторов, рН, температурному воздействию; изменять рН оптимума ферментов, их субстратную специфичность и связывающие свойства; регулировать предпочтения определенных металлов-кофакторов и каталитические свойства ферментов.
Химическая модификация - наиболее известный вид модификации ферментов [1.2]. Ее методы должны отвечать следующим требованиям:
используемые химические реагенты должны быть безвредными (особенно в случаях дальнейшего использования ферментов в пищевых технологиях);
условия модификации не должны быть жесткими, приводящими к ухудшению свойств ферментов; модифицированные ферменты должны отделяться от реакционной среды относительно простыми и недорогими способами;
применение модифицированных ферментов должно быть экономически выгодным.
Отрасль |
Этапы технологически» процессов и технологические цели применения ферментов |
Технология переработки зерна |
Повышение выхода муки и круп, улучшение качества клейковины, производство модифицированной муки зернобобовых |
Хлебопечение |
Сокращение расхода муки, улучшение теста, замедление черстеения изделий, улучшение цвета корочки, производство охлажденного и замороженного теста |
Пивоварение |
Использование неосоложенного сырья, разжижение, усиление ферментируемое™, улучшение фильтрации, контроль содержания ззота, получение низкокалорийного пива, стабилизация пива |
Технология молочных продуктов |
Коагуляция молока, замена сычужного фермента в производстве сыра, модификация молочного белка, создание сырного аромата, получение ферментативно модифицированных сыров, удаление перекиси водорода, получение молочного сахара |
Производство вина, фруктовых соков, газированных напитков, консервов |
Осветление, мацерация сырья, удаление крахмала из сока, увеличение выхода, получение сладких ликеров, стабилизация вин и соков, производство соков с мякотью и пюре |
Переработка крахмала |
Увеличение выхода, модификация крахмала, разжижение, осахаривание, получение глюкозо-фруктовых и зерновых сиропов |
Спиртовая промышленность |
Конверсия сырья, разжижение крахмала, осахаривание, улучшение роста дрожжей, увеличение выхода спирта |
Производство кофе |
Сепарация зерен, контроль вязкости зкетрактов, улучшение вкуса и аромата |
Производство белков |
Гидролиз белков и полисахаридов, снижение вязкости, производство модифицированных пептидов и белков |
Производство сахара |
Удаление крахмала, белков и полисахаридов |
Производство ароматизаторов |
Синтез тонких ароматов, получение натуральных ароматических эфиров и т. д. |
Производство масел и жиров |
Увеличение выхода, модификация жиров, экстракция масла, получение биологически активных веществ (лецитина, токоферолов, каротинов и др.) |
Технология мясопродуктов |
Увеличение выхода, тендеризация мыса, получение мясных экстрактов, текстуризация белков, продление сроков хранения |
Производство растительных экстрактов |
Увеличение экстрактивности, сокращение длительности экстракции, улучшение фильтрации, повышение выхода пигментов, производство чая и чайных экстрактов, сокращение времени экстракции, усиление аромата и цвета |
Производство пектина |
Упрощение технологии, увеличение выхода, регулирование степени этерификации |
Примером химической модификации служит модификация ферментов в условиях неполярной (не водной) среды. Происходящее при этом снижение активности воды в реакционной системе существенно изменяет свойства ферментов: реакция сдвигается в сторону синтеза; образуются оптически активные продукты; повышается термостабильность фермента и стабильность при хранении; фермент приобретает способность катализировать новые реакции, не протекающие в водной среде (синтез пептидов, алифатических амидов и др.); ферменты проявляют активность в органических растворителях при температуре выше 100 °С.
Данный способ химической модификации использован при модификации таких ферментов, как липазы [3-5], химотрипсин [6], трипсин [7], субтилизин [8], термолизин [9], полифенолоксидазы [10], глюкоамилазы [11], папаин [12], химозин [13].
С помощью физико-химических методов модификации изменяют силы электростатического взаимодействия, водородные связи и гидрофобные взаимодействия в молекулах белков. Например, широко используемый для изомеризации глюкозы в фруктозу фермент ксилозоизомераза модифицируется в направлении увеличения его термостабильности, снижения значения рН оптимума, изменения предпочтения активирующего катиона металла, изменения субстратной специфичности от ксилозы к глюкозе [14, 15].
К активно развивающимся областям энзимологии относится разработка биологических методов модификации ферментов. Особенно многообещающим является направление, получившее название «белковая инженерия». Методы белковой инженерии, основанные на знании зависимости между аминокислотной последовательностью, трехмерной структурой и каталитической активностью ферментов, позволяют успешно модифицировать ферменты для улучшения их технологических свойств [16, 17].
Широко используется способ замены определенных аминокислот в структурах .молекул ферментов. Показано, что замена в молекуле фосфолипазы А2 Asn89 на Asp и Glu92 на Lys вблизи N-терминального конца спирали 5 увеличивает ккал/моль [18], а замена Asp56 на Ser, Ser60 на Gly и Asn67 на Туr значительно увеличивает активность и средство фосфолипазы А2 к фосфолипидным мицеллам [19, 20].
Путем замены аминокислот в структурах молекул ферментов изменяют также их субстратную специфичность [21-23].
Изменение соотношения активности к растворимому и нерастворимому субстратам у целлобиогидролаз достигается путем замены внешних остатков ароматических аминокислот, которые захватывают конец молекулы полисахарида и направляют ее внутрь активного центра.
Увеличение стабильности ферментов к температуре и экстремальным значениям рН достигается путем таких замен среди сближенных в его третичной структуре аминокислотных остатков, которые приводят к образованию дополнительных нековалентных гидрофобных связей, солевых мостиков или ковалентных S-S-связей, повышающих общую стабильность глобулы молекулы фермента.
Во многих случаях замены осуществляются на основе сопоставления совершенствуемых структyp с соответствующими структурами аналогов из экстремофильных родственных организмов (термо-, ацидо- и алкалофильных).
Рекомбинатный фермент |
Организм - продуцент |
Область применения |
α-ацетолактатдекарбоксилаза |
Bacillus subtilis Bacillus amyloliquefaciens |
Производство налитков |
Аминогелтидаэа |
Trichoderma reese Trichoderma lonqibrachiatum |
Производство молочных продуктов |
α-Амилаза |
Bacillus subtilis Bacillus amyloliquefaciens |
Производство напитков, хлебопечение |
Арабинофуранозидаза |
Aspergillu niger |
Производство напитков |
Каталаза |
Aspergillu niger |
Производство продуктов, содержащих куриные яйца |
Химозин |
Aspergillu niger |
Производство сыров |
Циклодекстрингликозил трансфераза |
Bacillus licheniformis |
Переработка крахмала |
α-Глюканаза |
Bacillus subtilis Bacillus amyloliquefaciens |
Производство напитков |
Глюкоамилаза |
Aspergillu niger |
Производство напитков, хлебопечение |
Глюкозоизомераза |
Streptomyces lividans |
Переработка крахмала |
Глюкозооксидаза |
Aspergillu niger |
Хлебопечение |
Глюкозооксидаза |
Bacillus subtilis Bacillus amyloliquefaciens |
Хлебопечение, переработка крахмала |
Липаза, триацилглицерол |
Aspergillus oryzae |
Производство жиров |
Мальтогенная амилаза |
Bacillus subtilis Bacillus amyloliquefaciens |
Хлебопечение, переработка крахмала |
Пектинлиаза |
Aspergillu niger |
Производство напитков |
Пектинэстераза |
Trichoderma reesei Trichoderma longibrachiatum |
Производство напитков |
Фосфолипаза А |
Trichoderma reesei Triclioderma longibrachiatum |
Хлебопечение, переработка жиров |
Фосфолипаза В |
Trichoderma reesei Trichoderma longibrachiatum |
Хлебопечение, переработка крахмала |
Полигалактозидаза |
Trichoderma reesei Trichoderma longibrachiatum |
Производство напитков |
Протеаза |
Aspergillus oryzae |
Производство сыров |
Пуллуланаза |
Bacillus licheniformis |
Переработка крахмала |
Ксиланаза |
Aspergillu niger |
Производство напитков, хлебопечение |
Человечество использует ферменты для приготовления продуктов питания с незапамятных времен.
Эмпирическим путем люди выяснили, что существуют природные субстраты, которые при внесении их в тот или иной вид сырья вызывают в нем желательные изменения. Такими субстратами были соки растений и ткани животных, содержащие ферменты, а также виноградный сок, молоко, тесто, самопроизвольно сбродившие в результате попадания в них микроорганизмов. Например, для получения сыра использовали соки растений, содержащие фермент фицин, или ткани желудка птиц и животных, содержащие фермент ренин. Для тендеризации мяса (размягчения мышечной ткани) использовали сок папайи, содержащий фермент папайи.
Иногда повышение стабильности ферментов достигается введением в его структуру специального термостабилизующего модуля, обнаруженного у некоторых бактерий.
Повышение стабильности ферментов к протеолизу осуществляется либо путем удаления сайтов узнавания протеаз из структуры доменов, либо путем увеличения степени гликозилирования через введение в них аминокислот; служащих сайтами О- или N-гликозилирования.
Модификация ферментов осуществляется также с помощью изменения их модульной структуры путем включения или удаления субстратсвязывающего домена. Например, в результате введения в молекулы гликозилтрансфераз целлюлозосвязывающего домена они приобретают способность «сшивать» оборванные концы молекул в аморфных участках на поверхности целлюлозного волокна. Удаление «ненужных» модулей уменьшает массу молекулы, в результате чего повышается эффективность диффузии фермента в субстрат.
Изменение характера действия и субстратной специфичности ферментов достигается, например, делецией петель, перекрывающих активный центр экзогидролаз, что превращает их в родственные эндогидролазы [24].
Один из видов биологической модификации - знзиматическая модификация ферментов. Ферменты используют для модификации протеинов уже более 20 лет. В пищевых технологиях ферменты используются для регулирования функционально-технологических и нутритивных свойств белков [25-27], а также для регулирования функционально-физиологических свойств пищевых белков [28-30].
В 90-х гг XX в. ферменты начали использовать для модификации других ферментов. Сложность осуществления таких реакций обусловлена стерическими факторами, затрудняющими взаимодействие молекул ферментов. Одним из немногочисленных примеров подобной модификации является модификация фосфолипазы А2 тканевой трансглутаминазой [31, 32].
Все шире используются в качестве продуцентов ферментов генетически измененные микроорганизмы. Модификация их генома производится с целью увеличения гиперпродукции продуцируемых этими микроорганизмами ферментов или создания возможности синтеза нехарактерных для данного микроорганизма ферментов.
С целью увеличения гиперпродукции ферментов микроорганизмы подвергают воздействию различных мутагенов (ультрафиолетовых и рентгеновских лучей, химических агентов), вызывающих как гибельную мутацию у большей части микробной популяции, так и мутации, способствующие увеличению продукции ферментов. Для каждого мутагена и микроорганизмы подбирают условия мутагенной обработки, позволяющие увеличить количество выживших мутировавших клеток. Оставшиеся жизнеспособными микробные клетки подвергают скринингу по геномным вариантам, отбирая наиболее активных продуцентов определенных ферментов.
Данный метод, называемым методом классической мутации, впервые был описан в конце 30-х гг. XX в, и активно использовался в 1950-1970 гг. Ему на смену пришли методы модификации генома микроорганизмов, основанные на достижениях генной инженерии. В частности рекомбинантная ДНК (рДНК) технология, позволяющая внедрять в геном микроорганизма гены, ответственные за синтез необходимых ферментов.
В настоящее время налажено промышленное производство микроорганизмов-продуцентов рекомбинантных ферментов. Например, ген, ответственный за выработку фермента химозина, выделенный из эукариотического организма, внедряют в геном микроорганизмов Escherihia coli, Kluyveromyces lactis или Aspergillus awamori, которые становятся продуцентами данного фермента [33]. Бактерии Bacillus subtilus используют как продуценты рекомбинантного фермента ацетолактатдекарбоксилазы [34].
Использование микроорганизмов-продуцентов рекомбинантных ферментов имеет ряд преимуществ. Один и тот же микроорганизм может использоваться как продуцент различных ферментных препаратов, что унифицирует технологию их получения. Выход ферментов значительно увеличивается, например выход глюкоамилазы и эндоксиланазы. продуцируемых рекомбинантными штаммами Aspergillus. превышает выход этих ферментов из традиционных штаммов в 10-30 раз.
Рекомбинантные ферменты отличаются высокой чистотой, что имеет особое значение в пищевых технологиях. Например, использование свободных от протеазной активности амилаз в хлебопечении позволяет улучшить реологические свойства теста, поскольку не происходит разрушения структуры белков клейковины.
Рекомбинантные ферменты широко применяются в пищевых технологиях (табл. 2). Однако, если в непищевых отраслях промышленности рекомбинантные ферменты применяют без ограничений, то пищевые продукты, полученные с использованием рекомбинантных ферментов, должны быть соответственно маркированы для информирования потребителя.
Кроме как из природных источников, ферменты могут быть получены путем искусственного синтеза. Перспективен синтез ферментов, не имеющих полипептидных структур, но содержащих аналоги активных центров существующих ферментов. Созданы ферменты, содержащие синтетические полимеры циклодекстринов и металлопроизводных стероидов, являющиеся матриксом, в котором дополнительные реакционные группы ориентированы как активные центры ферментов [35].
Циклодекстрины широко используются для создания синтетических ферментов, поскольку способны к гидрофобному связыванию в центральной полости активных соединений. На основе β-циклодекстрина получены различные синтетические гидролитические ферменты [35], ферменты с химотрипсиновой [36], трансамилазной и рибонуклеазной активностью [37, 38]. Синтетический химотрипсин был получен путем включения в молекулу β-циклодекстрина каталитических групп - имидозолилбензоиной кислоты или других имидазольных соединений.
Поскольку синтетические ферменты не содержат аминокислотных остатков, они менее подвершены действию таких факторов, как температура, рН, ионная сила, чем природные ферменты, для конформационной стабильности и биологических функций которых данные факторы являются лимитирующими [39-42]. Эти свойства синтетических ферментов расширяют возможности ферментативных технологий, в том числе и в пищевой промышленности.
