
- •Формальная кинетика. Основные понятия, их применение к гетерогенным химическим процессам
- •Диффузия и теплопередача в гетерогенных процессах
- •10. Диффузионные процессы испарения и растворения
- •Коэффициент диффузии, коэффициент массоотдачи, влияние температуры на скорость гетерогенного процесса
- •8. Второй закон Фика (нестационарная диффузия)
Коэффициент диффузии, коэффициент массоотдачи, влияние температуры на скорость гетерогенного процесса
Коэффициент диффузии является константой скорости диффузионного процесса. Он численно равен количеству вещества (в молях), проходящему через единицу площади (1 см2) за единицу времени (1 с) при градиенте концентрации, равном единице (т.е. изменению концентрации в 1 моль/см3 на расстоянии в 1 см). Размерность коэффициента диффузии:
 или
или
 . (1.10)
. (1.10)
Величина коэффициента диффузии чаще всего оценивается из экспериментальных данных, однако его можно оценить из ряда известных соотношений.
Коэффициент диффузии молекул в газовой фазе равен:
 , (1.11)
, (1.11)
где
 ,
,
 ,
,
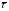 –
средние величины длинны свободного
пробега, скорости и времени между
столкновениями.
–
средние величины длинны свободного
пробега, скорости и времени между
столкновениями.
Коэффициент диффузии для кристалла, в котором диффундирующее вещество скачками перемещается по узлам правильной решетки, можно оценить по соотношению:
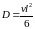 ,
(1.12)
,
(1.12)
где
 –
параметр решетки,
–
параметр решетки,
 –
частота диффузионных скачков.
–
частота диффузионных скачков.
Для оценки коэффициента диффузии сферических частиц в растворах, размеры которых гораздо больше, чем у молекул растворителя, применяется формула Стокса–Эйнштейна:
 ,
(1.13)
,
(1.13)
где R-
универсальная газовая постоянная; T-
температура; NA-
число Авагадро;
 - вязкость среды;
- вязкость среды;
 -
радиус диффундирующей молекулы.
-
радиус диффундирующей молекулы.
Коэффициент диффузии в сильно разбавленном растворе электролита
можно рассчитать по соотношению:
 , (1.14)
, (1.14)
rдеR=8,314
Дж/(моль∙К)– газовая постоянная;
T–температура;
 –
предельная электропроводимось катионов
и анионов, А∙ г=экв/(см4∙В);
–
предельная электропроводимось катионов
и анионов, А∙ г=экв/(см4∙В); –
валентности катиона
и аниона соответственно;F=
96485 Кл/моль – число Фарадея. Значения
для
многих ионов приведены в кратком
справочнике физико-химических величин.
–
валентности катиона
и аниона соответственно;F=
96485 Кл/моль – число Фарадея. Значения
для
многих ионов приведены в кратком
справочнике физико-химических величин.
Зависимость коэффициента диффузии от температуры описывается формулой:
 , (1.15).
, (1.15).
где
 –
предэкспоненциальный
множитель (фактор диффузии), Q–
энергия активации диффузии.
–
предэкспоненциальный
множитель (фактор диффузии), Q–
энергия активации диффузии.
Коэффициент массоотдачи - величина, характеризующая интенсивность массоотдачи и равная плотности потока массы данного компонента на поверхности раздела (на стенке), отнесенной к разности его массовых долей (или в случае газовой смеси его парциальных давлений) в среде и на поверхности раздела со стороны данной фазы. Или: величина, характеризующая интенсивность массопередачи и равная плотности потока массы данного компонента через поверхность раздела (или проницаемую стенку), отнесенной к разности его массовых долей в средах по обе стороны поверхности раздела (стенки); различают местный коэффициент массопередачи и средний коэффициент массопередачи.
8. Второй закон Фика (нестационарная диффузия)
Диффузией называется процесс переноса вещества, обусловленный самопроизвольным выравниванием его концентрации в первоначально неоднородной системе. В результате процесса диффузии устанавливается одинаковый химический потенциал каждого компонента во всех элементах объема системы. Если в пределах всей системы температура одинакова, то диффузия приводит к самопроизвольному выравниванию концентраций. В тех случаях, когда в системе имеется температурный или какой-либо другой градиент, влияющий на значение химического потенциала вещества, диффузия может привести даже к еще большему увеличению разности концентраций.
Процессы
диффузии описываются законами Фика.
Первый
закон Фика, который
описывает стационарную диффузию,
устанавливает связь между количеством
вещества
 ,
продиффундировавшего
за время
,
продиффундировавшего
за время
 через
площадьS,пропорционально
градиенту концентрации
через
площадьS,пропорционально
градиенту концентрации
 :
:
 . (1.1)
. (1.1)
В более общем виде диффузия характеризуется потоком Ji, равным массе вещества, проходящей за единицу времени через условную единичную поверхность, располагаемую перпендикулярно направлению потока:
 , (1.2)
, (1.2)
где
 –
масса i
вещества, переносимая за время
–
масса i
вещества, переносимая за время
 через
поверхность, площадь которой равна S;
Di–
коэффициентом диффузии. Знак минус
перед
указывает
на то, что процесс диффузии идет в
направлении уменьшения концентрации.
через
поверхность, площадь которой равна S;
Di–
коэффициентом диффузии. Знак минус
перед
указывает
на то, что процесс диффузии идет в
направлении уменьшения концентрации.
Второй закон Фикаописываетизменение общей концентрации диффундирующего вещества в каждой точке среды:
 ,
(1.3)
,
(1.3)
где
 –
оператор Лапласа;
–
оператор Лапласа;
 –функция,
описывающая рождение или гибель
диффундирующих молекул в каждой точке
среды.
–функция,
описывающая рождение или гибель
диффундирующих молекул в каждой точке
среды.
В декартовых координатах оператор Лапласа имеет вид:
 . (1.4)
. (1.4)
В цилиндрических координатах:
 .
(1.5)
.
(1.5)
В сферических координатах:
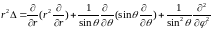 .
(1.6)
.
(1.6)
Выражение (4) фактически является уравнением материального баланса
Для диффузии в одном направлении (одномерная диффузия) второй закон Фиказаписывается в следующем виде:
 . (1.7)
. (1.7)
Отметим, что величина наблюдаемого потока зависит не только от процесса диффузии, но и от действия на частицы внешних сил. Если внешняя сила Fх, направленная вдоль оси х, сообщает частице скорость wx, то возникает дополнительная составляющая потока, равная ci ∙wx. С ее учетом поток вещества определяется уравнением:
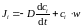 . (1.8)
. (1.8)
В этом же случае вместо уравнения, выражающего второй закон Фика, применяется уравнение Фоккера-Планка:
 .
.
11Кинетика гетерогенно-каталитических процессов. Основные понятия катализа, терминология
Кинетика процессов, в которых реагирует
одно вещество и продукты реакции не тормозят процесс
Рассмотрим гетерогенные каталитические реакции, когда катали-
затор твердый, а реагирующие вещества и продукты реакции га-
зообразные. Причем вначале ограничимся случаем, когда реагируетодно вещество, и продукты реакции не тормозят процесса.
Примерами такого типа реакций могут быть реакции распада
-некоторых веществ, например, распад NH 3
на платине, распадметана на угле и др.
Как уже было сказано, в типичном гетерогенном процессе реагируют только те вещества, которые адсорбированы на поверхности. Скорость w гетерогенной химической реакции определяют
как количество вещества, реагирующего в единицу времени на
единице площади поверхности катализатора
w = dx/Sdt
где x — количество реагирующего вещества в момент времени t; S — общая
площадь катализатора, на которой идет химический процесс.
Скорость гетерогенного химического процесса согласно основ-
ному постулату химической кинетики прямо пропорциональна поверхностной концентрации веществ. Последняя прямо пропорциональна доле поверхности σ, занятой молекулами реагирующего
вещества на единице площади катализатора, поэтому можно записать
dx/Sdt = k'σ
Так как поверхность данного катализатора постоянна, величину общей поверхности катализатора можно ввести в константускорости процесса k\ т. е. принять, что
k'S = k
Поэтому уравнение запишется в более простом виде
dx/dt = kσ
Площадь, занятую реагирующим веществом на одном квадратном сантиметре поверхности, можно найти, пользуясь адсорбционной теорией Ленгмюра. Сделаем упрощающие предположения:
1) между адсорбированными молекулами не действуют силы притяжения и отталкивания; 2) процесс адсорбции заканчиваетсятогда, когда все адсорбционные центры на поверхности твердого
тела (или жидкости) оказываются занятыми, т. е. на поверхностираздела фаз образуется слой толщиной в одну молекулу (мономолекулярный насыщенный слой); 3) все адсорбционные центры
одинаковы во всех отношениях. Тогда можно считать, что скоростьпроцесса адсорбции W\ будет прямо пропорциональна давлениюгаза и свободной поверхности катализатора 1 — σ :
w1 = k1p(1 — σ)
где k1—константа, характеризующая скорость процесса адсорбции.
Скорость обратного процесса (десорбции) будет прямо пропорциональна поверхности, занятой реагирующими молекулами
W2 = k2σ
где k2— константа, характеризующая процесс десорбция.
12. Основные характерные черты гетерогенно-каталитического процесса
В гетерогенном катализе реагирующие вещества и катализатор находятся в разных агрегатных состояниях. Наиболее часто катализатор представляет собой твердое вещество, а реагенты являются газами или жидкостями. Реакция протекает на поверхности катализатора. Следовательно свойства поверхности (площадь, химический состав поверхностного слоя, его структура) существенно влияют на активность катализатора. Гетерогенные каталитические процессы очень сложны. Если катализатор имеет достаточно развитую поверхность, то можно выделить семь стадий каталитического процесса: -диффузия реагирующих веществ к поверхности катализатора (внешняя диффузия); -диффузия в поры катализатора (внутренняя диффузия); -адсорбция реагента на поверхности катализатора; -химическое превращение на поверхности катализатора (которое может происходить в несколько стадий); -десорбция продуктов с поверхности катализатора; -диффузия продуктов реакции в порах к внешней поверхности гранул катализатора; -диффузия продуктов от внешней поверхности катализатора. В гетерогенном катализе значительную роль играет адсорбция, так как каталитическая реакция протекает в поверхностном слое. Адсорбированные молекулы определенным образом ориентированы к поверхности, причем уменьшение энергии активации происходит за счет перераспределения связей и повышения энтропии активации. Энергетические диаграммы реакции, проходящей с участием гетерогенного катализатора и без него (стр 290 рис) отличаются от аналогичных диаграмм с участием гомогенного катализатора наличием энтальпии адсорбции и десорбции. Очень сильное адсорбционное взаимодействие может препятствовать прохождению химической реакции. Молекулы продуктов должны быть десорбированы (оторваны) от поверхности на это затрачивается энергия (энтальпия десорбции dНД>0) Слишком большое значение энтальпии десорбции также может затруднять протекание процесса. Только некоторое оптимальное сочетание энергии активации, энтальпии адсорбции и десорбции будет способствовать ускорению каталитического процесса.
