
- •4 Атмосферное давление
- •[Править] Взаимосвязи в пределах модели идеального газа
- •[Править] Температура, давление и плотность
- •[Править] Влияние влажности воздуха
- •[Править] Влияние высоты над уровнем моря в тропосфере
- •Уравнение состояния идеального газа
- •1 Объём азота соединяется с 3 объёмами водорода с образованием 2 объёмов аммиака:
- •[Править] См. Также
[Править] Влияние высоты над уровнем моря в тропосфере
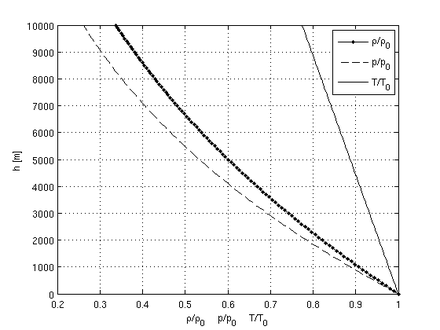
![]()
Зависимость давления, температуры и плотности воздуха от высоты по сравнению со стандартной атмосферой (p0=101325 Па, T0=288,15 K, ρ0=1,225 кг/м³).
Для вычисления плотности воздуха на определенной высоте в тропосфере могут использоваться следующие параметры (в параметрах атмосферы указано значение для стандартной атмосферы):
стандартное атмосферное давление на уровне моря — p0 = 101325 Па;
стандартная температура на уровне моря — T0 = 288,15 K;
ускорение свободного падения над поверхностью Земли — g = 9,80665 м⁄сек2 (при данных вычислениях считается независимой от высоты величиной);
скорость падения температуры (англ.)русск. с высотой, в пределах тропосферы — L = 0,0065 K⁄м;
универсальная газовая постоянная — R = 8,31447 Дж⁄(Мол·K);
молярная масса сухого воздуха — M = 0,0289644 кг⁄Мол.
Для тропосферы (то есть области линейного убывания температуры — это единственное свойство тропосферы, используемое здесь) температура на высоте h над уровнем моря может быть задана формулой:
![]()
Давление на высоте h:
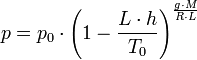
Тогда плотность может быть вычислена подстановкой соответствующих данной высоте h температуры T и давления P в формулу:
Эти три формулы (зависимость температуры, давления и плотности от высоты) и использованы для построения графиков, приведенных справа. Графики нормализованы — показывают обший вид поведения параметров. «Нулевые» значения для верных вычислений нужно каждый раз подставлять в соответствии с показаниями соответствующих приборов (термометра и барометра) на данный момент на уровне моря.
Уравнение состояния идеального газа
[править]
Материал из Википедии — свободной энциклопедии
Уравнение состояния |
|
Статья является частью серии «Термодинамика». |
Уравнение состояния идеального газа |
Уравнение Ван-дер-Ваальса |
Уравнение Дитеричи |
Уравнение состояния Редлиха — Квонга |
Уравнение состояния Барнера — Адлера |
Уравнение состояния Суги — Лю |
Уравнение состояния Бенедикта — Вебба — Рубина |
Уравнение состояния Ли — Эрбара — Эдмистера |
Разделы термодинамики |
Начала термодинамики |
Уравнение состояния |
Термодинамические величины |
Термодинамические потенциалы |
Термодинамические циклы |
Фазовые переходы |
править |
См. также «Физический портал» |
![]()
где
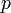 —
давление,
—
давление,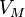 —
молярный
объём,
—
молярный
объём,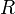 —
универсальная
газовая постоянная
—
универсальная
газовая постоянная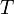 —
абсолютная
температура,К.
—
абсолютная
температура,К.
Так
как
![]() ,
где
,
где
![]() —
количество
вещества,
а
—
количество
вещества,
а
![]() ,
где
,
где
![]() —
масса,
—
масса,
![]() —
молярная
масса,
уравнение состояния можно записать:
—
молярная
масса,
уравнение состояния можно записать:
![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
![]()
![]()
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
![]() —
закон
Бойля — Мариотта.
—
закон
Бойля — Мариотта.
![]() —
Закон
Гей-Люссака.
—
Закон
Гей-Люссака.
![]() —
закон
Шарля
(второй закон Гей-Люссака, 1808 г.)
—
закон
Шарля
(второй закон Гей-Люссака, 1808 г.)
С точки зрения химика этот закон может звучать несколько иначе: Объёмы вступающих в реакцию газов при одинаковых условиях (температуре, давлении) относятся друг к другу и к объёмам образующихся газообразных соединений как простые целые числа. Например, 1 объём водорода соединяется с 1 объёмом хлора, при этом образуются 2 объёма хлороводорода:
![]()

