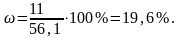1.4 Промышленные способы получения
Получают полисульфидные каучуки поликонденсацией алифатических дигалогено-производных - главным образом ди - (b-хлорэтил) формаля, а также 1,2-дихлорэтана, 1,2-дихлорпропана, b, b'-дихлордиэтилового эфира, ди - (d-хлорбутил) формаля с полисульфидами щелочных металлов (чаще Na2Sm, где m примерно 2 — 5). Для создания разветвления и возможности отверждения некоторых полисульфидные каучуки по концевым группам SH в поликонденсацию вводят 0,1-4,0 мол.% 1,2,3-трихлорпропана.
Поликонденсацию (неравновесную, на границе раздела фаз) проводят в водной среде в присутствии диспергатора [как правило, Mg(OH)2] и эмульгатора (канифольного мыла), используя избыток полисульфида щелочного металла для
п олучения полисульфидные каучуки высокой молекулярной массы. Так как в процессе, как правило, образуется тетрасульфидный каучук для получения дисульфидного каучука дисперсию полимера после поликонденсации обрабатывают NaOH (десульфурируют), после чего отмывают водой от избытка полисульфида щелочного металла и минеральных солей многократной декантацией.
Выделяют полисульфидные каучуки из отмытой дисперсии, разрушая диспергатор кислотами и одновременно переводя концевые группы SNa в SH, затем тщательно отмывают водой и сушат.
Твердые полисульфидные каучуки вальцуют и прессуют в брикеты массой около 50 кг; выпускают также их водные дисперсии с содержанием сухого вещества 50-60% по массе и размером частиц полимера 2-10 мкм.
Вулканизующие агенты для полисульфидных каучуков ZnO, СаО, РbО2, МnО2, кумилпероксид, n-хинондиоксим.
Вулканизаты полисульфидных каучуков масло-, бензо-, свето-, радиационно-, кислороде- и озоностойки, устойчивы в разбавленных кислотах и щелочах; sраст 1,5-10 МПа, относит. удлинение 150-400%.
Жидкие полисульфидные каучуки - основа герметиков и клеев синтетических, твердые применяют для гуммирования бетонных топливных резервуаров и герметизации клепаных швов топливных сосудов, для производства РТИ.
1.5 Безопасность
Ведение технологического процесса производства тиокола связано с применением взрывоопасных горючих продуктов, агрессивных и вредных для организма веществ: этиленхлоргидрина (ЭХГ), параформальдегида, серной кислоты, формаля.
Технологические процессы ведутся при Т до -40 до100-130 оС с использованием вакууметрического давления при отгоне этиленхлогидрина и избыточном давлении до 2,0 МПа при передавливании продуктов.
Наиболее опасным является стадия синтеза формаля-сырца из-за возможного выделения формальдегида и паров ЭХГ в атмосферу.
О бвязка оборудования выполнена трубопроводами, содержащими разъемные фланцевые соединения в связи с чем повышается опасность разгерметизации и разлива продукта.
Характеристика опасности продуктов.
1,2-дихлорпропан
Физические свойства
Температура кипения: 96°C
Температура плавления: -100°C
Относительная плотность (вода = 1): 1.16
Растворимость в воде, г/100 мл при 20°C: 0.26
Давление паров, кПа при 20°C: 27.9
Относительная плотность пара (воздух = 1): 3.9
Относительная плотность смеси пар/воздух при 20°C (воздух = 1): 1.15
Температура вспышки: 16°C c.c.
Температура самовоспламенения: 557°C
Пределы взрываемости, объем % в воздухе: 3.4-14.5
Нормативы для рабочей зоны:
Максимальная разовая концентрация: не более 15 мин, не чаще 4 раз в смену мг/м3
Виды опасности / Воздействия |
Острая опасность/ Симптомы |
Предупреждение |
Первая помощь / Ликвидация пожара |
|
1 |
2 |
3 |
4 |
|
Пожарная опасность |
Сильно огнеопасно. |
Не допускать открытого огня, искр и курения. |
порошком, пеной, двуокисью углерода, |
|
Взрывоопасность |
Смеси пар/воздух взрывоопасны. |
Закрытая система, вентиляция, взрывобезопасное электрооборудование и освещение. |
В случае пожара: сохранять бочки и пр. охлажденными, обливая их водой. |
|
Воздействие |
|
|
|
|
Вдыхание |
Кашель. Сонливость. Головная боль. Боли в горле. |
Вентиляция, местная вытяжка или защита органов дыхания. |
Свежий воздух, покой. Искусственное дыхание по показаниям. Обратиться за медицинской помощью. |
|
1 |
2 |
3 |
4 |
Кожа |
Сухость кожи. Покраснение. Боль. |
Защитные перчатки. |
Сначала промыть большим количеством воды, затем удалить загрязненную одежду и снова промыть. Обратиться за медицинской помощью. |
Глаза |
Покраснение. Боль. |
Защитные очки-маска |
Вначале промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это не трудно), затем доставить к врачу. |
Проглатывание |
Боль в животе. Понос. Сонливость. Головная боль. Тошнота. Рвота. |
Не принимать пищу, не пить и не курить во время работы |
Прополоскать рот. Обратиться за медицинской помощью. |
1,2,3-трихлорпропан
Физические свойства
Температура кипения: 156°C
Температура плавления: -14°C
Относительная плотность (вода = 1): 1.4
Растворимость в воде: нерастворимо
Давление паров, кПа при 20°C: 0.29
Относительная плотность пара (воздух = 1): 5.1
Относительная плотность смеси пар/воздух при 20°C (воздух = 1): 1.01
Температура вспышки: 74°C
Температура самовоспламенения: 304°C
Пределы взрываемости, объем% в воздухе: 3.2-12.6
Нормативы для рабочей зоны:
ПДК в воздухе рабочей зоны (максимально разовая) - 2мг/м3
Класс опасности: 3
В иды опасности / Воздействия |
Острая опасность/ Симптомы |
Предупреждение |
Первая помощь / Ликвидация пожара |
Пожарная опасность |
Горюче. В огне выделяют раздражающие или токсичные пары (или газы). |
Не допускать открытого огня, искр и курения. |
порошком, спиртоустойчивой пеной, разбрызгиванием воды, двуокисью углерода |
Взрывоопасность |
При температуре выше 74°C могут образоваться взрывоопасныe смеси пар/воздух. Риск пожара и взрыва при контакте с металлами. |
При температуре выше 74°C применять закрытую систему, вентиляцию, защищенное от взрыва электрооборудование. |
В случае пожара: сохранять бочки и пр. охлажденными, обливая их водой. |
Воздействие |
|
Избегать любого контакта |
Во всех случаях обращаться к врачу |
Вдыхание |
Кашель. Сонливость. Головная боль. Боли в горле. |
Вентиляция, местная вытяжка или защита органов дыхания. |
Свежий воздух, покой. Искусственное дыхание по показаниям. Обратиться за медицинской помощью. |
Кожа |
Сухость кожи. Покраснение. Боль. |
Защитные перчатки. Защитная одежда. |
Удалить загрязненную одежду. Промыть кожу большим количеством воды или под душем. Обратиться за медицинской помощью |
Глаза |
Покраснение. Боль. |
Защитные очки-маска |
Вначале промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это не трудно), затем доставить к врачу. |
Проглатывание |
Боль в животе. Понос. Сонливость. Головная боль. Тошнота. Рвота. |
Не принимать пищу, не пить и не курить во время работы |
Прополоскать рот. Обратиться за медицинской помощью. |
Е дкий
натр (Натрий гидрат)
дкий
натр (Натрий гидрат)
Физические свойства
Температура кипения: 1390°C
Температура плавления: 318°C
Плотность: 2.1 г/см3
Растворимость в воде, г/100 мл при 20°C: 10
Нормативы для рабочей зоны:
Максимальная допустимая концентрация не установлена.
Виды опасности / Воздействия |
Острая опасность/ Симптомы |
Предупреждение |
Первая помощь / Ликвидация пожара |
1 |
2 |
3 |
4 |
Пожарная опасность |
Не горюче. Контакт с влагой или водой может привести к выделению достаточного количества тепла для того, чтобы привести к возгоранию горючих веществ |
|
В случае возгорания в окрестностях: разрешены все средства пожаротушения |
Взрывоопасность |
|
|
|
Воздействие |
|
Избегать любого контакта |
Во всех случаях обращаться к врачу |
Вдыхание |
Едкое. Ощущение жжения. Боли в горле. Кашель. Затрудненное дыхание. Одышка. Симптомы могут быть отсроченными |
Местная вытяжная вентиляция или защита органов дыхания |
Свежий воздух, покой. Полусидячее положение. Искусственное дыхание по показаниям. Обратиться за медицинской помощью |
Кожа |
Едкое. Покраснение. Боль. Серьезныеожоги кожи. Волдыри |
Защитные перчатки. Защитная одежда. |
Удалить загрязненную одежду. Промыть кожу большим количеством воды или под душем. Обратиться за медицинской помощью |
1 |
2 |
3 |
4 |
Глаза |
Едкое. Покраснение. Боль. Неясность зрения. Сильные глубокие ожоги |
Защитная маска, или, если вещество в виде порошка, то защита глаз в сочетании с защитой органов дыхания. |
Вначале промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это не трудно), затем доставить к врачу. |
Проглатывание |
Едкое. Ощущение жжения. Боль в животе. Шок или коллапс. |
Не принимать пищу, не пить и не курить во время работы |
Прополоскать рот. Обратиться за медицинской помощью. |
Сера порошкообразная
Физические свойства
Температура кипения: 445°C
Температура плавления: (r-сера) 107°C; (бета-сера) 115°C; (amorphous) 120)°C
Плотность: 2.1 г/см3
Растворимость в воде: нерастворим
Температура вспышки: 160°C c.c.
Температура самовоспламенения: 232°C
Пределы взрываемости, объем% в воздухе: 35-1400 г/м
Максимально разовая ПДК в воздухе рабочей зоны 6 мг/м3. Класс опасности 4.
Виды опасности / Воздействия |
Острая опасность/ Симптомы |
Предупреждение |
Первая помощь / Ликвидация пожара |
1 |
2 |
3 |
4 |
Пожарная опасность |
Горюче. |
Не допускать открытого огня, искр и курения |
Разбрызгиванием воды, пеной, порошком, сухим песком. |
Взрывоопасность |
Мелкодисперсные частицы в воздухе образуют взрывоопасныe смеси |
Не допускать накопления пыли; закрытая система, защищенное от взрыва при накоплении пыли электрооборудование и освещение. Не допускать накопление электростатического заряда |
В случае пожара: сохранять бочки и пр. охлажденными, обливая их водой. |
1 |
2 |
3 |
4 |
Воздействие |
|
Не допускать рассеивания пыли |
Во всех случаях обращаться к врачу |
Вдыхание |
Ощущение жжения. Кашель. Боли в горле. |
Местная вытяжная вентиляция или защита органов дыхания |
Свежий воздух, покой. Полусидячее положение. Искусственное дыхание по показаниям. Обратиться за медицинской помощью |
Кожа |
Покраснени |
Защитные перчатки. Защитная одежда. |
Удалить загрязненную одежду. Промыть кожу большим количеством воды или под душем. |
Глаза |
Покраснение. Боль. Неясность зрения. |
Защитная маска.
|
Вначале промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это не трудно), затем доставить к врачу. |
Проглатывание |
Ощущение жжения. Понос |
Не принимать пищу, не пить и не курить во время работы |
Прополоскать рот. Обратиться за медицинской помощью. |
Хлористый магний
Физические свойства
Температура кипения: 1412°C
Температура плавления: (быстрый разогрев) 712°C
Относительная плотность (вода = 1): 2.3
Растворимость в воде, г/100 мл при 20°C: 54.
Нормативы для рабочей зоны:
При воздействии на человека действовать аналогично как при действии серы на организм.
Хлористый водород
Физические свойства
Т емпература кипения: -85°C
Температура плавления: -114°C
Плотность: 1.00045 г/л (газ)
Растворимость в воде, г/100 мл при 30°C: 67
Относительная плотность пара (воздух = 1): 1.
Нормативы для рабочей зоны:
При воздействии на человека действовать аналогично как при действии едкого натра на организм.
Йод кристаллический
Физические свойства
Температура кипения: 184°C
Температура плавления: 114°C
Относительная плотность (вода = 1): 4.9
Растворимость в воде: нерастворимо
Давление паров, кПа при 25°C: 0.04
Относительная плотность пара (воздух = 1): 8.8
Нормативы для рабочей зоны:
При воздействии на человека действовать аналогично как при действии едкого натра на организм.
Толуол
Физические свойства
Температура кипения: 110,6°C
Температура плавления: -95°C
Относительная плотность (вода = 1): 0.86694
Растворимость в воде: нерастворимо
Пары могут проникать через неповрежденную кожу и органы дыхания, вызывать поражение нервной системы (заторможенность, нарушения в работе вестибулярного аппарата), в том числе необратимое. Поэтому работать с толуолом и растворителями, в состав которых он входит, необходимо в прочных резиновых перчатках в хорошо проветриваемом помещении или под тягой.
П ожароопасен, легковоспламеняющаяся жидкость. Концентрационные пределы взрываемости паровоздушной смеси 1,3 — 6,7 %. Обладает слабым наркотическим действием.
Толуол (метилбензол) — является сильно токсичным ядом, влияющим на функцию кроветворения организма, также, как и его предшественник, бензол. Нарушение кроветворения проявляется в цианозе, гипоксии. Существует также толуольная токсикомания, которая имеет и канцерогенное влияние. В целом, бензольные углеводороды очень токсичны, длительное их воздействие может привести к необратимым поражениям ЦНС, кроветворных органов, и создать предпосылки для возникновения энцефалопатии.
При действии на организм человека действовать аналогично всем предыдущим показаниям.
Тиосульфат натрия
Физические свойства
Бесцветные моноклинные кристаллы. Молярная масса 248,17 г/моль.
Растворим в воде (41,2% при 20 оС, 69,86% при 80оС).
При 48,5 °C плавится в своей кристаллизационной воде, обезвоживается около 100оС.
По воздействию на организм схож с едким натром.
Цель работы:
Синтез тиокола из дигалогенпроизводных и четырехсернистого натрия и определение выхода продукта и молекулярной массы тиокола.
Задачи работы:
Составление литературного обзора
Дать характеристику веществ, используемых в работе
Проведение синтеза
Определение молекулярной массы тиокола
Подготовка отчета
Р еактивы:
1,2-дихлорпропан С1СН2-СН Сl-СН3
1,2,3-трихлорпропан С1СН2-СН Сl-СН2С1
Едкий натр NаОН
Сера порошкообразная S
Хлористый магний MgCl2 кристаллический
Соляная кислота 10% HCl
Оборудование:
Колба круглодонная трехгорлая емкостью 500 мл
Мешалка с затвором
Холодильник обратный (шариковый)
Воронка капельная емкостью 50 мл
Цилиндр емкостью 500 мл
С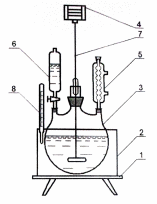 хема
установки получения тиокола показана
на рисунке 1.
хема
установки получения тиокола показана
на рисунке 1.
1 – электрическая плитка; 2 – баня водяная; 3 – реакционная колба; 4 – привод мешалки; 5 – холодильник; 6 – капельная воронка; 7 – мешалка с затвором;
8 – термометр.
Рисунок 1 – Схема установки получения тиокола
Проведение опыта
Опыт № 1. Получение тиокола из 1,2-дихлорпропана.
1. Синтез тетрасульфида натрия
Важной стадией синтеза тиоколов является получение полисульфида натрия. Получим полисульфид натрия по реакции:
6NaOH + 10S → 2Na2S4 + Na2S2O3 + 3H2O (1)
NaOH – едкий натр, М = 23+16+1 = 40 г/моль;
S – сера, М = 32 г/моль;
Na2S4 – тетрасульфид натрия, М = 2*23+4*32 = 174 г/моль;
Na2S2O3 – тиосульфат натрия, М = 2*23+2*32+3*16 = 158 г/моль;
H2O – вода, М = 2*1+16 = 18 г/моль.
Для синтеза полисульфида натрия использовали 20 % раствор едкого натра.
Рассчитаем необходимую массу едкого натра.
Исходя из уравнения реакции (1) для приготовления 2 моль тетрасульфида натрия необходимо 6 моль едкого натра, а для приготовления 0,33 моль тетрасульфида натрия необходимо:
6 моль NaOH – 2 моля Na2S4
х моль NaOH – 0,33 моля Na2S4
х = 6*0,33/2 = 1 моль NaOH.
Массу 1 моля едкого натра определяли по формуле:
m = M * υ,
где М – молекулярная масса вещества, г/моль;
υ – количество вещества, моль.
m(NaOH) = 40 * 1 = 40 г.
Определили количество воды для приготовления 200 г 20 % раствора содержащего 40 г едкого натра:
m(H2O) = 200 – 40 = 160 г.
Рассчитаем необходимую массу серы.
И сходя из уравнения реакции (1) для приготовления 2 моль тетрасульфида натрия необходимо 10 моль серы, а для приготовления 0,33 моль тетрасульфида натрия необходимо:
10 моль S – 2 моля Na2S4
х моль S – 0,33 моля Na2S4
х = 10*0,33/2 = 1,65 моль S.
Масса 1,65 моля S равна:
m(S) = 32 * 1,65 = 53 г.
Твёрдую щёлочь (40 г) осторожно растворили в фарфоровом стакане при постоянном перемешивании, затем перенесли в реактор.
При интенсивном перемешивании прилили 5,5 г (0,027 моль) кристаллического хлористого магния, растворенного в 16 мл воды. Образовавшуюся суспензию нагревали до 50°С и добавили к ней, не прекращая перемешивания 50 г (1,65 моль) измельченной (тщательно растертой фарфоровым пестиком в фарфоровой ступке) элементарной серы при помощи воронки. Сера растворяется с образованием темно-коричневого раствора полисульфида натрия.
Смесь нагревали при 800С и при перемешивании выдержали в течение 45 минут до полного растворения серы. Сера растворилась с образованием тёмно-коричневого раствора.
2. Синтез тиокола
Для синтеза тиокола использовали 1,2 –дихлорпропан.
Тиокол получали по уравнению реакции:
 CH3
CH3
CH2Cl – CHCl – CH3 + Na2S4 → [– CH2 – CH – S – S –]n
║ ║
S S
CH2Cl – CHCl – CH3 – 1,2 –дихлорпропан, М = 3*12+2*35,5+6*1 = 113 г/моль.
Рассчитаем необходимый объём 1,2 –дихлорпропана.
1 ,2 –дихлорпропан и тетрасульфид натрия брали в соотношении 1 : 1, т. е. 0,33 моля 1,2 –дихлорпропана.
Масса 0,33 моль 1,2 –дихлорпропана равна:
m(CH2Cl – CHCl – CH3) = 113 * 0,33 = 37,3 г.
Зная плотность 1,2 –дихлорпропана (1,16 г/см3) его объём определяли по формуле:
V = 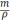
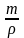 ,
,
где m – масса вещества, г;
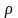 -
плотность вещества, г/см3.
-
плотность вещества, г/см3.
V(CH2Cl
– CHCl – CH3)
= 37,3/1,16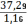 = 32 мл.
= 32 мл.
Расчетное количество 1,2 –дихлорпропана налили в капельную воронку и добавляли по каплям, регулируя скорость подачи так, чтобы из обратного холодильника стекало умеренное количество конденсата, в выше приготовленный раствор тетрасульфида натрия. После дозировки 1,2 –дихлорпропана смесь переме-
шивали ещё в течение 1 часа. Затем реакционную массу выдерживали при температуре 800С в течении 45 минут для завершения поликонденсации. Смесь охладили и перелили в стакан емкостью 0,5 л. Через некоторое время суспензия расслоилась. Верхний слой, окрашенный в желтый цвет, слили, а нижний слой несколько раз промыли дистиллированной водой (промывка совершенно необходима, так как в противном случае после осаждения получается сильно загрязненный препарат).
Коагуляцию осуществляли подкислением 10 % соляной кислотой до рН=3.
Рассчитаем необходимый объём соляной кислоты.
Плотность исходного раствора с концентрацией 37 % HCl равна 1,184 г/см3. Плотность 10 % соляной кислоты составляет 1,05 г/см3.
37% 10 | 1 часть
\ / |
10% | + = 3,7 - 100% масса раствора
/ \ |
0% 27 | 2,7 частей
Т о есть для приготовления 500 мл, что составляет 500*1,05=525 г 10%-го раствора соляной кислоты требуется x г 37 %-ой соляной кислоты и 2,7x г воды, получаем уравнение:
x+2,7x=525,
x= 141,9.
Итак, для приготовления 500 мл 10%-го раствора соляной кислоты необходимо 141,9/1,184=119,9 мл концентрированной соляной кислоты.
В мерную колбу на 500 мл налили 100 мл воды, прилили рассчитанное количество кислоты из цилиндра. Промыли цилиндр дистиллированной водой и вылили воду в мерную колбу. Довели объём раствора дистиллированной водой до метки.
Тиокол осадился в виде губчатой массы. Ее промыли водой для удаления остатков кислоты и соли магния. Затем тиокол высушили при 60-800С.
3. Определение молекулярной массы тиокола
В конической колбе взвешивали с точностью до 0,0002 г 0,2396г полученного тиокола. Растворили его в 75 мл толуола и добавили 30 мл йода, после чего содержимое колбы сильно встряхнули. Избыток йода оттитровали раствором серноватистокислого натрия (0,01 н) в присутствии крахмала.
Приготовление раствора крахмала в глицерине.
Готовили 100 г 2 % раствора крахмала в глицерине. Взяли 2 г крахмала и
98 г глицерина. Раствор грели на песочной бане до температуры 190 0С. Получили прозрачный раствор янтарного цвета.
Приготовление 0,01 н раствора серноватистокислого натрия.
0,1н 0,01 | 1 часть
\ / |
0,01н | + = 10 - 100% масс раствора
/ \ |
0 0,09 | 9 частей
Т о есть для приготовления 500 мл 0,01 н раствора тиосульфата натрия требуется x мл 0,1н раствора серноватистокислого натрия и 9x мл воды, получаем уравнение:
x+9x=500,
x= 50.
Итак, для приготовления 500 мл 0,01 н раствора тиосульфата натрия необходимо 50 мл 0,1 н раствора.
В мерную колбу на 500 мл налили 100 мл воды, прилили рассчитанное количество раствора тиосульфата натрия из цилиндра. Промыли цилиндр дистиллированной водой и вылили воду в мерную колбу. Довели объём раствора дистиллированной водой до метки.
Одновременно проводим контрольное титрование того же количества йода при добавлении 75 мл толуола.
Объём 0,01 Н раствора серноватистокислого натрия, израсходованного на контрольное титрование: Vк = 8,7 мл.
Объём 0,01 Н раствора серноватистокислого натрия, израсходованного на титрование навески:
V1 = 5,1 мл,
V2 = 5,3 мл,
V3 = 5 мл,
Vср = 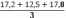
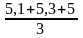 =5,1 мл.
=5,1 мл.
Молекулярную массу М вычисляли по формуле:
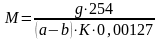 ,
,
где g – навеска тиокола, г;
254 – молекулярная масса йода, г/моль;
а – количество 0,01 Н раствора серноватистокислого натрия, израсходованного на контрольное титрование, мл;
b – количество 0,01 Н раствора серноватистокислого натрия, израсходованного на титрование навески тиокола, мл;
К – фактор 0,01 Н раствора серноватистокислого натрия;
0,00127 – количество йода, соответствующее 1 мл точно 0,01 Н раствора серноватистокислого натрия.
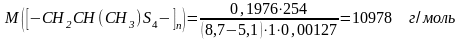
Молекулярная масса одного звена цепи составляет:
М(-CH2CH(СН3)S4-) = 170 г/моль.
Количество звеньев цепи тиокола составляет:
n
=  =
= 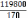
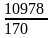 = 65.
= 65.
Определим выход тиокола. Так как исходные
компоненты были рассчитаны на 0,33 моль,
то теоретическая масса тиокола
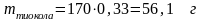 .
Выход продукта составляет:
.
Выход продукта составляет: