
- •Глава 1. Введение в химию 4
- •Глава 2. Электронное строение атомов 18
- •Глава 3. Химическая связь 33
- •Глава 4. Химическая термодинамика 53
- •Глава 5. Химическая кинетика 69
- •Глава 6. Растворы 83
- •Глава 7. Химические источники тока 113
- •Глава 8. Химические свойства элементов 132
- •Глава 9. Координационные соединения 162
- •Глава 1. Введение в химию
- •1.1. Понятие об атомах
- •1.2. Молекулы, радикалы и ионы
- •1.3. Номенклатура неорганических соединений
- •1.4. Законы стехиометрии
- •1.5. Химические реакции
- •Способы получения солей
- •Способы получения оксидов
- •Способы получения кислот
- •Способы получения оснований
- •Глава 2. Электронное строение атомов
- •2.1. Корпускулярно-волновые свойства частиц
- •2.2. Квантовые числа электрона
- •2.3. Заполнения атомных орбиталей
- •2.4. Электронные формулы элементов
- •2.5. Периодическая система элементов
- •2.5.1. Электронные конфигурации атомов периодической таблицы
- •2.6. Периодичность атомных характеристик
- •2.6.1. Ионные радиусы элементов
- •Глава 3. Химическая связь
- •3.1. Химическая связь
- •3.2. Типы химических связей
- •3.3. Современные представления о химической связи
- •3.3.1. Метод молекулярных орбиталей (ммо)
- •3.3.2. Двухатомные гомоядерные молекулы
- •3.3.3. Свойства двухатомных молекул p-элементов II периода
- •3.3.4. Многоатомные молекулы
- •3.3.5. Метод валентных связей (мвс)
- •3.3.6. Сравнительная характеристика ммо и мвс
- •3.3.7. Метод Гиллеспи–Найхолма
- •Глава 4. Химическая термодинамика
- •4.1. Введение в термодинамику
- •4.2. Энтальпия
- •4.3. Введение в термохимию
- •4.4. Закон Гесса
- •4.5. Энтропия
- •4.6. Энергия Гиббса
- •4.7. Химическое равновесие
- •4.8. Принцип Ле Шателье
- •4.8.1. Константы диссоциации кислот и оснований
- •4.8.2. Константы комплексообразования
- •Глава 5. Химическая кинетика
- •5.1. Скорость химических реакций
- •5.2. Закон действующих масс
- •5.3. Порядок химических реакций
- •5.4. Температура и скорость реакции
- •5.5. Катализ
- •5.6. Сложные реакции
- •5.6.1. Обратимые реакции
- •5.6.2. Последовательные реакции
- •5.6.3. Параллельные реакции
- •5.6.4. Цепные реакции
- •5.6.5. Фотохимические реакции
- •Глава 6. Растворы
- •6.1. Классификация растворов
- •6.2. Концентрация растворов
- •6.3. Растворы неэлектролитов
- •6.3.1. Закон Генри
- •6.3.3. Осмос
- •6.4. Растворы слабых электролитов
- •6.4.1. Водородный показатель pH
- •6.5. Растворы сильных электролитов
- •6.6. Кислотно-основные свойства химических соединений
- •6.7. Гидролиз солей
- •6.8. Произведение растворимости
- •6.9. Равновесие в гетерогенных системах
- •6.9.1. Диаграммы плавкости
- •Глава 7. Химические источники тока
- •7.1. Типы окислительно-восстановительных реакций
- •7.2. Электродные потенциалы и электродвижущие силы. Стандартный водородный электрод
- •7.2.1. Стандартные окислительно-восстановительные потенциалы
- •7.3. Классификация электродов
- •7.3.1. Электроды первого рода
- •.3.2. Электроды второго рода
- •7.3.3. Ионоселективные электроды
- •7.4. Химические источники тока
- •7.4.1. Типы гальванических элементов
- •7.5. Электрохимическая коррозия
- •Глава 8. Химические свойства элементов
- •8.1.1. Водород и его соединения. Гелий
- •8.1.2. Водородные соединения
- •8.1.3. Оксиды, пероксиды и гидроксиды
- •8.2.1. Важнейшие характеристики p-элементов
- •8.2.2. Гидроксиды
- •8.2.3. Отличия соединений p-элементов второго и третьего периода
- •8.2.4. Водородные соединения
- •8.2.5. Оксиды, бориды, карбиды, силициды и нитриды
- •8.2.6. Интерметаллические соединения
- •8.2.7. Благородные газы
- •8.3.1. Соединения d-элементов с легкими неметаллами
- •8.4.1. Лантаноиды
- •8.4.2. Актиноиды
- •Глава 9. Координационные соединения
- •9.1. Общие сведения о координационных соединениях
- •9.2. Изомерия координационных соединений
- •9.3. Устойчивость координационных соединений в растворах
- •9.4. Химическая связь в координационных соединениях
- •9.4.1. Метод валентных связей
- •9.4.2. Теория кристаллического поля
- •9.4.3. Теория поля лигандов
- •9.5. Электронная конфигурация комплексообразователя
- •9.6. Реакции с участием координационных соединений
- •9.7. Координационные соединения p- и s-элементов
2.3. Заполнения атомных орбиталей
Заселение электронами атомных орбиталей (АО) осуществляется согласно принципу наименьшей энергии, принципу Паули и правилу Гунда.
Принцип наименьшей энергии требует, чтобы электроны заселяли АО в порядке увеличения энергии элекронов на этих орбиталях. Это отражает общее правило – максимуму устойчивости системы соответствует минимум ее энергии.
Принцип Паули запрещает в многоэлектронном атоме находиться электронам с одинаковым набором квантовых чисел. Это означает, что два любых электрона в атоме (или молекуле, или ионе) должны отличаться друг от друга значением хотя бы одного квантового числа, то есть на одной орбитали может быть не более двух электронов с различными спинами (спаренных электронов). Каждый подуровень содержит 2l + 1 орбитали, на которых размещаются не более 2(2l + 1) электронов. Отсюда следует, что емкость s-орбиталей – 2, p-орбиталей – 6, d-орбиталей – 10 и f-орбиталей – 14 электронов. Если число электронов при заданном l просуммировать от 0 до n – 1, то получим формулу Бора–Бьюри, определяющую общее число электронов на уровне с заданным n:
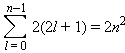
Эта формула не учитывает межэлектронное взаимодействие и перестает выполняться при n ≥ 3.
Орбитали с одинаковыми энергиями (вырожденные) заполняются в соответствии с правилом Гунда: наименьшей энергией обладает электронная конфигурация с максимальным спином. Это означает, что если на p-орбитали три электрона, то они располагаются так: , и суммарный спин S = 3/2, а не так: , S = 1/2.
2.4. Электронные формулы элементов
Рассмотрим последовательное заполнение электронных оболочек атомов в соответствии с приведенными правилами. В записи электронных формул (или конфигураций), отражающих эту последовательность, первая цифра равна n, буква после нее соответствует l, а правый верхний индекс равен числу электронов в этом состоянии (табл. 2.1). Например, электронная формула лития – 1s22s1, углерода – 1s22s22p2, хлора – 1s22s22p63s23p5. Заселенность электронных оболочек может быть представлена в виде квантовых ячеек (квадратов или горизонтальных линий) (рис. 2.2). В отличие от электронных формул, здесь используются не два, а все четыре квантовых числа. Видно, что энергия электронов в многоэлектронных атомах определяется как квантовым числом n, так и l; электроны отличаются значениями ml, а у спаренных электронов различны только спины. Свободная ячейка в нашем примере означает свободную p-орбиталь, которую может занимать электрон при возбуждении атома.
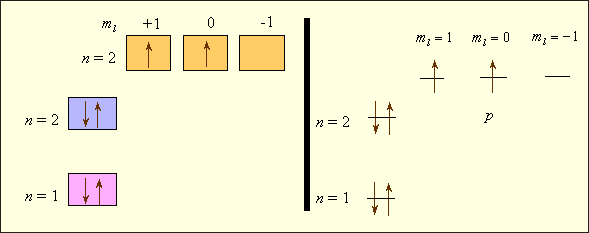
Рисунок 2.2.
Электронное строение атома углерода.
2.5. Периодическая система элементов
Исследуя изменение химических свойств элементов в зависимости от величины их относительной атомной массы (атомного веса), Д. И. Менделеев в 1869 г. открыл закон периодичности этих свойств: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомных весов элементов».
Физическая основа периодического закона была установлена в 1922 г. Н. Бором. Поскольку химические свойства обусловлены строением электронных оболочек атома, периодическая система Менделеева – это естественная классификация элементов по элекронным структурам их атомов. Простейшая основа такой классификации – число электронов в нейтральном атоме, которое равно заряду ядра. Но при образовании химической связи электроны могут перераспределяться между атомами, а заряд ядра остается неизменным, поэтому современная формулировка периодического закона гласит: «Свойства элементов находятся в периодической зависимости от зарядов ядер их атомов».
Это обстоятельство отражено в периодической системе в виде горизонтальных и вертикальных рядов – периодов и групп.
Период – горизонтальный ряд, имеющий одинаковое число электронных слоев, номер периода совпадает со значением главного квантового числа n внешнего уровня (слоя); таких периодов в периодической системе семь. Второй и последующие периоды начинаются щелочным элементом (ns1) и заканчивается благородным газом (ns2np6).
По вертикали периодическая система подразделяется на восемь групп, которые делятся на главные – А, состоящие из s- и p-элементов, и побочные – B-подгруппы, содержащие d-элементы. Подгруппа III B, кроме d-элементов, содержит по 14 4f- и 5f-элементов (4f- и 5f-семейства). Главные подгруппы содержат на внешнем электронном слое одинаковое число электронов, которое равно номеру группы.
В главных подгруппах валентные электроны (электроны, способные образовывать химические связи) расположены на s- и p-орбиталях внешнего энергетического уровня, в побочных – на s-орбиталях внешнего и d-орбиталях предвнешнего слоя. Для f-элементов валентными являются (n – 2)f- (n – 1)d- и ns-электроны.
Сходство элементов внутри каждой группы – наиболее важная закономерность в периодической системе. Следует, кроме того, отметить такую закономерность, как диагональное сходство у пар элементов Li и Mg, Be и Al, B и Si и др. Эта закономерность обусловлена тенденцией смены свойств по вертикали (в группах) и их изменением по горизонтали (в периодах).
Все сказанное выше подтверждает, что структура электронной оболочки атомов элемента изменяется периодически с ростом порядкового номера элемента. С другой стороны, свойства определяются строением электронной оболочки и, следовательно, находятся в периодической зависимости от заряда ядра атома. Далее рассматриваются некоторые периодические свойства элементов.
Связь между электронным строением элементов и их положением в периодической системе представлена в табл. 2.2.
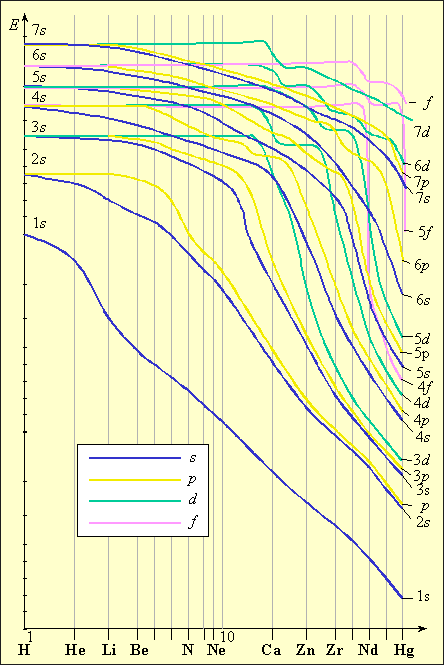
Рисунок 2.3.
Первый период (n = 1, l = 0) состоит из двух элементов H (1s1) и He (1s2).
Во втором периоде (n = 2, l = 0, 1) заполняются s- и p-орбитали от Li до Ne. Элементы называются соответсвенно s- и p-элементами.
В третьем периоде появляются пять d-орбиталей (n = 3, l = 0, 1, 2). Пока они вакантны, и третий период, как и второй, содержит восемь p-элементов элементов от Na до Ar.
Следующие за аргоном калий и кальций имеют на внешнем уровне 4s-электроны (четвертый период). Появление 4s-электронов при наличии свободных 3d-орбиталей обусловлено экранированием ядра плотным 3s23p6-электронным слоем. В связи с отталкиванием от этого слоя внешних электронов для калия и кальция реализуются [Ar]4s1- и [Ar]4s2-состояния. Сходство K и Ca с Na и Mg соответственно, кроме чисто «химического» обоснования, подтверждается также электронными спектрами.
При дальнейшем увеличении заряда у следующего за кальцием скандия 3d-состояние становится энергетически более выгодным, чем 4p, поэтому и заселяется 3d-орбиталь (рис. 2.3). Из анализа зависимости энергии электрона от порядкового номера элемента В. М. Клечковский сформулировал правило, согласно которому энергия атомных орбиталей возрастает по мере увеличения суммы (n + l). При равенстве сумм сначала заполняется уровень с меньшим n и большим l, а потом с большим n и меньшим l. Так у K и Ca заполняется 4s-орбиталь (4 + 0 = 4), а потом у Sc заполняется 3d-орбиталь (3 + 2 = 5).
Приведенные рассуждения подтверждаются экспериментальными данными об изменении энергии s-, p-, d- и f-орбиталей в зависимости от порядкового номера элемента. Как следует из рис. 1.3, значения энергии различных состояний зависит от заряда ядра Z, и чем больше Z, тем меньше различаются эти состояния по энергиям. Характер этого различия таков, что кривые, выражающие изменение энергии, пересекаются. Так для элементов K и Ca (Z = 19 и 20) энергия 3d-орбиталей выше, чем 4p, а для элементов с Z ≥ 21 энергия 3d-орбиталей ниже, чем 4p. Начиная со скандия (Z = 21) заполняется 3d-орбиталь, а во внешнем слое остаются 4s-электроны. Поэтому в четвертом периоде в ряду от Sc до Zn все десять 3d-элементов – металлы с низшей степенью окисления, как правило, 2, за счет внешних 4s-электронов. Общая электронная формула этих элементов – 3d1–104s1–2. Для хрома и меди наблюдается проскок (или провал) электрона на d-уровень: Cr – 3d54s1, Cu – 3d104s1. Такой проскок с ns- на (n – 1)d-уровень наблюдается также у Mo, Ag, Au, Pt и у других элементов и объясняется близостью энергий ns- и (n – 1)d-уровней и стабильностью наполовину и полностью заполненных уровней.
Образование катионов d-элементов связано с потерей прежде всего внеших ns- и только затем (n – 1)d-электронов. Например:
![]()
![]()
Дальше в четвертом периоде после десяти d-элементов появляются p-элементы от Ga (4s24p1) до Kr (4s24p6).
Пятый период повторяет четвертый – в нем также 18 элементов, и 4d-элементы, как и 3d образуют вставную декаду (4d 1–105s 0–2).
В шестом периоде после лантана (5d16s2) – аналога скандия и иттрия следуют 14 4f-элементов – лантаноидов. Свойства этих элементов очень близки, поскольку идет заполнение глубоколежащего (n – 2)f-подуровня. Общая формула лантаноидов 4f 2–145d 0–16s 2.
Ионы 4f-элементов образуются следующим образом:
![]()
![]()
После 4f-элементов заполняются 5d- и 6p-орбитали.
Седьмой период отчасти повторяет шестой. 5f-элементы называются актиноидами. Их общая формула 5f 2–146d 0–17s2. Далее следуют еще 6 искусственно полученных 6d-элементов незавершенного седьмого периода.
