- •Глава 1. Введение в химию 4
- •Глава 2. Электронное строение атомов 18
- •Глава 3. Химическая связь 33
- •Глава 4. Химическая термодинамика 53
- •Глава 5. Химическая кинетика 69
- •Глава 6. Растворы 83
- •Глава 7. Химические источники тока 113
- •Глава 8. Химические свойства элементов 132
- •Глава 9. Координационные соединения 162
- •Глава 1. Введение в химию
- •1.1. Понятие об атомах
- •1.2. Молекулы, радикалы и ионы
- •1.3. Номенклатура неорганических соединений
- •1.4. Законы стехиометрии
- •1.5. Химические реакции
- •Способы получения солей
- •Способы получения оксидов
- •Способы получения кислот
- •Способы получения оснований
- •Глава 2. Электронное строение атомов
- •2.1. Корпускулярно-волновые свойства частиц
- •2.2. Квантовые числа электрона
- •2.3. Заполнения атомных орбиталей
- •2.4. Электронные формулы элементов
- •2.5. Периодическая система элементов
- •2.5.1. Электронные конфигурации атомов периодической таблицы
- •2.6. Периодичность атомных характеристик
- •2.6.1. Ионные радиусы элементов
- •Глава 3. Химическая связь
- •3.1. Химическая связь
- •3.2. Типы химических связей
- •3.3. Современные представления о химической связи
- •3.3.1. Метод молекулярных орбиталей (ммо)
- •3.3.2. Двухатомные гомоядерные молекулы
- •3.3.3. Свойства двухатомных молекул p-элементов II периода
- •3.3.4. Многоатомные молекулы
- •3.3.5. Метод валентных связей (мвс)
- •3.3.6. Сравнительная характеристика ммо и мвс
- •3.3.7. Метод Гиллеспи–Найхолма
- •Глава 4. Химическая термодинамика
- •4.1. Введение в термодинамику
- •4.2. Энтальпия
- •4.3. Введение в термохимию
- •4.4. Закон Гесса
- •4.5. Энтропия
- •4.6. Энергия Гиббса
- •4.7. Химическое равновесие
- •4.8. Принцип Ле Шателье
- •4.8.1. Константы диссоциации кислот и оснований
- •4.8.2. Константы комплексообразования
- •Глава 5. Химическая кинетика
- •5.1. Скорость химических реакций
- •5.2. Закон действующих масс
- •5.3. Порядок химических реакций
- •5.4. Температура и скорость реакции
- •5.5. Катализ
- •5.6. Сложные реакции
- •5.6.1. Обратимые реакции
- •5.6.2. Последовательные реакции
- •5.6.3. Параллельные реакции
- •5.6.4. Цепные реакции
- •5.6.5. Фотохимические реакции
- •Глава 6. Растворы
- •6.1. Классификация растворов
- •6.2. Концентрация растворов
- •6.3. Растворы неэлектролитов
- •6.3.1. Закон Генри
- •6.3.3. Осмос
- •6.4. Растворы слабых электролитов
- •6.4.1. Водородный показатель pH
- •6.5. Растворы сильных электролитов
- •6.6. Кислотно-основные свойства химических соединений
- •6.7. Гидролиз солей
- •6.8. Произведение растворимости
- •6.9. Равновесие в гетерогенных системах
- •6.9.1. Диаграммы плавкости
- •Глава 7. Химические источники тока
- •7.1. Типы окислительно-восстановительных реакций
- •7.2. Электродные потенциалы и электродвижущие силы. Стандартный водородный электрод
- •7.2.1. Стандартные окислительно-восстановительные потенциалы
- •7.3. Классификация электродов
- •7.3.1. Электроды первого рода
- •.3.2. Электроды второго рода
- •7.3.3. Ионоселективные электроды
- •7.4. Химические источники тока
- •7.4.1. Типы гальванических элементов
- •7.5. Электрохимическая коррозия
- •Глава 8. Химические свойства элементов
- •8.1.1. Водород и его соединения. Гелий
- •8.1.2. Водородные соединения
- •8.1.3. Оксиды, пероксиды и гидроксиды
- •8.2.1. Важнейшие характеристики p-элементов
- •8.2.2. Гидроксиды
- •8.2.3. Отличия соединений p-элементов второго и третьего периода
- •8.2.4. Водородные соединения
- •8.2.5. Оксиды, бориды, карбиды, силициды и нитриды
- •8.2.6. Интерметаллические соединения
- •8.2.7. Благородные газы
- •8.3.1. Соединения d-элементов с легкими неметаллами
- •8.4.1. Лантаноиды
- •8.4.2. Актиноиды
- •Глава 9. Координационные соединения
- •9.1. Общие сведения о координационных соединениях
- •9.2. Изомерия координационных соединений
- •9.3. Устойчивость координационных соединений в растворах
- •9.4. Химическая связь в координационных соединениях
- •9.4.1. Метод валентных связей
- •9.4.2. Теория кристаллического поля
- •9.4.3. Теория поля лигандов
- •9.5. Электронная конфигурация комплексообразователя
- •9.6. Реакции с участием координационных соединений
- •9.7. Координационные соединения p- и s-элементов
9.3. Устойчивость координационных соединений в растворах
Химические свойства комплексного иона с известной электронной конфигурацией и геометрическим строением определяются двумя факторами: а) способностью равновесной системы при определенных условиях к превращениям; б) скоростью, с которой могут происходить превращения, ведущие к достижению равновесного состояния системы.
Первый определяет термодинамическую, а второй – кинетическую устойчивость комплексного соединения. Кинетическая устойчивость зависит от многих факторов, поэтому обычно поддается лишь качественной оценке.
В противоположность ей термодинамическая устойчивость может быть легко охарактеризована количественно с помощью констант равновесия.
В растворе ион металла M и монодентатный лиганд L взаимодействуют ступенчато с образованием комплексного иона [MLn] по схеме:
|
|
|
|
|
|
где Ki – ступенчатые константы образования (устойчивости) отдельных комплексов [MLi].
Поскольку
в этой системе существует лишь n
независимых равновесий, полная константа
процесса M + nL
= MLn
– общая константа образования:
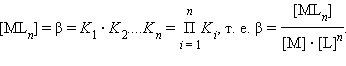
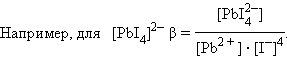
Чем больше константа устойчивости, тем более прочным является данный комплекс, поскольку ΔG° = –RT lnβ.
Образование прочных комплексных ионов может быть использовано для растворения труднорастворимых электролитов. Концентрация ионов в растворе определяется величиной произведения растворимости такого электролита. Добавляя в раствор вещества, образующие с одним из его ионов комплексное соединение, можно во многих случаях достичь растворения осадка за счет комплексообразования. Добиться этого тем легче, чем больше величина произведения растворимости и чем больше константа устойчивости комплексного иона. Например, хлорид серебра AgCl растворяется в избытке аммиака, образуя [Ag(NH3)2]Cl. Менее растворимый AgI в аммиаке практически не растворим, но растворяется в тиосульфате натрия Na2S2O3 по реакции
|
|
|
поскольку β[Ag(S2O3)2]3– на несколько порядков больше β[Ag(NH3)2]+.
Комплексные ионы участвуют в реакциях обмена с образованием более прочного или менее растворимого соединения:
|
|
|
Здесь M = Ni2+, Cu2+, Fe2+.
9.4. Химическая связь в координационных соединениях
Образование химической связи в координационных соединениях объясняется с использованием как упомянутых в главе 3 методов валентных связей (МВС) и молекулярных орбиталей (ММО), так и специфического приближения – теории кристаллического поля (ТКП).
9.4.1. Метод валентных связей
В основу метода МВС положено допущение, что координационный ион (соединение) образуется по донорно-акцепторному механизму за счет неподеленных электронных пар лигандов (доноров) и свободных гибридных орбиталей иона комплексообразователя (акцептора).
Образование парамагнитного иона [FeF6]4– можно представить таким образом. Свободный ион Fe2+ имеет электронную конфигурацию d6 и следующее распределение электронов по орбиталям:
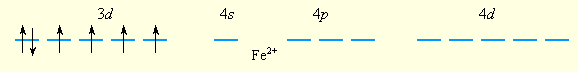
Шесть ионов F– смещают по одной из своих неподеленных электронных пар на вакантные sp3d2-гибридные орбитали иона Fe2+. Четыре неспаренных электрона иона Fe2+ сохраняются и обусловливают высокий спин иона [FeF6]4–:
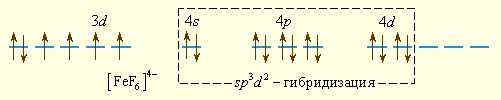
Так как число неспаренных электронов в комплексе и свободном ионе Fe2+ совпадает, то комплекс [FeF6]4– называется высокоспиновым.
Ионы CN– значительно сильнее взаимодействуют с ионом железа (II), следствием чего является спаривание d-электронов центрального иона и образование низкоспинового комплекса [Fe(CN)6]4– с d2sp3-гибридизацией.
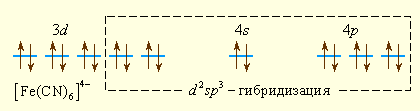
Аналогично можно представить образование и других комплексных ионов:
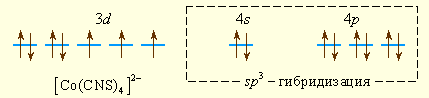
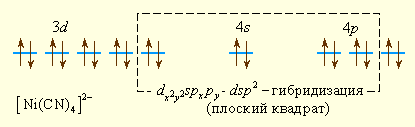
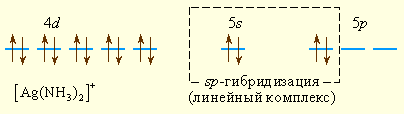
Комплексообразователем может быть не только положительный ион металла, но и металл в нулевой степени окисления, например, в карбонилах металлов – соединениях с общей формулой [M(CO)n]. Связь в таких соединениях можно объяснить с позиций МВС в рамках правила 18 электронов: устойчивы такие карбонилы, в которых все d- , s- и p-орбитали металла заполнены электронными парами. Стабильны карбонилы [Cr(CO)6], [Fe(CO)5], [Ni(CO)4].
У пентакарбонила железа [Fe(CO)5–]-d1sp3-гибридизация.
Если металл имеет нечетное число электронов, то карбонилы димерны: [Mn(CO)5]2, [Co(CO)4]2.