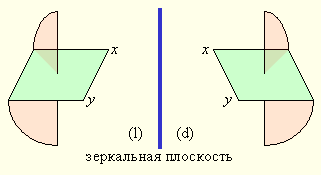- •Глава 1. Введение в химию 4
- •Глава 2. Электронное строение атомов 18
- •Глава 3. Химическая связь 33
- •Глава 4. Химическая термодинамика 53
- •Глава 5. Химическая кинетика 69
- •Глава 6. Растворы 83
- •Глава 7. Химические источники тока 113
- •Глава 8. Химические свойства элементов 132
- •Глава 9. Координационные соединения 162
- •Глава 1. Введение в химию
- •1.1. Понятие об атомах
- •1.2. Молекулы, радикалы и ионы
- •1.3. Номенклатура неорганических соединений
- •1.4. Законы стехиометрии
- •1.5. Химические реакции
- •Способы получения солей
- •Способы получения оксидов
- •Способы получения кислот
- •Способы получения оснований
- •Глава 2. Электронное строение атомов
- •2.1. Корпускулярно-волновые свойства частиц
- •2.2. Квантовые числа электрона
- •2.3. Заполнения атомных орбиталей
- •2.4. Электронные формулы элементов
- •2.5. Периодическая система элементов
- •2.5.1. Электронные конфигурации атомов периодической таблицы
- •2.6. Периодичность атомных характеристик
- •2.6.1. Ионные радиусы элементов
- •Глава 3. Химическая связь
- •3.1. Химическая связь
- •3.2. Типы химических связей
- •3.3. Современные представления о химической связи
- •3.3.1. Метод молекулярных орбиталей (ммо)
- •3.3.2. Двухатомные гомоядерные молекулы
- •3.3.3. Свойства двухатомных молекул p-элементов II периода
- •3.3.4. Многоатомные молекулы
- •3.3.5. Метод валентных связей (мвс)
- •3.3.6. Сравнительная характеристика ммо и мвс
- •3.3.7. Метод Гиллеспи–Найхолма
- •Глава 4. Химическая термодинамика
- •4.1. Введение в термодинамику
- •4.2. Энтальпия
- •4.3. Введение в термохимию
- •4.4. Закон Гесса
- •4.5. Энтропия
- •4.6. Энергия Гиббса
- •4.7. Химическое равновесие
- •4.8. Принцип Ле Шателье
- •4.8.1. Константы диссоциации кислот и оснований
- •4.8.2. Константы комплексообразования
- •Глава 5. Химическая кинетика
- •5.1. Скорость химических реакций
- •5.2. Закон действующих масс
- •5.3. Порядок химических реакций
- •5.4. Температура и скорость реакции
- •5.5. Катализ
- •5.6. Сложные реакции
- •5.6.1. Обратимые реакции
- •5.6.2. Последовательные реакции
- •5.6.3. Параллельные реакции
- •5.6.4. Цепные реакции
- •5.6.5. Фотохимические реакции
- •Глава 6. Растворы
- •6.1. Классификация растворов
- •6.2. Концентрация растворов
- •6.3. Растворы неэлектролитов
- •6.3.1. Закон Генри
- •6.3.3. Осмос
- •6.4. Растворы слабых электролитов
- •6.4.1. Водородный показатель pH
- •6.5. Растворы сильных электролитов
- •6.6. Кислотно-основные свойства химических соединений
- •6.7. Гидролиз солей
- •6.8. Произведение растворимости
- •6.9. Равновесие в гетерогенных системах
- •6.9.1. Диаграммы плавкости
- •Глава 7. Химические источники тока
- •7.1. Типы окислительно-восстановительных реакций
- •7.2. Электродные потенциалы и электродвижущие силы. Стандартный водородный электрод
- •7.2.1. Стандартные окислительно-восстановительные потенциалы
- •7.3. Классификация электродов
- •7.3.1. Электроды первого рода
- •.3.2. Электроды второго рода
- •7.3.3. Ионоселективные электроды
- •7.4. Химические источники тока
- •7.4.1. Типы гальванических элементов
- •7.5. Электрохимическая коррозия
- •Глава 8. Химические свойства элементов
- •8.1.1. Водород и его соединения. Гелий
- •8.1.2. Водородные соединения
- •8.1.3. Оксиды, пероксиды и гидроксиды
- •8.2.1. Важнейшие характеристики p-элементов
- •8.2.2. Гидроксиды
- •8.2.3. Отличия соединений p-элементов второго и третьего периода
- •8.2.4. Водородные соединения
- •8.2.5. Оксиды, бориды, карбиды, силициды и нитриды
- •8.2.6. Интерметаллические соединения
- •8.2.7. Благородные газы
- •8.3.1. Соединения d-элементов с легкими неметаллами
- •8.4.1. Лантаноиды
- •8.4.2. Актиноиды
- •Глава 9. Координационные соединения
- •9.1. Общие сведения о координационных соединениях
- •9.2. Изомерия координационных соединений
- •9.3. Устойчивость координационных соединений в растворах
- •9.4. Химическая связь в координационных соединениях
- •9.4.1. Метод валентных связей
- •9.4.2. Теория кристаллического поля
- •9.4.3. Теория поля лигандов
- •9.5. Электронная конфигурация комплексообразователя
- •9.6. Реакции с участием координационных соединений
- •9.7. Координационные соединения p- и s-элементов
9.2. Изомерия координационных соединений
Многообразие координационных соединений обусловлено образованием изомеров – соединений одинаковых по составу, но отличающихся расположением лигандов вокруг центрального атома.
Гидратная (сольватная) изомерия обусловлена различным расположением молекул воды и анионных лигандов между внутренней и внешней сферами. Например, CrCl3∙6H2O существует по крайней мере в трех изомерных формах: [Cr(H2O)6]Cl3 – трихлорид гексааквахрома (III+) – фиолетового цвета, [CrCl(H2O)5]Cl2∙H2O – моногидрат дихлорид пентааквахлорохрома (III+) – сине-зеленого цвета, [CrCl2(H2O)4]Cl∙2H2O – дигидрат хлорид тетрааквадихлорохрома (III+) – зеленого цвета.
Эти изомеры по-разному реагируют с раствором AgNO3. При действии AgNO3 фиолетовое соединение выделяет в осадок весь хлор, сине-зеленое – 2/3, а зеленое – только 1/3 хлора, имеющегося в соединении.
Ионизационная изомерия характеризуется различным распределением ионов между внешними и внутренними сферами комплексных соединений и, как следствие этого, различным характером диссоциации на ионы. Например, для соединения CoBrSO4∙5NH3 известны два изомера: [CoBr(NH3)5]SO4 – красно-фиолетового цвета и [CoSO4(NH3)5]Br – красного цвета.
Координационная изомерия заключается в различном распределении лигандов во внутренних координационных сферах. По-разному взаимодействуют с AgNO3 два изомера – [Co(NH3)6]∙[Cr(CN)6] и [Cr(NH3)6]∙[Co(CN)6]. Первое соединение дает осадок Ag3[Cr(CN)6], а второе – осадок Ag3[Co(CN)6].
|
Рисунок 9.1. |
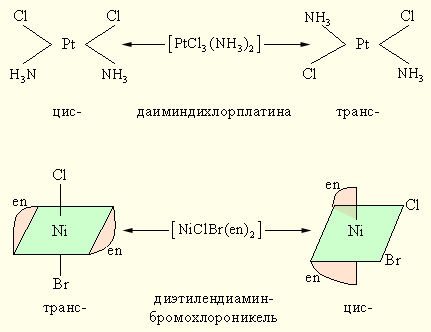
Геометрическая изомерия (цис-транс изомерия) состоит в различном пространственном расположениии лигандов вокруг центрального атома. Так, [PtCl2(NH3)2] существует в виде двух изомерных форм, отличающихся друг от друга рядом свойств.
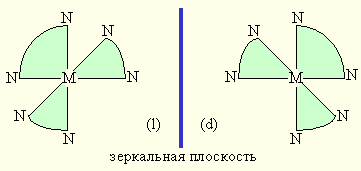
Оптическая изомерия. Оптическая изомерия характеризуется способностью вращать плоскость поляризации плоскополяризованного света. Два изомера отличаются друг от друга направлением вращения плоскости поляризации: один называют правым, другой – левым изомером. Правые и левые изомеры оказываются зеркальными изображениями друг друга и не могут быть совмещены в пространстве (рис. 9.2).
Из двух геометрических изомеров диэтилендиаминбромохлороникеля (II) только цис-изомер может существовать в виде двух оптических модификаций. Изомеры такого рода называются энантиомерами (рис. 9.3).
|
|
Основным признаком оптически активных соединений является отсутствие плоскостей симметрии, кроме зеркальной. При смешении оптических изомеров в растворе происходит их рацемизация, приводящая к потере способности такой эквимолярной смеси вращать плоскость поляризации света из-за образования эквимолекулярной смеси лево- (l) и правовращающих (d) изомеров.
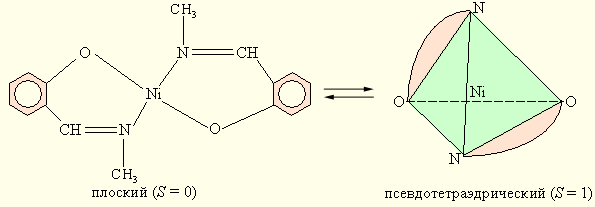
Структурная изомерия. Структурными называют такие координационные изомеры, в которых происходит изменение симметрии (стереохимии) координационной сферы. Так, у бис (N-метилсалицилиденамината) никеля (II) наблюдается равновесие между плоским и псевдотетраэдрическим строением.
|
Рисунок 9.4. |
Частным случаем структурной изомерии, связанной с изменением спинового состояния центрального атома, является так называемая спиновая изомерия, при которой под воздействием внешних факторов (температуры, давления) происходит смена спинового состояния, приводящая к уменьшению межатомного расстояния центральный ион – донорный атом при переходе из высокоспинового в низкоспиновое состояние