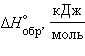- •Глава 1. Введение в химию 4
- •Глава 2. Электронное строение атомов 18
- •Глава 3. Химическая связь 33
- •Глава 4. Химическая термодинамика 53
- •Глава 5. Химическая кинетика 69
- •Глава 6. Растворы 83
- •Глава 7. Химические источники тока 113
- •Глава 8. Химические свойства элементов 132
- •Глава 9. Координационные соединения 162
- •Глава 1. Введение в химию
- •1.1. Понятие об атомах
- •1.2. Молекулы, радикалы и ионы
- •1.3. Номенклатура неорганических соединений
- •1.4. Законы стехиометрии
- •1.5. Химические реакции
- •Способы получения солей
- •Способы получения оксидов
- •Способы получения кислот
- •Способы получения оснований
- •Глава 2. Электронное строение атомов
- •2.1. Корпускулярно-волновые свойства частиц
- •2.2. Квантовые числа электрона
- •2.3. Заполнения атомных орбиталей
- •2.4. Электронные формулы элементов
- •2.5. Периодическая система элементов
- •2.5.1. Электронные конфигурации атомов периодической таблицы
- •2.6. Периодичность атомных характеристик
- •2.6.1. Ионные радиусы элементов
- •Глава 3. Химическая связь
- •3.1. Химическая связь
- •3.2. Типы химических связей
- •3.3. Современные представления о химической связи
- •3.3.1. Метод молекулярных орбиталей (ммо)
- •3.3.2. Двухатомные гомоядерные молекулы
- •3.3.3. Свойства двухатомных молекул p-элементов II периода
- •3.3.4. Многоатомные молекулы
- •3.3.5. Метод валентных связей (мвс)
- •3.3.6. Сравнительная характеристика ммо и мвс
- •3.3.7. Метод Гиллеспи–Найхолма
- •Глава 4. Химическая термодинамика
- •4.1. Введение в термодинамику
- •4.2. Энтальпия
- •4.3. Введение в термохимию
- •4.4. Закон Гесса
- •4.5. Энтропия
- •4.6. Энергия Гиббса
- •4.7. Химическое равновесие
- •4.8. Принцип Ле Шателье
- •4.8.1. Константы диссоциации кислот и оснований
- •4.8.2. Константы комплексообразования
- •Глава 5. Химическая кинетика
- •5.1. Скорость химических реакций
- •5.2. Закон действующих масс
- •5.3. Порядок химических реакций
- •5.4. Температура и скорость реакции
- •5.5. Катализ
- •5.6. Сложные реакции
- •5.6.1. Обратимые реакции
- •5.6.2. Последовательные реакции
- •5.6.3. Параллельные реакции
- •5.6.4. Цепные реакции
- •5.6.5. Фотохимические реакции
- •Глава 6. Растворы
- •6.1. Классификация растворов
- •6.2. Концентрация растворов
- •6.3. Растворы неэлектролитов
- •6.3.1. Закон Генри
- •6.3.3. Осмос
- •6.4. Растворы слабых электролитов
- •6.4.1. Водородный показатель pH
- •6.5. Растворы сильных электролитов
- •6.6. Кислотно-основные свойства химических соединений
- •6.7. Гидролиз солей
- •6.8. Произведение растворимости
- •6.9. Равновесие в гетерогенных системах
- •6.9.1. Диаграммы плавкости
- •Глава 7. Химические источники тока
- •7.1. Типы окислительно-восстановительных реакций
- •7.2. Электродные потенциалы и электродвижущие силы. Стандартный водородный электрод
- •7.2.1. Стандартные окислительно-восстановительные потенциалы
- •7.3. Классификация электродов
- •7.3.1. Электроды первого рода
- •.3.2. Электроды второго рода
- •7.3.3. Ионоселективные электроды
- •7.4. Химические источники тока
- •7.4.1. Типы гальванических элементов
- •7.5. Электрохимическая коррозия
- •Глава 8. Химические свойства элементов
- •8.1.1. Водород и его соединения. Гелий
- •8.1.2. Водородные соединения
- •8.1.3. Оксиды, пероксиды и гидроксиды
- •8.2.1. Важнейшие характеристики p-элементов
- •8.2.2. Гидроксиды
- •8.2.3. Отличия соединений p-элементов второго и третьего периода
- •8.2.4. Водородные соединения
- •8.2.5. Оксиды, бориды, карбиды, силициды и нитриды
- •8.2.6. Интерметаллические соединения
- •8.2.7. Благородные газы
- •8.3.1. Соединения d-элементов с легкими неметаллами
- •8.4.1. Лантаноиды
- •8.4.2. Актиноиды
- •Глава 9. Координационные соединения
- •9.1. Общие сведения о координационных соединениях
- •9.2. Изомерия координационных соединений
- •9.3. Устойчивость координационных соединений в растворах
- •9.4. Химическая связь в координационных соединениях
- •9.4.1. Метод валентных связей
- •9.4.2. Теория кристаллического поля
- •9.4.3. Теория поля лигандов
- •9.5. Электронная конфигурация комплексообразователя
- •9.6. Реакции с участием координационных соединений
- •9.7. Координационные соединения p- и s-элементов
8.2.6. Интерметаллические соединения
Металлы характеризуются склонностью сплавляться друг с другом, образуя твердые растворы и химические соединения, называемые интерметаллическими, или интерметаллидами.
В противоположность твердым растворам интерметаллиды имеют кристаллическую структуру, отличную от структур исходных металлов. Состав интерметаллических соединений не всегда подчиняется правилам валентности, но эти соединения имеют ярко выраженную индивидуальность свойств. Два металла могут образовывать между собой не одно, а несколько соединений, например, NaSn3, NaSn2, NaSn, Na4Sn3, Na2Sn, Na4Sn и др., существующие лишь в определенных пределах состава и температуры.
Устойчивость
интерметаллидов определяется природой
взаимодействующих металлов. Чем сильнее
отличаются металлы по своей природе и
электроотрицательности (ЭО), тем более
прочные соединения они образуют, а их
образование сопровождается значительным
экзотермическим эффектом. Эту
закономерность можно наблюдать на
примере соединений Mg с металлами II–V
групп, в которых
![]() резко
повышается при переходе от MgZn к
резко
повышается при переходе от MgZn к
![]() (табл. 8.7).
(табл. 8.7).
Интерметаллид
|
||||||||||||
Таблица 8.7. Интерметаллиды магния. |
Среди соединений различают два типа: валентные и электронные.
Валентные интерметаллиды, как правило, образуют металлы с заметно отличающимися электроотрицательностями. Диаграммы плавкости в этом случае имеют четко выраженный максимум, соответствующий составу интерметаллида. Формула последнего отвечает обычным валентностям элементов (Na2Sn, Na4Sn, Mg2Ge, Mg2Sn, Mg3Sb2, Mg3Al2. Связь в таких соединениях ковалентно-полярная, растет с уменьшением ΔОЭО атомов. При электролизе расплавов валентных интерметаллидов на аноде осаждается более электроотрицательный металл.
Типичные металлы образуют второй тип интерметаллидов – электронные соединения. В них элементы не проявляют своих характерных степеней окисления. Их состав определяется не свойствами взаимодействующих компонентов, а формальной электронной концентрацией (ФЭК), т. е. отношением числа валентных электронов к числу взаимодействующих атомов в формуле. В соответствии со значениями ФЭК (табл. 8.8) большинство известных электронных соединений можно отнести к трем типам со свойственными им кристаллическими решетками. Для первого типа ФЭК равна 3/2, для второго – 21/13, третьего – 7/4.
Формула интерметаллида
|
||||||||||||||||||||||||||||||||
Таблица 8.8. Интерметаллиды электронного типа. |