- •Глава 1. Введение в химию 4
- •Глава 2. Электронное строение атомов 18
- •Глава 3. Химическая связь 33
- •Глава 4. Химическая термодинамика 53
- •Глава 5. Химическая кинетика 69
- •Глава 6. Растворы 83
- •Глава 7. Химические источники тока 113
- •Глава 8. Химические свойства элементов 132
- •Глава 9. Координационные соединения 162
- •Глава 1. Введение в химию
- •1.1. Понятие об атомах
- •1.2. Молекулы, радикалы и ионы
- •1.3. Номенклатура неорганических соединений
- •1.4. Законы стехиометрии
- •1.5. Химические реакции
- •Способы получения солей
- •Способы получения оксидов
- •Способы получения кислот
- •Способы получения оснований
- •Глава 2. Электронное строение атомов
- •2.1. Корпускулярно-волновые свойства частиц
- •2.2. Квантовые числа электрона
- •2.3. Заполнения атомных орбиталей
- •2.4. Электронные формулы элементов
- •2.5. Периодическая система элементов
- •2.5.1. Электронные конфигурации атомов периодической таблицы
- •2.6. Периодичность атомных характеристик
- •2.6.1. Ионные радиусы элементов
- •Глава 3. Химическая связь
- •3.1. Химическая связь
- •3.2. Типы химических связей
- •3.3. Современные представления о химической связи
- •3.3.1. Метод молекулярных орбиталей (ммо)
- •3.3.2. Двухатомные гомоядерные молекулы
- •3.3.3. Свойства двухатомных молекул p-элементов II периода
- •3.3.4. Многоатомные молекулы
- •3.3.5. Метод валентных связей (мвс)
- •3.3.6. Сравнительная характеристика ммо и мвс
- •3.3.7. Метод Гиллеспи–Найхолма
- •Глава 4. Химическая термодинамика
- •4.1. Введение в термодинамику
- •4.2. Энтальпия
- •4.3. Введение в термохимию
- •4.4. Закон Гесса
- •4.5. Энтропия
- •4.6. Энергия Гиббса
- •4.7. Химическое равновесие
- •4.8. Принцип Ле Шателье
- •4.8.1. Константы диссоциации кислот и оснований
- •4.8.2. Константы комплексообразования
- •Глава 5. Химическая кинетика
- •5.1. Скорость химических реакций
- •5.2. Закон действующих масс
- •5.3. Порядок химических реакций
- •5.4. Температура и скорость реакции
- •5.5. Катализ
- •5.6. Сложные реакции
- •5.6.1. Обратимые реакции
- •5.6.2. Последовательные реакции
- •5.6.3. Параллельные реакции
- •5.6.4. Цепные реакции
- •5.6.5. Фотохимические реакции
- •Глава 6. Растворы
- •6.1. Классификация растворов
- •6.2. Концентрация растворов
- •6.3. Растворы неэлектролитов
- •6.3.1. Закон Генри
- •6.3.3. Осмос
- •6.4. Растворы слабых электролитов
- •6.4.1. Водородный показатель pH
- •6.5. Растворы сильных электролитов
- •6.6. Кислотно-основные свойства химических соединений
- •6.7. Гидролиз солей
- •6.8. Произведение растворимости
- •6.9. Равновесие в гетерогенных системах
- •6.9.1. Диаграммы плавкости
- •Глава 7. Химические источники тока
- •7.1. Типы окислительно-восстановительных реакций
- •7.2. Электродные потенциалы и электродвижущие силы. Стандартный водородный электрод
- •7.2.1. Стандартные окислительно-восстановительные потенциалы
- •7.3. Классификация электродов
- •7.3.1. Электроды первого рода
- •.3.2. Электроды второго рода
- •7.3.3. Ионоселективные электроды
- •7.4. Химические источники тока
- •7.4.1. Типы гальванических элементов
- •7.5. Электрохимическая коррозия
- •Глава 8. Химические свойства элементов
- •8.1.1. Водород и его соединения. Гелий
- •8.1.2. Водородные соединения
- •8.1.3. Оксиды, пероксиды и гидроксиды
- •8.2.1. Важнейшие характеристики p-элементов
- •8.2.2. Гидроксиды
- •8.2.3. Отличия соединений p-элементов второго и третьего периода
- •8.2.4. Водородные соединения
- •8.2.5. Оксиды, бориды, карбиды, силициды и нитриды
- •8.2.6. Интерметаллические соединения
- •8.2.7. Благородные газы
- •8.3.1. Соединения d-элементов с легкими неметаллами
- •8.4.1. Лантаноиды
- •8.4.2. Актиноиды
- •Глава 9. Координационные соединения
- •9.1. Общие сведения о координационных соединениях
- •9.2. Изомерия координационных соединений
- •9.3. Устойчивость координационных соединений в растворах
- •9.4. Химическая связь в координационных соединениях
- •9.4.1. Метод валентных связей
- •9.4.2. Теория кристаллического поля
- •9.4.3. Теория поля лигандов
- •9.5. Электронная конфигурация комплексообразователя
- •9.6. Реакции с участием координационных соединений
- •9.7. Координационные соединения p- и s-элементов
7.5. Электрохимическая коррозия
В основе коррозийных процессов лежат окислительно-восстановительные реакции металлов с окружающей средой, сопровождающиеся переходом металлов в более термодинамически устойчивое состояние.
Рассмотрим коррозию железа как электрохимический процесс. Ржавление железа есть не что иное, как анодная реакция
|
|
|
Катодная реакция – восстановление атмосферного кислорода:
|
|
|
Водородные ионы поставляет вода. Если бы в воде не было растворенного кислорода, то коррозия была бы невозможна. Следовательно, железо корродирует в слое воды, насыщенном кислородом. Таким образом, начальную стадию коррозии железа можно передать реакцией
|
2Fe + O2 + 4H+ → 2FeO + 2H2O. |
|
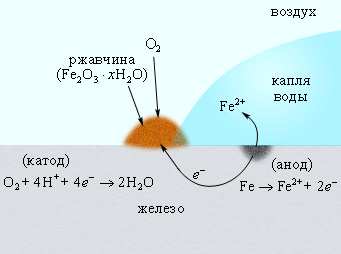
На скорость коррозии существенное влияние оказывает концентрация ионов H+. Повышение pH приводит к замедлению коррозии, поскольку восстановление O2 из H2O замедляется. При pH = 9–10 коррозия железа практически прекращается. Известно, что в водной среде ионы Fe2+ в присутствии кислорода окисляются до Fe3+. Вторая стадия коррозии соответствует реакции образования гидратированного оксида железа (ржавчины) Fe2O3∙nH2O (рис. 7.4):
|
4Fe2+ + O2 + 4H2O + xH2O = 2Fe2O3∙xH2O + 8H+. |
|
Рисунок 7.4. Коррозия железа кислородом воздуха, растворенным в воде. |
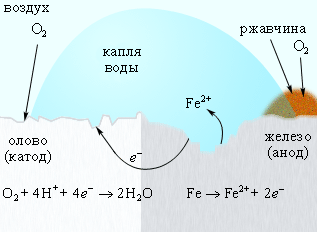
Для защиты железа от коррозии используются всевозможные покрытия: краска, слой металла (олова, цинка). При этом краска и олово предохраняют от коррозии до тех пор, пока защитный слой цел. Появление в нем трещин и царапин способствует проникновению влаги и воздуха к поверхности железа, и процесс коррозии возобновляется, причем в случае оловянного покрытия он даже ускоряется, поскольку олово служит катодом в электрохимическом процессе (рис. 7.5).
|
Рисунок 7.5. Коррозия «белой жести». |
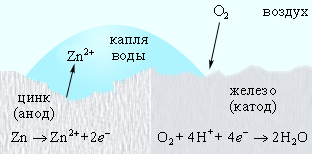
Оцинкованное железо ведет себя иначе. Поскольку цинк выполняет роль анода, то его защитная функция сохраняется и при нарушении цинкового покрытия (рис. 7.6).
|
Рисунок 7.6. Катодная защита в оцинкованном железе. |
Катодная защита широко используется для уменьшения коррозии подземных и подводных трубопроводов и стальных опор высоковольтных передач, нефтяных платформ и причалов.
Глава 8. Химические свойства элементов
8.1. s-Элементы
Элементы IА и IIА подгрупп, у которых заполняется внешний ns-уровень, относятся к s-элементам: ns1 – Li, Na, K, Rb, Cs, Fr называют щелочными, а ns2 – Be, Mg, Ca, Sr, Ba, Ra – щелочноземельными. Из приведенных в таб. 8.1 данных следует:
Степени окисления элементов ns1 и ns2 всегда равны номеру группы (+1 и +2).
В основном состоянии атомы ns2-элементов не имеют неспаренных электронов, поэтому образованию ковалентной связи в соединениях этих элементов предшествует возбуждение ns2 → ns1np1 с последующей гибридизацией sp-типа, определяющей линейное строение трехатомных молекул ЭX2.
Для ns1-элементов характерно образование двухатомных молекул Э2(σсв)2(σ*)0; для ns2-элементов образование Э2 невозможно из-за равной заселенности связывающих и разрыхляющих σ-орбиталей.
Величины E°s-элементов предопределяют их восстановительные свойства, увеличиваясь при движении в подгруппе сверху вниз. Все s-элементы вытесняют водород из воды и кислот, восстанавливают оксиды металлов и неметаллов до простых веществ.
Ионность связи Э–Х возрастает в подгруппе сверху вниз, а в случае оснований удлинение связи Э–OH ведет к увеличению основности.
В соединениях LiX и BeX2 связь Э–Х преимущественно ковалентная (малополярная).
Элементы ns1(n = 2–6)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Таблица 8.1. Важнейшие характеристики s-элементов. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
s-Металлы хранят в инертной атмосфере или под слоем жидких углеводородов, а получают обычно электролизом расплавов. Соли s-элементов окрашивают пламя в цвета: лития – в алый, натрия – в желтый, калия – в сине-фиолетовый, рубидия – в темно-красный, цезия – в бледно-голубой, кальция – в оранжево-красный, стронция – в темно-красный, бария – в светло-зеленый.
Большинство солей растворимо в воде. К нерастворимым относят LiCO3, KClO4, ЭCO3, ЭSO4, Э3(PO4)2 (Э = Ca, Sr, Ba), некоторые ЭF2.