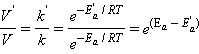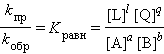- •Глава 1. Введение в химию 4
- •Глава 2. Электронное строение атомов 18
- •Глава 3. Химическая связь 33
- •Глава 4. Химическая термодинамика 53
- •Глава 5. Химическая кинетика 69
- •Глава 6. Растворы 83
- •Глава 7. Химические источники тока 113
- •Глава 8. Химические свойства элементов 132
- •Глава 9. Координационные соединения 162
- •Глава 1. Введение в химию
- •1.1. Понятие об атомах
- •1.2. Молекулы, радикалы и ионы
- •1.3. Номенклатура неорганических соединений
- •1.4. Законы стехиометрии
- •1.5. Химические реакции
- •Способы получения солей
- •Способы получения оксидов
- •Способы получения кислот
- •Способы получения оснований
- •Глава 2. Электронное строение атомов
- •2.1. Корпускулярно-волновые свойства частиц
- •2.2. Квантовые числа электрона
- •2.3. Заполнения атомных орбиталей
- •2.4. Электронные формулы элементов
- •2.5. Периодическая система элементов
- •2.5.1. Электронные конфигурации атомов периодической таблицы
- •2.6. Периодичность атомных характеристик
- •2.6.1. Ионные радиусы элементов
- •Глава 3. Химическая связь
- •3.1. Химическая связь
- •3.2. Типы химических связей
- •3.3. Современные представления о химической связи
- •3.3.1. Метод молекулярных орбиталей (ммо)
- •3.3.2. Двухатомные гомоядерные молекулы
- •3.3.3. Свойства двухатомных молекул p-элементов II периода
- •3.3.4. Многоатомные молекулы
- •3.3.5. Метод валентных связей (мвс)
- •3.3.6. Сравнительная характеристика ммо и мвс
- •3.3.7. Метод Гиллеспи–Найхолма
- •Глава 4. Химическая термодинамика
- •4.1. Введение в термодинамику
- •4.2. Энтальпия
- •4.3. Введение в термохимию
- •4.4. Закон Гесса
- •4.5. Энтропия
- •4.6. Энергия Гиббса
- •4.7. Химическое равновесие
- •4.8. Принцип Ле Шателье
- •4.8.1. Константы диссоциации кислот и оснований
- •4.8.2. Константы комплексообразования
- •Глава 5. Химическая кинетика
- •5.1. Скорость химических реакций
- •5.2. Закон действующих масс
- •5.3. Порядок химических реакций
- •5.4. Температура и скорость реакции
- •5.5. Катализ
- •5.6. Сложные реакции
- •5.6.1. Обратимые реакции
- •5.6.2. Последовательные реакции
- •5.6.3. Параллельные реакции
- •5.6.4. Цепные реакции
- •5.6.5. Фотохимические реакции
- •Глава 6. Растворы
- •6.1. Классификация растворов
- •6.2. Концентрация растворов
- •6.3. Растворы неэлектролитов
- •6.3.1. Закон Генри
- •6.3.3. Осмос
- •6.4. Растворы слабых электролитов
- •6.4.1. Водородный показатель pH
- •6.5. Растворы сильных электролитов
- •6.6. Кислотно-основные свойства химических соединений
- •6.7. Гидролиз солей
- •6.8. Произведение растворимости
- •6.9. Равновесие в гетерогенных системах
- •6.9.1. Диаграммы плавкости
- •Глава 7. Химические источники тока
- •7.1. Типы окислительно-восстановительных реакций
- •7.2. Электродные потенциалы и электродвижущие силы. Стандартный водородный электрод
- •7.2.1. Стандартные окислительно-восстановительные потенциалы
- •7.3. Классификация электродов
- •7.3.1. Электроды первого рода
- •.3.2. Электроды второго рода
- •7.3.3. Ионоселективные электроды
- •7.4. Химические источники тока
- •7.4.1. Типы гальванических элементов
- •7.5. Электрохимическая коррозия
- •Глава 8. Химические свойства элементов
- •8.1.1. Водород и его соединения. Гелий
- •8.1.2. Водородные соединения
- •8.1.3. Оксиды, пероксиды и гидроксиды
- •8.2.1. Важнейшие характеристики p-элементов
- •8.2.2. Гидроксиды
- •8.2.3. Отличия соединений p-элементов второго и третьего периода
- •8.2.4. Водородные соединения
- •8.2.5. Оксиды, бориды, карбиды, силициды и нитриды
- •8.2.6. Интерметаллические соединения
- •8.2.7. Благородные газы
- •8.3.1. Соединения d-элементов с легкими неметаллами
- •8.4.1. Лантаноиды
- •8.4.2. Актиноиды
- •Глава 9. Координационные соединения
- •9.1. Общие сведения о координационных соединениях
- •9.2. Изомерия координационных соединений
- •9.3. Устойчивость координационных соединений в растворах
- •9.4. Химическая связь в координационных соединениях
- •9.4.1. Метод валентных связей
- •9.4.2. Теория кристаллического поля
- •9.4.3. Теория поля лигандов
- •9.5. Электронная конфигурация комплексообразователя
- •9.6. Реакции с участием координационных соединений
- •9.7. Координационные соединения p- и s-элементов
5.5. Катализ
Изменить величину Ea можно с помощью катализаторов. Вещества, принимающие участие, но не расходующиеся в процессе реакции, назваются катализаторами. Само это явление называется катализом.
В зависимости от того, находится ли катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном или гетерогенном катализе. Механизм каталитического действия для них не одинков, однако и в том и в другом случае происходит ускорение реакции за счет снижения Ea.
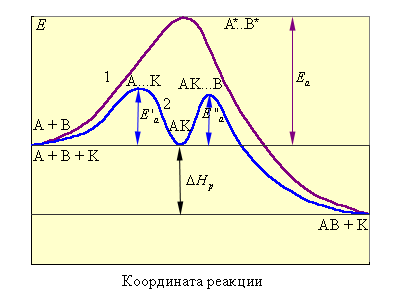
Так, медленно протекающая реакция A + B → А…B → AB (ΔG < 0) в присутствии катализатора идет с большей скоростью в две стадии:
|
|
|
|
т. е. образуются частицы промежуточного соединения AK (катализатора с реагентами), затем активный комплекс AKB и конечные продукты с регенерацией катализатора. Следовательно, каталитический путь оказывается кинетически более выгодным, чем прямое взаимодействие исходных веществ. Существует ряд специфических катализаторов – ингибиторов, снижающих скорость реакции.
|
Рисунок 5.5. Изображение реакционного пути некаталитической A + B → AB реакции (кривая 1) и гомогенной каталитической реакции (кривая 2). |
Увеличение скорости реакции в присутствии катализатора определяется формулой
|
|
|
где
![]()
![]() – параметры каталитического процесса,
V,
k,
– параметры каталитического процесса,
V,
k,
![]() –
некаталитического процесса ln
–
некаталитического процесса ln
![]() /k
= 2,303 lg
/k
=
–
/RT.
/k
= 2,303 lg
/k
=
–
/RT.
5.6. Сложные реакции
Большинство химических реакций идут не в одну стадию, но и одностадийная реакция может кинетически осложняться, если она обратима. К кинетически сложным реакциям относят также последовательные, параллельные, цепные, фотохимические и некоторые другие.
5.6.1. Обратимые реакции
Особенность обратимых реакций состоит в том, что по мере накопления продуктов реакции возрастает скорость обратной реакции. Если они сравняются, то наступает равновесное состояние. Для реакции
|
|
|
ЗДМ для прямой реакции Vпр = kпр [A]a [B]b, для обратной реакции Vобр = kобр [L]l [Q]q. При условии Vобр = Vпр получаем
|
|
|
При
отношении
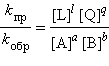 получаем
выражение ЗДМ для обратимой реакции
получаем
выражение ЗДМ для обратимой реакции
|
|
|
Для одностадийной реакции
|
|
|
где k1 – константа скорости прямой реакции, k–1 – константа скорости обратной реакции.
При
наступлении равновесия k1
[A] = k–1
[B], следовательно
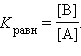
Предположим, что А может превратиться в B через промежуточную стадию образования C:

Возможен ли такой циклический процесс? Оказывается, такой циклический процесс запрещен в силу принципа детального равновесия (микроскопической обратимости), согласно которому для равновесного химического процесса всякая элементарная реакция должна идти со скоростью, в точности равной скорости реакции. То есть, в обратимой элементарной реакции прямая и обратная реакции протекают через одно и то же переходное состояние. Справедлива схема
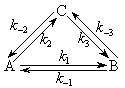
Эти шесть констант скорости не являются независимыми, поскольку k–1 k2 k3 = k1 k–2 k–3.