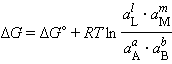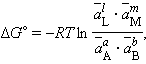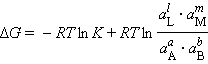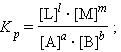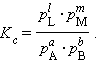- •Глава 1. Введение в химию 4
- •Глава 2. Электронное строение атомов 18
- •Глава 3. Химическая связь 33
- •Глава 4. Химическая термодинамика 53
- •Глава 5. Химическая кинетика 69
- •Глава 6. Растворы 83
- •Глава 7. Химические источники тока 113
- •Глава 8. Химические свойства элементов 132
- •Глава 9. Координационные соединения 162
- •Глава 1. Введение в химию
- •1.1. Понятие об атомах
- •1.2. Молекулы, радикалы и ионы
- •1.3. Номенклатура неорганических соединений
- •1.4. Законы стехиометрии
- •1.5. Химические реакции
- •Способы получения солей
- •Способы получения оксидов
- •Способы получения кислот
- •Способы получения оснований
- •Глава 2. Электронное строение атомов
- •2.1. Корпускулярно-волновые свойства частиц
- •2.2. Квантовые числа электрона
- •2.3. Заполнения атомных орбиталей
- •2.4. Электронные формулы элементов
- •2.5. Периодическая система элементов
- •2.5.1. Электронные конфигурации атомов периодической таблицы
- •2.6. Периодичность атомных характеристик
- •2.6.1. Ионные радиусы элементов
- •Глава 3. Химическая связь
- •3.1. Химическая связь
- •3.2. Типы химических связей
- •3.3. Современные представления о химической связи
- •3.3.1. Метод молекулярных орбиталей (ммо)
- •3.3.2. Двухатомные гомоядерные молекулы
- •3.3.3. Свойства двухатомных молекул p-элементов II периода
- •3.3.4. Многоатомные молекулы
- •3.3.5. Метод валентных связей (мвс)
- •3.3.6. Сравнительная характеристика ммо и мвс
- •3.3.7. Метод Гиллеспи–Найхолма
- •Глава 4. Химическая термодинамика
- •4.1. Введение в термодинамику
- •4.2. Энтальпия
- •4.3. Введение в термохимию
- •4.4. Закон Гесса
- •4.5. Энтропия
- •4.6. Энергия Гиббса
- •4.7. Химическое равновесие
- •4.8. Принцип Ле Шателье
- •4.8.1. Константы диссоциации кислот и оснований
- •4.8.2. Константы комплексообразования
- •Глава 5. Химическая кинетика
- •5.1. Скорость химических реакций
- •5.2. Закон действующих масс
- •5.3. Порядок химических реакций
- •5.4. Температура и скорость реакции
- •5.5. Катализ
- •5.6. Сложные реакции
- •5.6.1. Обратимые реакции
- •5.6.2. Последовательные реакции
- •5.6.3. Параллельные реакции
- •5.6.4. Цепные реакции
- •5.6.5. Фотохимические реакции
- •Глава 6. Растворы
- •6.1. Классификация растворов
- •6.2. Концентрация растворов
- •6.3. Растворы неэлектролитов
- •6.3.1. Закон Генри
- •6.3.3. Осмос
- •6.4. Растворы слабых электролитов
- •6.4.1. Водородный показатель pH
- •6.5. Растворы сильных электролитов
- •6.6. Кислотно-основные свойства химических соединений
- •6.7. Гидролиз солей
- •6.8. Произведение растворимости
- •6.9. Равновесие в гетерогенных системах
- •6.9.1. Диаграммы плавкости
- •Глава 7. Химические источники тока
- •7.1. Типы окислительно-восстановительных реакций
- •7.2. Электродные потенциалы и электродвижущие силы. Стандартный водородный электрод
- •7.2.1. Стандартные окислительно-восстановительные потенциалы
- •7.3. Классификация электродов
- •7.3.1. Электроды первого рода
- •.3.2. Электроды второго рода
- •7.3.3. Ионоселективные электроды
- •7.4. Химические источники тока
- •7.4.1. Типы гальванических элементов
- •7.5. Электрохимическая коррозия
- •Глава 8. Химические свойства элементов
- •8.1.1. Водород и его соединения. Гелий
- •8.1.2. Водородные соединения
- •8.1.3. Оксиды, пероксиды и гидроксиды
- •8.2.1. Важнейшие характеристики p-элементов
- •8.2.2. Гидроксиды
- •8.2.3. Отличия соединений p-элементов второго и третьего периода
- •8.2.4. Водородные соединения
- •8.2.5. Оксиды, бориды, карбиды, силициды и нитриды
- •8.2.6. Интерметаллические соединения
- •8.2.7. Благородные газы
- •8.3.1. Соединения d-элементов с легкими неметаллами
- •8.4.1. Лантаноиды
- •8.4.2. Актиноиды
- •Глава 9. Координационные соединения
- •9.1. Общие сведения о координационных соединениях
- •9.2. Изомерия координационных соединений
- •9.3. Устойчивость координационных соединений в растворах
- •9.4. Химическая связь в координационных соединениях
- •9.4.1. Метод валентных связей
- •9.4.2. Теория кристаллического поля
- •9.4.3. Теория поля лигандов
- •9.5. Электронная конфигурация комплексообразователя
- •9.6. Реакции с участием координационных соединений
- •9.7. Координационные соединения p- и s-элементов
4.7. Химическое равновесие
Для определения величины ΔG в условиях, отличных от стандартных, используют уравнение зависимости изобарно-изотермического потенциала от концентрации и температуры.
Используя соотношения (4.1) и (4.2), получаем:
|
|
(4.3) |
Рассмотрим вместо небольших, но конечных изменений (ΔG, ΔH, ΔS) бесконечно малые изменения всех параметров, входящих в уравнение (4.3). Тогда оно приобретает вид:
|
dG = dU + PdV + VdP – TdS – SdT. |
(4.4) |
Подставив в него dU = δQ – δA, получим:
|
dG = δQ – δA + PdV + VdP – TdS – SdT. |
(4.5) |
Если реакция протекает при постоянной температуре (SdT = 0) и обратимо (ΔQ = TdS), а единственной совершаемой в ходе реакции работой является работа расширения (δА = PdV), то в правой части (4.5) все члены, кроме VdP, взаимно сокращаются или равны нулю. Тогда получаем:
|
dG = VdP. |
|
Для одного моля идеального газа V = RT / P и, следовательно,
|
dG = RT dP / P = RT d(lnP) |
|
Интегрируя, получаем
|
|
(4.6) |
Это уравнение позволяет, зная молярную энергию Гиббса идеального газа G1 при парциальном давлении P1, вычислить молярную энергию Гиббса G2 при парциальном давлении P2. Хотя уравнение 4.6 выведено для обратимой реакции, оно в равной мере применимо и к необратимым процессам, поскольку G является функцией состояния, и ее изменение не зависят от способа перехода из состояния 1 в состояние 2. Допустив, что состояние 1 является стандартным, а состояние 2 произвольным, уравнение (4.6) можно записать в виде:
|
|
(4.7) |
где
![]() –
стандартный изобарно-изотермический
потенциал вещества j;
–
стандартный изобарно-изотермический
потенциал вещества j;
![]() –
его активная концентрация (активность).
–
его активная концентрация (активность).
Для идеальных растворов активная концентрация определяется как отношение концентрации этого вещества при заданных условиях к его концентрации в стандартном состоянии a = C/C°. Вещества в стандартном состоянии имеют a = 1.
В соответствии с (4.7) энергия Гиббса произвольной химической реакции
|
aА + bВ = lL + mМ |
|
равна:
|
|
(4.8) |
При достижении равновесия (ΔG = 0) уравнение (4.8) принимает вид
|
|
|
где
![]()
![]()
![]()
![]() – равновесные значения активных
концентраций.
– равновесные значения активных
концентраций.
Выражение под знаком логарифма, представляющее собой отношение произведения равновесных активностей продуктов к произведению активностей исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия:
|
|
(4.9) |
Подставив (4.9) в (4.8), получим уравнение, носящее название изотермы Вант-Гоффа:
|
|
(4.10) |
При определенных условиях активности реагентов могут быть заменены концентрациями или парциальными давлениями. В этих случаях константа равновесия, выраженная через равновесные концентрации Kc или через парциальные давления Kр, принимает вид
|
|
(4.11) |
|
|
(4.12) |
Уравнения (4.11) и (4.12) представляют собой варианты закона действующих масс (ЗДМ) для обратимых реакций в состоянии равновесия. При постоянной температуре отношение равновесных концентраций (парциальных давлений) конечных продуктов к равновесным концентрациям (парциальным давлениям) исходных реагентов, возведенных соответственно в степени, равные их стехиометрическим коэффициентам, величина постоянная (К. Гульдберг, П. Вааге, 1867 г.).
Для газообразных веществ Kp и Kc связаны соотношением Kp = (RT)ΔnKc, где Δn – разность числа молей начальных и конечных газообразных реагентов.
Константа равновесия определяется при известных равновесных концентрациях реагирующих веществ или по известной ΔG° химической реакции.