
- •Химическая кинетика
- •Основные понятия и определения
- •Виды химических реакций
- •Простые реакции. Молекулярность
- •Сложные реакции
- •С труктура темы
- •Формальная кинетика
- •Определение скорости химической реакции
- •Основной закон химической кинетики – закон «действующих масс»
- •Кинетические параметры
- •Порядок реакции
- •Константа скорости
- •Кинетические уравнения
- •Кинетическое уравнение реакции нулевого порядка
- •Кинетическое уравнение реакции первого порядка
- •Кинетическое уравнение реакции второго порядка
- •Кинетическое уравнение реакции третьего порядка
- •Теория скоростей химических реакций
- •Распределение молекул по энергиям
- •Энергия активации
- •Зависимость скорости реакции от температуры
- •Правило Вант-Гоффа
- •Уравнение Аррениуса
- •Э Рис. 6.6. Определение энергии активации кспериментальное определение энергии активации и предэкспоненциального множителя
- •Физический смысл предэкспоненциального множителя
- •Основы теории активных соударений
- •Теория активированного комплекса
- •Кривая потенциальной энергии
- •Виды сложных реакций
- •Реакции с последовательными стадиями
- •Реакции с параллельными стадиями
- •Обратимые реакции
- •Каталитические реакции
- •Цепные реакции
- •Кинетическое равновесие
- •Условие равновесия
- •Кинетическое равновесие устанавливается при равенстве скоростей прямой и обратной реакции.
- •Константа равновесия
- •Смещение равновесия. Принцип Ле-Шателье
- •Влияние концентрации
- •Влияние давления
- •Влияние температуры.
- •Влияние катализатора.
- •Расчеты кинетических и термодинамических величин
- •Изотерма химической реакции
- •Зависимость константы равновесия от температуры. Изобара химической реакции
Кинетическое уравнение реакции второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:

Рис. 6.4.3. Изменение
концентрации исходного вещества для
реакции второго порядка

После разделения переменных и интегрирования получаем:
1/с = A + kt,
Постоянная интегрирования из начальних условий А=1/со, тогда линейная форма кинетического уравнения реакции 2-го порядка:
1/с = 1/со + kt,
График зависимости концентрации реагента для реакции второго порядка в координатах 1/с от времени (рис. 6.4.3.) представляет прямую с tg угла наклона равному константе скорости
Кинетическое уравнение реакции третьего порядка
Р
Рис. 6.4.4. Изменение
концентрации исходного вещества для
реакции третьего порядка
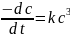 (6.6.4)
(6.6.4)
Решение (6.6.4) относительно концентрации и с учетом начальных условий дает линейное уравнение: 1/с2 = 1/с2о +2kt, откуда следует, что константа скорости реакции третьего порядка равна ½tgα, где α – угол наклона прямой в координатах 1/с2 и времени (рис. 6.4.4.).
Теория скоростей химических реакций
Формальная кинетика изучает протекание реакций во времени исходя из экспериментальных данных. Получаемые при этом значения кинетических параметров могут свидетельствать о механизме реакции лишь косвенно.
Под механизмом реакции понимается определение:
всех стадий процесса;
их молекулярности;
возможных скоростей, которые зависят от температуры и природы реагирующих веществ.
На все эти вопросы отвечает современноая теория абсолютных скоростей химических реакций. Необходимым условием химического превращения является взаимодействие исходных частиц (молекул, ионов или радикалов), чаще всего реализуемое в виде соударений их между собой. Однако, это условие еще недостаточно, поскольку только немногие столкновения приводят к элементарному акту реакции. Будь по другому, атмосфера земли при наших обычных условиях состояла бы из оксидов азота, а не молекул кислорода и азота, каждая из которых за одну секунду в 1 см3 сталкиваются более 1010 раз, а общее число соударений >1029. Если нагреть смесь этих газов до высоких температур(>10000C), то скорости молекул резко возрастут (и соответственно энергия тоже) часть «активных» соударений приведет сначала к разрушению старых молекул, а затем и к образованию новых.
Для других газов (например, кислорода и водорода) достаточно уже комнатной температуры, чтобы они прореагировали очень быстро и даже со взрывом. Это говорит о том, что некоторым веществам не требуется много избыточной энергии для взаимодействия (например, тем у которых энергия связи мала) и наоброт, если связь в исходных молекулах прочная – прореагировать они могут только при высоких температурах. Из этого следует важный вывод:
элементарный акт химического превращения возможен только между частицами, обладающими достаточной энергией для разрыва их химических связей, поскольку все частицы разные, то и энергии необходимые для их взаимодействия тоже будут разными.
То есть, для протекания реакции необходимы активные соударения (их рассматривает теория активных соударений), которые приводят к разрыву химических связей и образованию промежуточного соединения (теория активированного комплекса), и затем продуктов реакции.
Определим частицы, которые могут прореагировать, учитывая распределение молекул по их энергиям.
