
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
КУРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И
СОЦИАЛЬНОГО РАЗВИТИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
(ГБОУ ВПО КГМУ МИНЗДРАВСОЦРАЗВИТИЯ РОССИИ)
КАФЕДРА ФИЗИКИ, ИНФОРМАТИКИ И МАТЕМАТИКИ
Самостоятельная работа № 1
Тема: «Биоэнергетика и термодинамика биологических систем».
по дисциплине « физика»
Выполнил:
Остряков Евгений Олегович, 4 группа, I курс, педиатрический факультет
Проверил:
Доцент, кандидат медицинских наук Долгарева Светлана Анатольевна
Преподаватель:
Долгарева Светлана Анатольевна
План.
I. Введение ………………………………….стр. 3
II. Основная часть…………………………....стр. 4
III. Заключение.………………………………стр.26
IV. Список литературы………………………стр.27
Введение.
I. Мотивация темы
Изучение основ биоэнергетики и термодинамики раскрывает физические механизмы важнейшей функции организма - обмена веществ и энергии, которые и являются обоснованием биокалориметрических исследований.
II. Цель самостоятельной работы
Цель самостоятельной работы: Овладеть методикой приобретения знаний из учебной литературы и научных первоисточников. Приобрести навыки правильного отбора учебной литературы, а также навыки анализа отобранного материала. Изучить предложенные, не вошедшие в план лекций и лабораторных занятий, вопросы по теме: «Термодинамика биологических процессов».
III. Биоэнергетика — биологическая энергетика, изучает механизмы преобразования энергии в процессах жизнедеятельности организмов. Иначе говоря, биоэнергетика рассматривает явления жизнедеятельности в их энергетическом аспекте. Методы и подходы к изучаемым явлениям, применяемые в биоэнергетике, — физико-химические, объекты и задачи — биологические. Т. о., Б. стоит на стыке этих наук и является частью молекулярной биологии, биофизики и биохимии.
ТЕРМОДИНАМИКА БИОЛОГИЧЕСКИХ СИСТЕМ, раздел биофизики, рассматривающий общие закономерности превращений энергии, их связь с обменом н транспортом веществ, а также проблемы устойчивости и эволюции биол. систем.
 Основная
часть.
Основная
часть.
БИОЭНЕРГЕТИКА, совокупность процессов преобразования энергии в биол. системах, а также раздел биологии, изучающий эти процессы. Существование живых организмов и биосферы в целом возможно только при непрерывном притоке солнечной энергии..
Понятие энергии, работы, теплоемкости. Виды энергии в организме. Энергия химической связи.
Энергия
Энергия – скалярная физическая величина, являющаяся единой мерой различных форм движения материи и мерой перехода движения материи из одних форм в другие. Введение понятия энергии удобно тем, что в случае, если физическая система являетсязамкнутой, то её энергия сохраняется во времени. Это утверждение носит название закона сохранения энергии.
Виды энергии:
Механика различает потенциальную энергию (или, в более общем случае, энергия взаимодействия тел или их частей между собой или с внешними полями) и кинетическую энергию (энергия движения). Их сумма называется полной энергией.
Энергией обладают все виды полей. По этому признаку различают: электромагнитную (разделяемую иногда на электрическую и магнитную энергии), гравитационную и ядерную энергии (также может быть разделена на энергию слабого и сильного взаимодействий).
Термодинамика рассматривает внутреннюю энергию и иные термодинамические потенциалы.
В химии рассматриваются такие величины как энергия связи и энтальпия, имеющие размерность энергии, отнесённой к количеству вещества.
Внутренняя энергия
Вну́тренняя эне́ргия тела (обозначается как U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
Работа
Работа — это физическая величина, являющаяся скалярной количественной мерой действия силы или сил на тело или систему, зависящая от численной величины и направления силы(сил) и от перемещения точки(точек) тела или системы
![]()
РАБОТА (в термодинамике)– это изменение внутренней энергии системы, связанное с изменением ее объема и расположения ее частей относительно друг друга. Например, ударяя по куску свинца молотком, сгибая и разгибая проволоку или сжимая находящийся под поршнем в цилиндре газ, мы каждый раз совершаем над системой работу и тем самым изменяем ее внутреннюю энергию. Мерой изменения внутренней энергии при этом является величина совершенной работы. Работа газа положительна при расширении газа и отрицательна при его сжатии. На p–V-диаграмме работа газа численно совпадает (по модулю) с площадью фигуры под графиком зависимости давления от объема. При совершении работы в термодинамике меняется состояние макроскопических тел: их объем и температура
Теплоемкость
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT:
Единица измерения теплоёмкости в системе СИ — Дж/К.
Энергия химической связи.
Энергия химической связи, равна работе, которую необходимо затратить, чтобы разделить молекулу на две части (атомы, группы атомов) и удалить их друг от друга на бесконечное расстояние. Энергия химической связи — частный случай энергии связи, обычно ее выражают в кдж/моль (ккал/моль); в зависимости от частиц, образующих химическую связь, характера взаимодействия между ними (ковалентная связь, водородная связь и другие виды химической связи), кратности связи (например: двойные, тройные связи) энергия химической связи имеет величину от 8—10 до 1000 кдж/моль. Для молекулы, содержащей две (или более) одинаковых связей, различают энергию каждой связи (энергию разрыва связи) и среднюю энергию связи, равную усредненной величине энергии разрыва этих связей.
Выделение энергии в организме. Энергетическая сущность окислительного фосфорилирования. Понятие миграции энергии.
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
Функция дыхательной цепи – утилизация восстановленных дыхательных переносчиков,образующихсяв реакциях метаболического окисления субстратов (главным образом в цикле трикарбоновых кислот). Каждая окислительная реакция в соответствии с величиной высвобождаемой энергии «обслуживается» соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД. Соответственно своим окислительно-восстановительным потенциалам эти соединения в восстановленной форме подключаются к дыхательной цепи (см. рис. 9.7). В дыхательной цепи происходит дискриминация протонов и электронов: в то время как протоны переносятся через мембрану, создавая ΔрН, электроны движутся по цепи переносчиков от убихинола к цитохромоксидазе, генерируя разность электрических потенциалов, необходимую для образования АТФ протонной АТФ-синтазой. Таким образом, тканевое дыхание «заряжает» митохондриальную мембрану, а окислительное фосфорилирование «разряжает» ее.
.
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ, синтез АТФ из аденозиндифосфата и неорганического фосфата, осуществляющийся в живых клетках,благодаряэнергии,выделяющейся при окислении органический веществ в процессе клеточного дыхания. В общем виде окислительное фосфорилирование и его место в обмене в-в можно представить схемой:
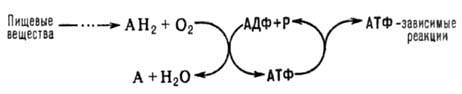 АН2-орг.
в-ва, окисляемые в дыхательной цепи
АДФ-аденозиндифосфат, Р-неорганического фосфата.
АН2-орг.
в-ва, окисляемые в дыхательной цепи
АДФ-аденозиндифосфат, Р-неорганического фосфата.
П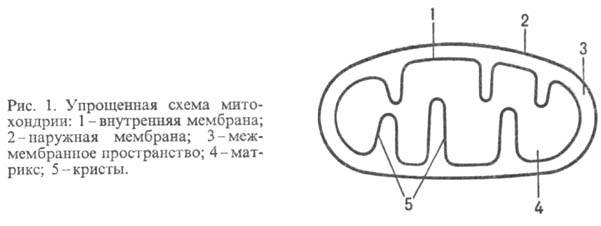 оскольку АТФ необходим
для осуществления мн. процессов, требующих
затраты энергии (биосинтез,
совершение мех. работы, транспорт в-в и
др.), Окислительное фосфорилирование играет
важнейшую роль в жизнедеятельности
аэробных организмов.
Образование АТФ в клетке
происходит
также благодаря др. процессам, напр. в
ходе гликолиза и
разл. типов брожения,
протекающих без участия кислорода.
Их вклад в синтез
АТФ в
условиях аэробного дыхания составляет
незначит. часть от вклада
окислительного фосфорилирования (ок.
5%).
оскольку АТФ необходим
для осуществления мн. процессов, требующих
затраты энергии (биосинтез,
совершение мех. работы, транспорт в-в и
др.), Окислительное фосфорилирование играет
важнейшую роль в жизнедеятельности
аэробных организмов.
Образование АТФ в клетке
происходит
также благодаря др. процессам, напр. в
ходе гликолиза и
разл. типов брожения,
протекающих без участия кислорода.
Их вклад в синтез
АТФ в
условиях аэробного дыхания составляет
незначит. часть от вклада
окислительного фосфорилирования (ок.
5%).
Механизм
окислительного фосфорилирования можно
представить схемой:
Перенос электронов (дыхание) ![]() А
~ В
А
~ В![]() АТФ А
~ В-высокоэнергетич.интермедиат Предполагалось,
что А ~ В - хим. соед. с макроэргич. связью,
напр. фосфорилир. фермент дыхат.
цепи (хим. гипотеза сопряжения), или
напряженная конформация к.-л. белка,
участвующего в
окислительном фосфорилировании (конформац.
гипотеза сопряжения). Однако эти гипотезы
не получили эксперим. подтверждения.
Наиб. признанием пользуется хемиосмотич.
концепция сопряжения, предложенная в
1961 П. Митчеллом (за развитие этой концепции
в 1979 ему присуждена Нобелевская премия).
В результатена мембране возникает
разность электрических-потенциалов
АТФ А
~ В-высокоэнергетич.интермедиат Предполагалось,
что А ~ В - хим. соед. с макроэргич. связью,
напр. фосфорилир. фермент дыхат.
цепи (хим. гипотеза сопряжения), или
напряженная конформация к.-л. белка,
участвующего в
окислительном фосфорилировании (конформац.
гипотеза сопряжения). Однако эти гипотезы
не получили эксперим. подтверждения.
Наиб. признанием пользуется хемиосмотич.
концепция сопряжения, предложенная в
1961 П. Митчеллом (за развитие этой концепции
в 1979 ему присуждена Нобелевская премия).
В результатена мембране возникает
разность электрических-потенциалов ![]() и
разность
химических. активностей ионов Н+
и
разность
химических. активностей ионов Н+ ![]() (внутри митохондрий рН
выше, чем снаружи). В сумме эти компоненты
дают трансмембранную разность электрохим.
потенциалов ионов водорода
(внутри митохондрий рН
выше, чем снаружи). В сумме эти компоненты
дают трансмембранную разность электрохим.
потенциалов ионов водорода ![]() между
матриксоммитохондрий и
внеш. водной фазой, разделенными мембраной:
между
матриксоммитохондрий и
внеш. водной фазой, разделенными мембраной:
![]()
где
R-универсальная газовая
постоянная,
T-абс. т-ра, F- число Фарадея. Величина ![]() обычно
составляет ок. 0,25 В, причем осн. часть
(0,15-0,20 В) представлена электрич.
составляющей
обычно
составляет ок. 0,25 В, причем осн. часть
(0,15-0,20 В) представлена электрич.
составляющей ![]() .
Энергия
.
Энергия ![]() ,
выделяющаяся при
движении протонов внутрь митохондрий по
электрич. полю в сторону меньшей
их концентрации (рис.
2, процесс 2), используется АТФ-синтетазой
для синтеза
АТФ.
Т. обр., схему окислительногофосфорилирования,
согласно этой концепции, можно представить
в след. виде: Перенос электронов (дыхание)
,
выделяющаяся при
движении протонов внутрь митохондрий по
электрич. полю в сторону меньшей
их концентрации (рис.
2, процесс 2), используется АТФ-синтетазой
для синтеза
АТФ.
Т. обр., схему окислительногофосфорилирования,
согласно этой концепции, можно представить
в след. виде: Перенос электронов (дыхание) ![]() АТФ
АТФ
Миграция энергии
Миграция энергии, перенос энергии, самопроизвольный переход энергии с одной частицы — донора (атома или молекулы) на другую — акцептор. Миграция энергии не связана ни с испусканием фотона донором и его поглощением акцептором, ни с обменом электронами или атомами между взаимодействующими частицами.Миграция энергии—результат электромагнитного взаимодействия частиц (индуктивно-резонансный механизм) либо частичного перекрывания их электронных оболочек (обменно-резонансный механизм). Мигрировать могут разные формы энергии, однако чаще всего миграция энергии. наблюдается после перехода молекулы (атома) в электронно-возбуждённое состояние при поглощении ею кванта света. За время, пока не произошёл обратный процесс излучения света и молекула находится в возбуждённом состоянии, она может передать полученную ею энергию др. молекуле, находящейся достаточно близко, т. е. на расстоянии, меньшем длины волны соответствующего излучения
(<
80 ![]() ).
В конденсированной среде (растворах
или кристаллах) такая передача происходит
многократно, и энергия может сместиться
от места поглощения кванта света на
сравнительно большие расстояния
(несколько мкм). М.
э. происходит в газах, жидкостях и твёрдых
телах. С. И. Вавилов показал, что
М. э. объясняет такие явления, как
концентрационная деполяризация и
концентрационное тушение люминесценции
красителей в растворах.
).
В конденсированной среде (растворах
или кристаллах) такая передача происходит
многократно, и энергия может сместиться
от места поглощения кванта света на
сравнительно большие расстояния
(несколько мкм). М.
э. происходит в газах, жидкостях и твёрдых
телах. С. И. Вавилов показал, что
М. э. объясняет такие явления, как
концентрационная деполяризация и
концентрационное тушение люминесценции
красителей в растворах.
Миграция энергии. играет большую роль в биологических системах, участвуя во многих процессах жизнедеятельности. Особенно важное значение М. э. электронного возбуждения имеет в фотобиологии. Так, в процессе фотосинтеза квант света переводит молекулу хлорофилла или др. пигмента в электронно-возбуждённое состояние. Затем энергия мигрирует от одной молекулы пигмента к другой до тех пор, пока не окажется на особой молекуле, служащей реакционным центром, преобразующим энергию электронного возбуждения в химическую энергию (т. е. энергию, заключённую в химических связях). Помимо межмолекулярной М. э., возможен и внутримолекулярный перенос энергии.
Термодинамическая система. Типы термодинамических систем.
Термодинамическая система.
Процессы передачи, сохранения и превращения энергии носят всеобщий характер и протекают в любой физической системе. Любой вид энергии способен перейти в тепло, а в некоторых случаях возможен и обратный переход. По этой причине, раздел физики, объектом исследования которого являются тепловые (энергетические) процессы, занимает особое место в теории. В частности, сведения из термодинамики необходимо привлекать при изучении процессов намагничивания вещества, термоэлектричества, явлений упругости и вязкости и т.д.
Термодинамические
системы
являются системами большого числа
частиц, взаимодействующих как друг с
другом, так и с внешними полями. Заметим,
что число частиц ограничено как сверху,
так и снизу. Наличие нижней границы (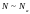 )
связано с необходимостью установления
в системе равновесного распределения
по скоростям частиц и по координатам.
Результаты компьютерного моделирования
показывают, что такие распределения
могут установиться и для систем гораздо
меньшего числа частиц (порядка сотен и
даже десятков). Однако в этом случае
систему гораздо легче вывести из
состояния равновесия, а время установления
равновесного состояния будет большим.
)
связано с необходимостью установления
в системе равновесного распределения
по скоростям частиц и по координатам.
Результаты компьютерного моделирования
показывают, что такие распределения
могут установиться и для систем гораздо
меньшего числа частиц (порядка сотен и
даже десятков). Однако в этом случае
систему гораздо легче вывести из
состояния равновесия, а время установления
равновесного состояния будет большим.
Важной особенностью термодинамической системы является ее равновесность (равномерное распределение частиц, температуры, концентрации и других характеристик по объему, занимаемому системой).
Для любой термодинамической системы существует состояние термодинамического равновесия, которое оно достигает с течением времени самопроизвольно при фиксированных внешних условиях. Сформулированное положение получило название нулевого начала термодинамики.
Это свойство является специфическим для всех термодинамических систем.
На практике для макроскопических систем под состоянием термодинамического равновесия будем понимать сохранение макроскопических параметров термодинамической системы с течением времени при отсутствии потоков любого типа: вещества, энергии (тепла), энтропии.
Типы термодинамических системы:
Система называется термодинамической, если между ее отдельными частями возможен обмен энергией.
Если возможен обмен не только энергией, но и веществом, то такая система называется физико-химической.
Пример – насыщенный раствор соли с некоторым избытком твердой соли на дне и паром над ним. В этой системе возможен обмен между твердой солью и ее водным раствором, между водным раствором и паром.
Типы термодинамических системы:
закрытая – нет обмена веществом с внешней средой;
адиабатическая – нет обмена теплотой;
изолированная – невозможен обмен ни веществом, ни энергией.
гетерогенная – внутри системы существует поверхность раздела, где происходят резкие скачкообразные изменения свойств (вода – лед);
гомогенная – нет поверхности раздела внутри системы, свойства системы изменяются непрерывно;
однородная – гомогенная система в состоянии равновесия.
Первый закон термодинамики и его применение в медицине.
Первый закон термодинамики.
Первый закон термодинамики: изменение внутренней энергии системы равно сумме количества теплоты, переданной системе, и работы внешних сил, совершенной над системой.
ΔU = Q + A
Где:
ΔU- изменение внутренней энергии,
Q- количество теплоты, преданное системе,
A- работа внешних сил.
Работа самой системы A` = -A, тогда первый закон термодинамики можно сформулировать так:
Количество теплоты, переданное системе, идёт на измене её внутренней энергии и на совершение системой работы.
Применение первого закона термодинамики к различным изопроцессам.
Изотермический процесс.
При изотермическом процессе температура не изменяется, следовательно ΔТ = 0, поэтому ΔU=0.
Тогда первый закон термодинамики принимает вид: Q = А`. Всё получаемое количество теплоты идёт на совершение работы.
Изохорный процесс.
При изохорном процессе объём газа не меняется, а следовательно работа газом не совершается, т.е.А`=0.
Поэтому первый закон термодинамики принимает вид: Q =ΔU . Всё получаемое количество теплоты идет на изменение внутренней энергии.
Изобарный процесс.
При изобарном процессе переданное газу количество теплоты идёт на изменение внутренней энергии и на совершение работы:
![]() .
.
Адиабатный процесс.
При адиабатном процессе отсутствует теплообмен с окружающей средой, т.е. Q = 0.
Тогда первый закон термодинамики принимает вид: A`= - ΔU. Газ совершает работу за счёт уменьшения своей внутренней энергии (при расширении газ охлаждается).
Физические принципы прямой биокалориметрии.
Физические принципы прямой биокалориметрии
Прямая калориметрия основана на непосредственном учете в биокалориметрах количества тепла, выделенного организмом. Биокалориметр представляет собой герметизированную и хорошо теплоизолированную от внешней среды камеру. В камере по трубкам циркулирует вода. Тепло, выделяемое находящимся в камере человеком или животным, нагревает циркулирующую воду. По количеству протекающей воды и изменению ее температуры рассчитывают количество выделенного организмом тепла.
Одновременно в биокалориметр подается О2 и поглощается избыток СО2 и водяных паров. Продуцируемое организмом человека тепло измеряют с помощью термометров по нагреванию воды, протекающей по трубкам в камере. Количество протекающей воды измеряют в баке. Через окно подают пищу и удаляют экскременты. С помощью насоса воздух извлекают из камеры и прогоняют через баки с серной кислотой — для поглощения воды и с натронной известью — для поглощения СО2. О2 подают в камеру из баллона через газовые часы. Давление воздуха в камере поддерживают на постоянном уровне с помощью сосуда с резиновой мембраной.
Физические принципы непрямой биокалориметрии. Калорический коэффициент питательных веществ, дыхательный коэффициент и калорический эквивалент кислорода.
Физические принципы непрямой биокалориметрии
Методы прямой калориметрии очень громоздки и сложны. Учитывая, что в основе теплообразования в организме лежат окислительные процессы, при которых потребляется О2 и образуется СО2, можно использовать косвенное, непрямое, определение теплообразования в организме по его газообмену — учету количества потребленного О2 и выделенного СО2 с последующим расчетом теплопродукции организма.
Для длительных исследований газообмена используют специальные респираторные камеры (закрытые способы непрямой калориметрии. Кратковременное определение газообмена в условиях лечебных учреждений и производства проводят более простыми не камерными методами (открытые способы калориметрии) .
Наиболее распространен способ Дугласа — Холдейна, при котором в течение 10—15 мин собирают выдыхаемый воздух в мешок из воздухонепроницаемой ткани (мешок Дугласа), укрепляемый на спине обследуемого. Он дышит через загубник, взятый в рот, или резиновую маску, надетую на лицо. В загубнике и маске имеются клапаны, устроенные так, что обследуемый свободно вдыхает атмосферный воздух, а выдыхает воздух в мешок Дугласа. Когда мешок наполнен, измеряют объем выдохнутого воздуха, в котором определяют количество О2 и СО2.
Кислород, поглощаемый организмом, используется для окисления белков, жиров и углеводов. Окислительный распад 1 г каждого из этих веществ требует неодинакового количества О2 и сопровождается освобождением различного количества тепла. Как видно из табл. 10.2, при потреблении организмом 1 л О2 освобождается разное количество тепла в зависимости от того, на окисление каких веществ О2 используется.
Количество тепла, освобождающегося после потребления организмом 1 л О2, носит название калорического эквивалента кислорода. Зная общее количество О2, использованное организмом, можно вычислить энергетические затраты только в том случае, если известно, какие вещества — белки, жиры или углеводы, окислились в теле. Показателем этого может служить дыхательный коэффициент.
Дыхательным коэффициентом (ДК) называется отношение объема выделенного СО2 к объему поглощенного О2. Дыхательный коэффициент различен при окислении белков, жиров и углеводов. Для примера рассмотрим, каков будет дыхательный коэффициент при использовании организмом глюкозы. Общий итог окисления молекулы глюкозы можно выразить формулой:
С6Н12О6 + 6 О2 = 6 СО2 + 6 Н2О
При окислении глюкозы число молекул образовавшегося СО2 равно числу молекул затраченного (поглощенного) О2. Равное количество молекул газа при одной и той же температуре и одном и том же давлении занимает один и тот же объем (закон Авогадро— Жерара). Следовательно, дыхательный коэффициент (отношение СО2/О2) при окислении глюкозы и других углеводов равен единице.
При окислении жиров и белков дыхательный коэффициент будет ниже единицы. При окислении жиров дыхательный коэффициент равен 0,7. Проиллюстрируем это на примере окисления трипальмитина:
2 С3Н5 (С15Н31СОО)3 + 145 О2 = 102 СО2 + 98 Н2О
Отношение между объемами углекислого газа и кислорода составляет в данном случае: 102 CO2/45 O2= 0,703
Физические основы теплообмена в организме.
Теплообмен в организме Человек относится к теплокровным животным. Это проявляется в том, что при значительных колебаниях температуры окружающей среды он способен поддерживать постоянную температуру тела на уровне 36-37 градусов. Тепловой баланс организма регулируется двумя процессами: теплообразованием и теплоотдачей. Теплопродукция в организме происходит постоянно в результате протекания разнообразных химических реакций, обеспечивающих нормальный обмен веществ. В случае если для поддержания постоянной внутренней температуры необходимо дополнительное тепло, оно может вырабатываться в результате произвольного повышения мышечной активности за счет непроизвольной ритмической мышечной активности (дрожи) и ускорения обменных процессов, не связанных с сокращением мышц (например, расщепления жира в клетках особой бурой жировой ткани). Чтобы поддерживать температуру тела постоянной, необходимо, чтобы теплопродукция уравновешивалась теплоотдачей. Теплоотдача происходит с поверхности тела через кожу путем проведения тепла, конвекции, излучения и испарения пота, а также путем испарения влаги с поверхности легких в процессе дыхания. В условиях комфортной температуры окружающей среды на обеспечение работы внутренних органов уходит лишь около 2 % теплопотерь, в то время как через кожу человек расходует около 95 % всего тепла, вырабатываемого организмом; оставшиеся 3 % уходят на испарение воды при дыхании и нагрев выдыхаемого воздуха. При низкой температуре, особенно во время пребывания человека в воде, соотношение форм теплоотдачи может существенно изменяться. Кроме того, теплоотдача зависит от проведения тепла и его перераспределения внутри организма, а также от кровотока. Так, если в комфортных условиях воздушной среды в покое потребление кислорода составляет около 250 куб.см, то в воде при температуре 25 градусов - в среднем 800 куб.см, при Т = 15 °С - до 1200 куб.см, а при температуре воды = 10 градусов - до 1600 см3. Следует помнить, что при погружении на глубину свыше 50 м значительно возрастает респираторная теплопотеря. Как мы уже говорили, вдыхание холодного газа способно вызвать серьезные нарушения дыхания, а также затруднить компенсацию давления в полости среднего уха и околоносовых пазухах. Проблема развития холодового отека евстахиевых каналов и повышенной секреции слизи особенно заметна при плавании в холодной воде.
Обратимые и необратимые процессы. Понятие энтропии.
Обратимые и необратимые процессы
Обратимые и необратимые процессы, пути изменения состояния термодинамической системы. Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс - идеализированный случай, достижимый лишь при бесконечно медленном изменении термодинамических параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называют необратимым.
Необратимые
процессы
могут протекать самопроизвольно только
в одном направлении;
таковы диффузия,теплопроводность,
вязкое течение и другое. Для химической
реакции применяют понятия термодинамической
и кинетической обратимости, которые
совпадают только в непосредственной
близости к состоянию равновесия. Р-ция
А + В ![]() С
+ D наз. кинетически обратимой или
двусторонней, если в данных условиях
продукты С и D могут реагировать друг с
другом с образованием исходных веществ
А и В. При этом скорости прямой и обратной
реакций, соотвав.
С
+ D наз. кинетически обратимой или
двусторонней, если в данных условиях
продукты С и D могут реагировать друг с
другом с образованием исходных веществ
А и В. При этом скорости прямой и обратной
реакций, соотвав. ![]()
![]() ,
где
,
где ![]() и
и ![]() -константы
скорости, [А],
[В], [С], [D]-
текущиеконцентрации (активности),
с течением времени становятся равными
и наступает химическое
равновесие, в котором
-константы
скорости, [А],
[В], [С], [D]-
текущиеконцентрации (активности),
с течением времени становятся равными
и наступает химическое
равновесие, в котором![]() -константа
равновесия, зависящая
от температуры. Кинетически необратимыми
(односторонними) являются обычно такие
реакции, в ходе которых хотя бы один из
продуктов удаляется из зоны реакции
(выпадает в осадок, улетучивается или
выделяется в виде малодиссоциированного
соединения), а также реакции, сопровождающиеся
выделением большого кол-ва тепла.
-константа
равновесия, зависящая
от температуры. Кинетически необратимыми
(односторонними) являются обычно такие
реакции, в ходе которых хотя бы один из
продуктов удаляется из зоны реакции
(выпадает в осадок, улетучивается или
выделяется в виде малодиссоциированного
соединения), а также реакции, сопровождающиеся
выделением большого кол-ва тепла.
Термодинамическое определение энтропии
Термодинамическая энтропия S, часто просто именуемая энтропия, в химии и термодинамике является функцией состояния термодинамической системы.
Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом. Он определил изменение энтропиитермодинамической системы при обратимом процессе как отношение общего количества тепла ΔQ к величине абсолютной температуры T (то есть тепло, переданное системе, при постоянной температуре):
![]() .
.
Например, при температуре 0 °C, вода может находиться в жидком состоянии и при незначительном внешнем воздействии начинает быстро превращаться в лед, выделяя при этом некоторое количество теплоты. При этом температура вещества так и остается 0 °C. Изменяется состояние вещества, сопровождающееся изменением тепла, вследствие изменения структуры.
Рудольф Клаузиус дал величине S имя «энтропия», происходящее от греческого слова τρoπή, «изменение» (изменение, превращение, преобразование). Данное равенство относится к изменению энтропии, не определяя полностью саму энтропию.
Эта формула применима только для изотермического процесса (происходящего при постоянной температуре). Её обобщение на случай произвольного квазистатического процесса выглядит так:
![]() ,
,
Где: dS — приращение (дифференциал) энтропии некоторой системы;
Q — бесконечно малое количество теплоты, полученное этой системой.
Необходимо обратить внимание на то, что рассматриваемое термодинамическое определение применимо только к квазистатическим процессам (состоящим из непрерывно следующих друг за другом состояний равновесия).
Поскольку энтропия является функцией состояния, в левой части равенства стоит её полный дифференциал. Напротив, количество теплоты является функцией процесса, в котором эта теплота была передана, поэтому Q считать полным дифференциалом нельзя.
Энтропия, таким образом, согласно вышеописанному, определена вплоть до произвольной аддитивной постоянной. Третье начало термодинамики позволяет определить её точнее: предел величины энтропии равновесной системы при стремлении температуры к абсолютному нулю полагают равным нулю.
Второй закон термодинамики и его применение в медицине.
Второй Закон Термодинамики
Второй Закон Термодинамики, как и Первый Закон сохранения энергии установлен эмпирическим путем. Впервые его сформулировал Клаузиус : теплота сама собой переходит лишь от тела с большей температурой к телу с меньшей температурой и не может самопроизвольно переходить в обратном направлении. Другая формулировка все самопроизвольные процессы в природе идут с увеличением энтропии. Энтропия мера хаотичности, неупорядоченности системы. Рассмотрим систему из двух контактирующих тел с разными температурами. Тепло пойдет от тела с большей температурой к телу с меньшей, до тех пор, пока температуры обоих тел не выровняются. При этом от одного тела к другому будет передано определенное количество тепла dQ. Но энтропия при этом у первого тела уменьшится на меньшую величину, чем она увеличится у второго тела, которое принимает теплоту, так как, поопределению, dSdQT температура в знаменателе!. То есть, в результате этого самопроизвольного процесса энтропия системы из двух тел станет больше суммы энтропий этих тел до начала процесса. Иначе говоря, самопроизвольный процесс передачи тепла от тела с высокой Т к телу с более низкой Т привел к тому, что энтропия системы из этих двух тел увеличилась! Заметим, что, рассматривая эту систему из двух тел, мы подразумевали, что внешнего теплопритока в нее или теплооттока из нее нет для простоты, чтобы не пудрить себе мозги то есть, считали ее изолированной или замкнутой. Отсюда еще одна формулировка Второго Закона Термодинамики При прохождении в изолированной системе самопроизвольных процессов энтропия системы возрастает. Или Энтропия изолированной системы стремится к максимуму так как самопроизвольные процессы передачи тепла всегда будут происходить, пока есть перепады температур.
Свободная и связанная энергия. Энтропия как мера связанной энергии. Уравнение Гельмгольца.
Свободная и связанная энергия. Энтропия как мера связанной энергии. Уравнение Гельмгольца
Вытекающая
из 2-го начала термодинамики необходимость
различить количественную и качественную
характеристику энергии нашла отражение
в принятом в термодинамике делении
энергии на свободную
и связанную
(соответственно пригодную и непригодную
к совершению в определенных условиях
внешней работы). Такое деление стало
возможным после введения Р. Клаузиусом
основополагающего для термодинамики
понятия энтропии S. В соответствии с её
смыслом Г.
Гельмгольц
назвал произведение абсолютной
температуры Т
и энтропии S
«связанной энергией», а остальную часть
F = U – TS –
«свободной
энергией».
Вслед за этим Дж. Гиббс ввел понятие
«свободной
энтальпии»
G как разности между энтальпией системы
H = U+ pV и связанной энергией TS. Несложно
показать, что в условиях постоянства
температуры T и объема V системы убыль
свободной энергии Гельмгольца определяет
максимальную механическую работу
(работу расширения), которую может
совершить система при обратимом характере
процессов. Действительно, обозначая
элементарную работу расширения через
dWр и выражая теплоту обратимого процесса
dQ известным образом через абсолютную
температуру T и энтропию
![]() ,
после применения преобразования Лежандра
TdS = d(TS) – SdT на основании имеем при T,V =
const:
,
после применения преобразования Лежандра
TdS = d(TS) – SdT на основании имеем при T,V =
const:
Аналогичным
образом, обозначая через
![]() работу
немеханического характера, и применяя
преобразование pdV= d(pV) - Vdp, найдем из (2)
в условиях T,р = const:
работу
немеханического характера, и применяя
преобразование pdV= d(pV) - Vdp, найдем из (2)
в условиях T,р = const:
![]()
Поэтому
свободную энергию Гельмгольца и Гиббса
называют соответственно изохорно –
изотермическим и изобарно – изотермическим
потенциалом. Однако понятие «свободной
энергии» (Гельмгольца и Гиббса) вовсе
не характеризует «запас» превратимой
энергии в системе, поскольку как
с![]() овершаются
не только за счет энергии самой системы,
но и за счет энергии окружающей среды
в процессе теплообмена с ней. Больше
того, связанную энергию TS, строго говоря,
нельзя считать частью внутренней энергии
U или энтальпии H, поскольку для большинства
случаев TS по своей величине оказывается
больше них самих. Следует также заметить,
что переход свободной энергии в связанную
не описывает исчерпывающим образом
диссипативные процессы в системе.
овершаются
не только за счет энергии самой системы,
но и за счет энергии окружающей среды
в процессе теплообмена с ней. Больше
того, связанную энергию TS, строго говоря,
нельзя считать частью внутренней энергии
U или энтальпии H, поскольку для большинства
случаев TS по своей величине оказывается
больше них самих. Следует также заметить,
что переход свободной энергии в связанную
не описывает исчерпывающим образом
диссипативные процессы в системе.
Так,
в процессах механической обработки
металлов коэффициент выхода тепла
(отношение выделившегося тепла к работе
деструкции) часто оказывается меньше
единицы, что свидетельствует о переходе
части энергии в нетепловые формы.
Наконец, в открытых системах (обменивающихся
веществом с окружающей средой) работа
![]() вообще
не определяется убылью какого-либо
термодинамического потенциала системы.
Причину этого нетрудно понять, рассматривая
объединенное уравнение 1-го и 2-го начал
для открытых систем в форме обобщенного
соотношения Гиббса:
вообще
не определяется убылью какого-либо
термодинамического потенциала системы.
Причину этого нетрудно понять, рассматривая
объединенное уравнение 1-го и 2-го начал
для открытых систем в форме обобщенного
соотношения Гиббса:

где
![]() -
масса k-го вещества и его химический
потенциал. Если включить в правую часть
(5) работу
-
масса k-го вещества и его химический
потенциал. Если включить в правую часть
(5) работу
![]() и
применить преобразование
и
применить преобразование
![]() из
(5) найдем:
из
(5) найдем:
![]()
откуда
в силу определения химического потенциала
![]() и
соотношения Гиббса-Дюгема
и
соотношения Гиббса-Дюгема
![]() следует
равенство немеханической работы н
следует
равенство немеханической работы н![]() улю.
Таким образом, во многих случаях деление
энергии на свободную и связанную также
утрачивает свою эвристическую ценность.
улю.
Таким образом, во многих случаях деление
энергии на свободную и связанную также
утрачивает свою эвристическую ценность.
Энтропия - (от греч. en — в, внутрь и trope — поворот, превращение), величина, характеризующая меру связанной энергии (D S), которая в изотермическом процессе не может быть превращена в работу. Она определяется логарифмом термодинамической вероятности и указывает направление самопроизвольного процесса в какой-либо изолированной системе (экосистеме). Энтропия является мерой беспорядка в системе (экосистеме). Понятие энтропии было введено Р. Клаузисом (1865).
Уравне́ние Гельмго́льца — это эллиптическое дифференциальное уравнение в частных производных:
(Δ + k2)U = f
г![]() де —
это оператор
Лапласа, а
неизвестная функция U
определена в
де —
это оператор
Лапласа, а
неизвестная функция U
определена в
![]() (на
практике уравнение Гельмгольца
применяется для n
= 1, 2, 3).
(на
практике уравнение Гельмгольца
применяется для n
= 1, 2, 3).
Как легко заметить, в уравнение Гельмгольца не входят операторы дифференцирования по времени, следовательно, сведение исходной задачи в частных производных к уравнению Гельмгольца может упростить её решение. Рассмотрим волновое уравнение:
![]()
Пусть функции u
и f
допускают разделение переменных:
![]() ,
и пусть T(t)
= eiωt.
Заметим, что в пространстве
Фурье-преобразований
дифференцирование по времени соответствует
умножению на множитель iω.
Таким образом, наше уравнение приводится
к виду:
,
и пусть T(t)
= eiωt.
Заметим, что в пространстве
Фурье-преобразований
дифференцирование по времени соответствует
умножению на множитель iω.
Таким образом, наше уравнение приводится
к виду:
![]() где—
где—
![]() это
квадрат модуля волнового вектора.
это
квадрат модуля волнового вектора.
Характеристика полного потока энергии и энтропии в открытых термодинамических системах. Уравнение Пригожина.
Характеристика полного потока энергии и энтропииа открытых термодинамических системах. Уравнение Пригожина
Применение второго закона к биологическим системам в его классической формулировке приводит, как кажется на первый взгляд, к парадоксальному выводу, что процессы жизнедеятельности идут с нарушением принципов термодинамики.
В самом деле, усложнение и увеличение упорядоченности организмов в период их роста сопровождаются кажущимся уменьшением, а не увеличением энтропии, как должно было бы следовать из второго закона.
Однако увеличение энтропии в необратимых самопроизвольных процессах происходит в изолированных системах, а биологические системы являются открытыми. Проблема поэтому заключается в том, чтобы, во-первых, понять, как связано изменение энтропии с параметрами процессов в открытой системе, а во-вторых, выяснить, можно ли предсказать общее направление необратимых процессов в открытой системе по изменению ее энтропии. Главная трудность в решении этой проблемы состоит в том, что мы должны учитывать изменение всех термодинамических величин во времени непосредственно в ходе процессов в открытой системе.
Постулат И.Р. Пригожина состоит в том, что общее изменение энтропии dS открытой системы может происходить независимо либо за счет процессов обмена с внешней средой (deS ), либо вследствие внутренних необратимых процессов (diS ):
dS = deS + diS.
Во всех реальных случаях diS > 0, и только если внутренние процессы идут обратимо и равновесно, то diS = 0. Для изолированных систем deS = 0, и мы приходим к классической формулировке второго закона:
dS = diS = 0.
В клеточном метаболизме всегда можно выделить такие две группы процессов. Например, поступление извне глюкозы, выделение наружу продуктов ее окисления (deS) и окисление глюкозы в процессах дыхания (diS).
В фотосинтезе приток свободной энергии света приводит к уменьшению энтропии клетки deS < 0, а процессы дыхания, диссимиляции в клетке увеличивают ее энтропию diS > 0. В зависимости от соотношения скоростей изменения deS и diS общая энтропия dS открытой системы может либо увеличиваться, либо уменьшаться со временем.
Если единственной причиной необратимости и увеличения энтропии системы являются ее внутренние процессы, то они ведут к уменьшению ее термодинамического потенциала. В этом случае
где G - полный термодинамический потенциал (или энергия Гиббса G = U + PV - TS ).
Можно показать, что скорость возникновения положительной энтропии внутри открытой химической системы зависит от химического сродства А и скорости реакции u:
Химическое сродство А определяется разностью химических потенциалов реагентов реакции, то есть ее движущей силой.
Стационарное состояние термодинамических систем. Отличие стационарного состояния от термодинамического равновесия.
Стационарное состояние термодинамческих систем. Отличие стационарного состояния от термодинамического равновесия
Открытые системы (О.с.), термодинамические системы, которые обмениваются с окружающей средой веществом (а также энергией и импульсом). К наиболее важному типу О. с. относятся химические системы, в которых непрерывно протекают химические реакции, происходит поступление реагирующих веществ извне, а продукты реакций отводятся. Биологические системы, живые организмы можно также рассматривать как открытые химические системы. Такой подход к живым организмам позволяет исследовать процессы их развития и жизнедеятельности на основе законов термодинамики неравновесных процессов, физической и химической кинетики.
Наиболее простыми являются свойства открытых систем вблизи состояния термодинамического равновесия. Если отклонение открытых систем от термодинамического равновесия мало и её состояние изменяется медленно, то неравновесное состояние можно охарактеризовать теми же параметрами, что и равновесное: температурой, химическими потенциалами компонентов системы и др. (но не с постоянными для всей системы значениями, а с зависящими от координат и времени). Степень неупорядоченности таких О. с., как и систем в равновесном состоянии, характеризуется энтропией. Энтропия О. с. в неравновесном (локально-равновесном) состоянии определяется, в силу аддитивности энтропии, как сумма значений энтропии отдельных малых элементов системы, находящихся в локальном равновесии.Согласно второму началу термодинамики, в замкнутой изолированной системе энтропия, возрастая, стремится к своему равновесному максимальному значению, а производство энтропии — к нулю. В отличие от замкнутой системы, в О. с. возможны стационарные состояния с постоянным производством энтропии, которая должна при этом отводиться от системы. Такое стационарное состояние характеризуется постоянством скоростей химических реакций и переноса реагирующих веществ и энергии. При таком "проточном равновесии" производство энтропии в Открытых системах минимально (Пригожина теорема).
Наиболее интересные свойства О. с. выявляются при нелинейных процессах. При таких процессах в О. с. возможно осуществление термодинамически устойчивых неравновесных (в частном случае стационарных) состояний, далёких от состояния термодинамического равновесия и характеризующихся определённой пространственной или временной упорядоченностью (структурой), которую называют диссипативной, т.к. её существование требует непрерывного обмена веществом и энергией с окружающей средой. Нелинейные процессы в О. с. и возможность образований структур исследуются на основе уравнений кинетики химической; баланса скоростей химических реакций в системе со скоростями подачи реагирующих веществ и отвода продуктов реакции. Накопление в О. с. активных продуктов реакций или теплоты может привести к автоколебательному (самоподдерживающемуся) режиму реакций. Для этого необходимо, чтобы в системе реализовалась положительная обратная связь: ускорение реакций под воздействием либо её продукта (химический автокатализ), либо теплоты, выделяющейся при реакции. Подобно тому, как в колебательном контуре с положительной обратной связью возникают устойчивые саморегулирующиеся незатухающие колебания (автоколебания), в химической О. с. с положительной обратной связью возникают незатухающие саморегулирующиеся химические реакции. Автокаталитические реакции могут привести к неустойчивости химических процессов в однородной среде и к появлению у О. с. стационарных состояний с упорядоченным пространственным неоднородным распределением концентраций (диссипативных структур с упорядоченностью на макроскопическом уровне).
Теория О. с. важна для понимания физико-химических процессов, лежащих в основе жизни, т.к. живой организм представляет собой устойчивую саморегулирующуюся О. с., обладающую высокой организацией как на молекулярном, так и на макроскопическом уровне. Подход к живым системам как к О. с., в которых протекают нелинейные химические реакции, открывает новые возможности для исследования процессов молекулярной самоорганизации на ранних этапах возникновения жизни.Теория О. с. является частным случаем общей теории систем, к которым относятся, например, рассматриваемые в кибернетике системы переработки информации, транспортные узлы, системы энергоснабжения и др. Подобные системы, хотя и не являются термодинамическими, но описываются системой уравнений баланса, в общем случае нелинейных, аналогичных рассматриваемым для физико-химических и биологических О. с. Для всех систем существуют общие проблемы регулирования и оптимального функционирования.
Аутостабилизация открытых термодинамических систем (Ле Шателье). Типы переходов стационарных состояний. Устойчивые и неустойчивые стационарные состояния.
Аутостабилизация открытых термодинамических систем(Ле Шателье).Типы переходов стационарных состояний .Устойчивые и неустойчивые стационарные состояния
Ле Шателье — Брауна принцип (принцип смещения равновесия), устанавливает, что внешнее воздействие, выводящее систему из состояния термодинамического равновесия, вызывает в системе процессы, стремящиеся ослабить эффект воздействия. Так, при нагревании равновесной системы в ней происходят изменения (например, химические реакции), идущие с поглощением теплоты, а при охлаждении — изменения, протекающие с выделением теплоты. При увеличении давления смещение равновесия связано с уменьшением общего объёма системы, а уменьшению давления сопутствуют физические или химические процессы, приводящие к увеличению объема.
Принцип смещения равновесия в зависимости от температуры высказал Я. Вант-Гофф (1884). В общем виде принцип смещения равновесия установлен А. Ле Шателье (1884) и термодинамически обоснован К. Брауном (1887). Исторически Ле Ш. — Б. п. был сформулирован по аналогии с правилом индукции Ленца (см. Ленца правило); вполне строго принцип выводится из общего условия термодинамического равновесия (максимальности энтропии). Ле Ш. — Б. п. позволяет определять направление смещения равновесия термодинамических систем без детального анализа условий равновесия
Под
устойчивостью
стационарного
состояния
физико-химической системы понимают её
невосприимчивость к случайным флуктуациям,
то есть случайным кратковременным
изменениям значений управляющих
параметров системы (концентраций
компонентов, температуры окружающей
среды, скорости протока реагентов через
реактор и т.п.). Если стационарное
состояние системы является устойчивым,
то случайные флуктуации не будут
оказывать существенного воздействия
на поведение системы. Если же стационарное
состояние неустойчиво, тогда под
воздействием случайных флуктуаций
система самопроизвольно перейдёт в
качественно новое состояние.
Для
исследования устойчивости систем
существует два метода, разработанных
русским математиком А.М. Ляпуновым.
Первый
метод Ляпунова
основан на определении корней
характеристического
уравнения
системы дифференциальных уравнений,
описывающей физико-химическую систему.
Второй метод Ляпунова основан на
исследовании физико-химической системы
с помощью функции Ляпунова.
Определение.
Рассмотрим некоторое стационарное
состояние системы
![]() .
Если найдётся функция
.
Если найдётся функция
![]() ,
которая равна нулю в стационарном
состоянии
,
которая равна нулю в стационарном
состоянии
|
|
|
и знакоопределена в его окрестности, т.е.
|
|
|
то такую функцию называют функцией Ляпунова. Второй метод Ляпунова заключается в исследовании знака производной от функции Ляпунова dV/dt. Если в окрестности рассматриваемого стационарного состояния знак функции Ляпунова V отличается от знака её производной dV/dt, то такое стационарное состояние устойчиво; если же знаки функции Ляпунова V и её производной dV/dt совпадают, то стационарное состояние неустойчиво:
|
|
состояние устойчиво; |
|
|
состояние неустойчиво. |
Заключение.
По завершению работы над рефератом, я рассмотрел основные понятия биоэнергетики и термодинамики, изучить I и II законы термодинамики.
После написания реферата, я могу ответить поставленные темой реферата.
Анализ таких систем важен для понимания возможных путей возникновения живого из неживого и усложнения биол. организации на первых стадиях биохимич. эволюции. Несмотря на прогресс термодинамике биологических систем в этой области, проблема специфики термодинамических свойств биологических систем и проблема их эволюции выходят за рамки чистой термодинамики и должны решаться с использованием др. подходов (теория информации и информац. ценности, заключённой в биологических системах, теория автоматов, кинетич. анализ) и опираться на совр. достижения эволюц. теории и физико-химич. биологии.
