
- •4. Расставьте коэффициенты в уравнении химической реакции:
- •1. Определите , используя данные таблицы:
- •4. Расставьте коэффициенты в уравнении химической реакции:
- •Определите , используя данные таблицы:
- •1.Определите , используя данные таблицы
- •2) Продолжите заполнение таблицы фазовых полей для точек (3,4) в соответствии с рис.1. Для нонвариантных точек напишите уравнение, описывающее равновесие сосуществующих фаз.
- •Соответствует ли составу 5 тип кривой охлаждения, приведенной на рис.2. Если не соответствует - приведите свой вариант.
1-й семестр 2000/01 уч. года Контрольная работа N 2. Вариант 1.
n l ml 3 0 0 2 2 -1 2 1 2
1. Определите химический элемент, имеющий всего один электрон на этом подуровне.
2. Напишите полную электронную конфигурацию атома этого элемента. (3 балла)
2. Сколько г СH3COONa*3H2O надо взять, чтобы получить 100 г 0.82% водного раствора? Определите значение рН этого раствора (d=1г/см3) при 25оС. Ка(СH3COOH)=10-5. Напишите в ионной форме уравнение реакции, протекающей в растворе. (5 баллов)
3. Определите молярную массу бромида однозарядного катиона, если температура начала кипения 0.98%-ного водного раствора соли (d=1г/см3) равна 100.105оС. Считайте диссоциацию соли полной. Е(H2O)=0.52о. Напишите формулу соли.(5 баллов)
4. Расставьте коэффициенты в уравнении химической реакции:
K2Cr2O7 + NaI + H2SO4 Cr2(SO4)3 + Na2SO4 + K2SO4 + I2 + H2O,
используя метод электронно-ионных полуреакций.
1.Определите
![]() ,
используя данные таблицы:
,
используя данные таблицы:
|
|
|
|
|
|
|
–1491.9 |
–55.9 |
–236.1 |
0 |
–285.8 |
|
270.6 |
109.4 |
–265.1 |
116.2 |
70.1 |
2.
Рассчитайте значение
![]() ,
учитывая, что
,
учитывая, что
![]() = 0.536 В. (6 баллов)
= 0.536 В. (6 баллов)
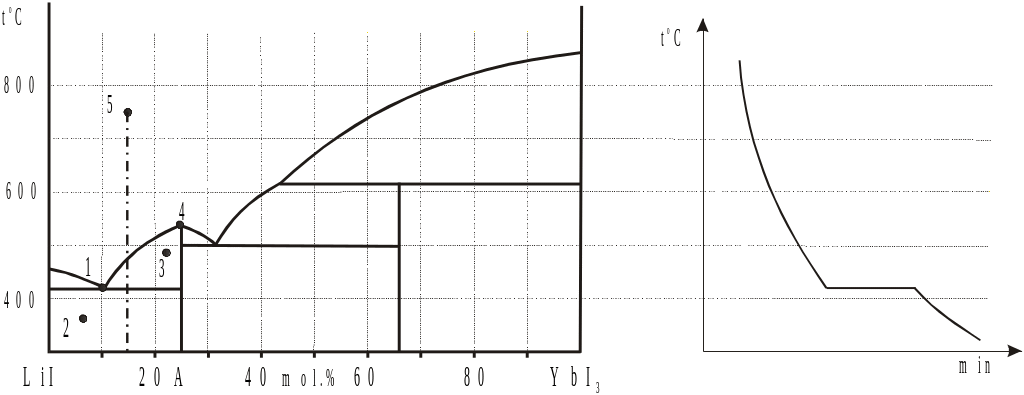
5. На рис.1 представлена фазовая диаграмма системы LiI – YbI3.
1) Рассчитайте и напишите формулу конгруэнтно плавящегося соединения в данной системе.
2) Продолжите заполнение таблицы фазовых полей для точек (3,4) в соответствии с рис.1. Для нонвариантных точек напишите уравнение, описывающее равновесие сосуществующих фаз.
No точки |
Число фаз |
Название фаз |
Число степеней свободы |
Уравнение, описывающее равновесие фаз |
1 |
3 |
ж + LiIтв+Aтв. |
0 |
LiIтв+Aтв. ж. |
2 |
2 |
LiIтв+Aтв. |
1 |
|
3) Соответствует ли составу 5 тип кривой охлаждения, приведенной на рис.2. Если не соответствует - приведите свой вариант.
Рис.1 Рис.2
 (6
баллов)
(6
баллов)
1-й семестр 2000/01 уч. года Контрольная работа N 2. Вариант 2.
1. Среди указанных наборов квантовых чисел укажите тот, который корректно определяет орбиталь атома:
n l ml 3 3 0 3 1 0 2 1 -2
2. Напишите полную электронную конфигурацию атома этого элемента.
(3 балла)
2. Сколько г Na2SO3 *7H2O надо взять, чтобы получить 100 г 1.46%-ного водного раствора? Определите значение рН этого раствора (d=1г/см3) при 25оС. Ка (HSO3-)=10-7. Протолитическая реакция иона SO32- протекает только по первой ступени. Напишите в ионной форме уравнение этой реакции. (5 баллов)
3. Определите молярную массу нитрита однозарядного катиона, если понижение давления над 0.69%-ным водным раствором соли (d=1г/см3) равно 11.4 Па при 25оС. Давление насыщенного пара воды при 25оС составляет 3167.2 Па. Считайте диссоциацию соли полной. Напишите формулу соли. (5 баллов)
4. Расставьте коэффициенты в уравнении химической реакции:
Zn + NaNO3 + NaOH + H2O Na2[Zn(OH)4]+NH3,
используя метод электронно-ионных полуреакций.
1. Определите , используя данные таблицы:
|
|
|
|
|
|
|
,кДж/моль |
0 |
–230.5 |
–230.2 |
–285.8 |
–1092.5 |
–46.2 |
,Дж/(моль·К) |
41.6 |
147.3 |
–8.6 |
70.1 |
89.7 |
192.6 |
2.
Рассчитайте значение
![]() ,
учитывая, что
,
учитывая, что
![]() =
– 0.12 В.
=
– 0.12 В.
(6 баллов)
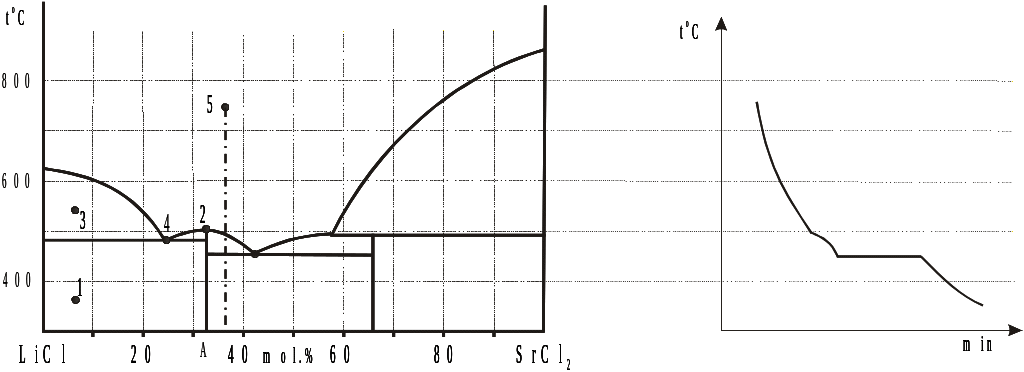
5. На рис.1 представлена фазовая диаграмма системы LiCl – SrCl2.
1) Рассчитайте и напишите формулу конгруэнтно плавящегося соединения в данной системе.
2) Продолжите заполнение таблицы фазовых полей для точек (3,4) в соответствии с рис.1. Для нонвариантных точек напишите уравнение, описывающее равновесие сосуществующих фаз.
No точки |
Число фаз |
Название фаз |
Число степеней свободы |
Уравнение, описывающее равновесие фаз |
1 |
2 |
LiClтв+Aтв. |
1 |
|
2 |
2 |
ж+Aтв. |
0 |
Aтв. ж. |
3) Соответствует ли составу 5 тип кривой охлаждения, приведенной на рис.2. Если не соответствует - приведите свой вариант.
Рис.1 Рис.2
 (6
баллов)
(6
баллов)
1-й семестр 2000/01 уч. года Контрольная работа N 2. Вариант 3.
1. Среди указанных наборов квантовых чисел укажите тот, который корректно определяет орбиталь атома:
n l ml 3 2 0 2 2 0 3 2 -3
2. Напишите полную электронную конфигурацию атома этого элемента.
(3 балла)
2. Сколько г Na2СO3 *10H2O надо взять, чтобы получить 100 г 1.06% водного раствора? Определите значение рН этого раствора (d=1г/см3) при 25оС. Ка(HСO3-)=10-11. Протолитическая реакция иона CO32- протекает только по первой ступени. Напишите в ионной форме уравнение реакции, протекающей в растворе. (5 баллов)
3. Определите молярную массу нитрата однозарядного катиона, если температура начала замерзания 0.8%-ного водного раствора соли (d=1г/см3) равна –0.375оС. Считайте диссоциацию соли полной. К(H2O)=1.86о. Напишите формулу соли. (5 баллов)
4. Расставьте коэффициенты в уравнении химической реакции:
Cl2 + NaOH NaCl + NaClO3 + H2O,
используя метод электронно-ионных полуреакций.
Определите , используя данные таблицы:
|
|
|
|
|
|
, кДж/моль |
0 |
–230.2 |
–167.2 |
–98.3 |
–285.8 |
, Дж/(моль·К) |
222.9 |
–8.6 |
56.5 |
163.2 |
70.1 |
2.
Рассчитайте значение
![]() ,
учитывая, что
,
учитывая, что
![]() = 1.359 В.(6 баллов)
= 1.359 В.(6 баллов)
5. На рис.1 представлена фазовая диаграмма системы KCl – SnCl2.
1) Рассчитайте и напишите формулу конгруэнтно плавящегося соединения в данной системе.
2) Продолжите заполнение таблицы фазовых полей для точек (3,4) в соответствии с рис.1. Для нонвариантных точек напишите уравнение, описывающее равновесие сосуществующих фаз.
No точки |
Число фаз |
Название фаз |
Число степеней свободы |
Уравнение, описывающее равновесие фаз |
1 |
2 |
KClтв+ж. |
0 |
KClтв. ж. |
2 |
2 |
KClтв+ж. |
1 |
|
3) Соответствует ли составу 5 тип кривой охлаждения, приведенной на рис.2. Если не соответствует - приведите свой вариант.
Рис.1 Рис.2
 (6
баллов)
(6
баллов)
1-й семестр 2000/01 уч. года Контрольная работа N 2. Вариант 4.
1. Среди указанных наборов квантовых чисел укажите тот, который корректно определяет орбиталь атома:
n l ml 1 1 0 2 1 0 2 0 1
2. Напишите полную электронную конфигурацию атома этого элемента.
(3 балла)
2. Сколько г Na2S *9H2O надо взять, чтобы получить 100 г 0.78%-ного водного раствора? Определите значение рН этого раствора (d=1г/см3) при 25оС. Ка (HS-)=10-13. Протолитическая реакция иона S2- протекает только по первой ступени. Напишите в ионной форме уравнение этой реакции. (5 баллов)
3. Определите молярную массу формиата однозарядного катиона, если осмотическое давление 0.68%-ного водного раствора соли (d=1г/см3) равно 495 кПа при 25оС. Считайте диссоциацию соли полной. Напишите формулу соли.(5 баллов)
4. В уравнении химической реакции:
KMnO4 + FeSO4 + H2SO4 MnSO4 + K2SO4 + Fe2(SO4)3 + H2O
расставьте коэффициенты, используя метод электронно-ионных полуреакций.
