
- •Часть V Лабораторная работа Окислительно-восстановительные реакции
- •Программа коллоквиума
- •1. Восстановительные свойства металлов
- •2. Окислительные свойства галогенов
- •3. Окислительные свойства ионов высшей валентности
- •4. Окислительно-восстановительные свойства ионов трехвалентного азота.
- •5. Окислительно-восстановительные свойства перекиси
1. Восстановительные свойства металлов
В три пробирки налить до 1/3 объема раствора сульфата меди и опустить на несколько минут в одну цинковую, во вторую - железную, в третью - алюминиевую пластинки. Что происходит? Составить уравнения реакций.
Примечание: уравнения данных реакции и вес последующие составлять, пользуясь электронными уравнениями. Указать в каждом случае, что является окислителем, что восстановителем. Написать наблюдаемые явления.
2. Окислительные свойства галогенов
К 2-3 мл сероводородной воды (Н£) прибавить по каплям бромную или йодную воду. Наблюдать обесцвечивание и помутнение раствора Объяснить наблюдаемое явление.
3. Окислительные свойства ионов высшей валентности
а) подействовать на несколько кристалликов перманганата калия (КМпО4) небольшим количеством концентрированной соляной кислоты (под тягой). Наблюдать образование в пробирке газа (какого?). Составить уравнение реакции:
б) подействовать на подкисленный разбавленной серной кислотой раствор дихромата калин К2Сг2 О7 раствором сульфата железа (II) FeSO4. Записать наблюдаемые изменения. Пользуясь электронными уравнениями, расставить коэффициенты в схеме реакции:
К2Сг2 О7 + Н2SO4 +FeSO4. ---► Сг2(SO4)3 + K2SO4 + MnSO4 + Н2О
в) к 2 мл раствора сульфата железа (II) Рс50ч прилить равный объем разбавленной серной кислоты и 1 мл раствора КМпО4 Окраска исчезает. Почему? Схема реакции:
FeSO4. + Н2SO4 + КМпО4 --► +Fe2(SO4)3 +К2 SO4 + Мп SO4 + Н20
г) на небольшое количество меди подействовать в отдельных пробирках концентрированной и разбавленной азотной кислотой. Делать под тягой! Записать наблюдаемые изменения и составить уравнение химической реакции. Примечание при взаимодействии меди с концентрированной азотной кислотой выделяется оксид азота (IV), а с разбавленной - оксид азота (II)
4. Окислительно-восстановительные свойства ионов трехвалентного азота.
В две пробирки налить раствор интрига калия, подкисленного разбавленной серной кислотой В одну пробирку прилить раствор иодида калия, а в другую дихромата калия Записать наблюдения и расставить коэффициенты в схеме реакции.
1. КNО2 + 4 KJ + H2SO4---- ► K2SO4 +N0 ↑ + H20
2 КNО2 + K2Cr2O7---- ► KNO3 + K2SO4 + Сг2(SO4)3 + Н20
5. Окислительно-восстановительные свойства перекиси
Водорода
а) к подкисленному разбавленной серной кислотой раствору перманганата калия прилить раствор перекиси водорода. При помощи лучинки испытать выделяющийся газ. Расставить коэффициенты, указать окислитель и восстановитель и схеме реакции:
КМпО4 + H2SO4 H2O2— > К2S04 + МnS04 + Н20 + 02 ↑
б) к подкисленному разбавленной серной кислотой раствору иодида калия прилить раствор перекиси водорода. Записать наблюдаемые явления. Расставить коэффициенты, указать окислитель и восстановитель в схеме реакции:
KJ + H2SO4+ H2O2 ---► J2+ К2S04 + Н20
Доказать присутствие свободного йода, прибавив в пробирку немного крахмального клейстера.
Примечания и меры предосторожности 1. Выполняя опыты, пользуйтесь растворами только указанной концентрации, соблюдайте рекомендуемую дозировку 2 Работа с кислотами требует предельной осторожности. Опыты с азотной кислотой и Н2S проводить под тягой! При попадании кислоты на незащищенные участки тела удалить кислоту обильной струей воды (в течение 15 минут) и затем нейтрализовать возможные остатки ее 3% раствором чайной соды( NaНСО3) 3. При попадании на руки растворов К2Cr2O7, FеSО4, Н2О2, J2 немедленно смыть их большим количеством воды. 4 Следует учесть, что перманганат калия (КМпО4) сильный окислитель и при смеши паини с серой, фосфором и различными органическими соединениями образует взрывчатые смеси.
Лабораторная работа
ХРОМ
Цель работы: ознакомиться с методами получения, применения и свойствами хрома и его соединений.
Программа коллоквиума
Общая характеристика элементов подгруппы хрома. Электронные конфигурации атомов хрома, молибдена, вольфрама. Какие степени окисления проявляют эти элементы в соединениях? Нахождение хрома в природе и методы промышленного получения его из руд. Использование металлического хрома и его сплавов в технике Физические и химические свойства хрома (отношение к кислороду, галогенам, углероду, азоту, фосфору, воде, щелочам, кислотам). Оксиды и гидроксиды хрома, их производные. Амфотерные свойства оксида и гидроксила хрома (Ш). Восстановительные свойства соединений трехвалентного хрома Хромовая и дихромовая кислоты, хромовый ангидрид. Хроматы и дихроматы. Окислительные свойства соединений шестивалентного хрома.
Теоретические основы метода выполнения работы
Хром является представителем побочной подгруппы УІ группы периодической системы, то есть d - элементом. Помимо хрома в эту подгруппу входят молибден Мо, вольфрам W.
На внешнем Электронном слое атома хрома и атома молибдена находится 1s- электрон, а у атома вольфрама два s- электрона. На предвнешнем электронном слое у атомов хрома и молибдена содержится 13 электронов, из них 5 на d- подуровне, а у атома вольфрама соответственно, 12 и 4 электрона:
24Cr52 1s2 2s2 2р6 3s2 3р6 3d5 4s1
42Мо96 1 s2 2s2 2р6 3s2 Зр6 3d10 4s2 4р6 4d5 5s1
74 W184 2s2 2s2 2p 63s2 Зр6 Зd10 4s2 4р6 4d104f 145р6 5s25d46s2
У атомов хрома и молибдена наблюдается проскок одного электрона с s- подуровня на d- подуровень предвнеишего электронного слоя:

Такое состояние наполовину законченного d – электронного подуровня (d5) является более устойчивым для атома.
Наличие у атомов элементов подгруппы хрома на внешнем обуславливает металлический характер их свойств.
В химических реакциях хром, молибден, вольфрам участвуют только как доноры электроном. В связи с этим, они имеют лишь положительные степени окисления, высшая и которых равна шести, в соответствии с номером группы.
Для хрома наиболее характерны степени окисления ьЗ,+6, для молибдена и вольфрама +6. Высшая степень окисления возникает при полном возбуждении атомов Оксиды в этой степени окисления проявляют кислотные свойства и способны образовывать кислоты типа Н2Х04.
Сила кислот, являющихся производными оксидов хрома (VI). молибдена (VI) и вольфрама (VI) (СrO3, МоО3, WО3 ) значительно уменьшается при переходе от хрома к вольфраму.
Для хрома и его аналогов характерна способность к комплексообразованию в качестве центрального атома с координационными числами 4 и 6. Это связано с наличием в электронного оболочке их атомов вакантных орбиталей, проявляющих тенденцию участвовать в образовании связей с электронами других частиц.
Хром твердый тугоплавкий, серовато-белый блестящий металл, имеющий плотность - 7.2 г/см1, Тпл. = 1890°С, Ткип.= 3390°С. Он хорошо подвергается механической обработке, но при загрязнении (углеродом, водородом) становится хрупким, ломким.
В обычных условиях хром, благодаря образовавшейся на его поверхности тончайшей защитной пленке, химически малоактивен, устойчив к воздействию кислорода воздуха, влаги. При температуре выше 600ГС он вытесняет водород из воды, реагирует с кислородом, галогенами, серой, азотом, углеродом и другими неметаллами, образуя соответственно оксид (Сг2О3), галогениды (СгF;. СгF3). сульфид (Сr2S3), карбиды (Сr4С, Сг3С4). нитриды (СгN, Сг2N).
В ряду напряжений хром стоит левее водорода (Сг 2+/ Сг =- 0.566 в), поэтому вытесняет его из разбавленных НС1 и Н3SО4.
Сг + 2НС1 -► СгСI*+ 3Н2O Сr+ Н2S04 —► СгS04+ Н2↑
Концентрированная серная и азотная кислоты, царская водка пассивируют хром. В подавляющем большинстве соединений он выступает как двух-, трех-, и шестивалентный элемент. Для него известны следующие оксиды: CrO- оксид хрома (II). Cr2O3 - оксид хрома (III), СгО3 - хромовый ангидрид, им соответствуют гидроксиды: Cr(OH)2; , Cr(OH)3 и кислоты: Н2СгО4 - хромовая, Н2Сг2O7 – дихромовая. Оксид и гидроксид хрома (II) имеют основной характер, оксид и гидроксид хрома (III) амфотерный. Если первые взаимодействуют с киотами то вторые с кислотами и щелочами:
Сг(ОН)3 + ЗНС1 = СгСІ3 + ЗН20 Сг(ОН)3 + NаОН = 2Н20 + NаСгО2
хромит натрия
Сг(ОН)3 + 3 NаОН = Nа3[ (Сг(ОН)6]
Гексагидроксохромит натрия
Основные и кислотные свойства гидроксида хрома (III) выражены слабо, поэтому соли с катионом Сг+3 или анионом СгО2 подвержены в водных растворах заметному гидролизу, степень которого, как обычно, возрастает с повышением температуры раствора и уменьшением его концентрации:
СrCI+ 3НCI = Сг(0Н)СI2+ 4 НCI или
Сr+3 + НОН= Сг(ОН)+2 + Н+ рН <7
Сульфиды и карбонаты хрома в водных растворах получены быть не могут, так как подвергаются полному гидролизу, поскольку это соли слабого основания и слабой кислоты:
2СгСI3 +3Na 2С03 +ЗН0Н = 2Сr(ОН)3 +ЗСО2↑+6NaСI
или 2Сг3+ +3С03-3 +ЗН0Н = 2Сr(ОН)3↓ +ЗСО2↑
Ион Сг3+ имеет склонность к образованию комплексных II соединений с различными лигандами, способными входить во внутреннюю координационную сферу:(ОН , Н2О, NН3, F,СI ,J , Вг и др.), проявляя при этом обычно координационное чисто шесть:
[ Cr(H2O)6] CI3 - хлорид гексааквахрома (III)
[ Cr(NH3)6] CI3 - хлорид гексаамминхрома (III)
Склонность к образованию комплексов с координационным числом пять объясняется структурой иона Cr3+ (наличием шесть свободных орбиталей: двух 3d, один 4s и трех 4р).
↑
↑
↑
↑
3d 4s 4p
Оксид хрома (III) Сг203 в обычных условиях не растворяется в воде, кислотах и щелочах. В лаборатории этот тугоплавкий зеленого цвета порошок получается разложением дихромата аммония:
t
(NH4)2Cr2O7 —> N2 + Сг202 + 4 Н20
В растворимое состояние Cr2O3 можно перевести в виде солей Сг3+ полученных:
а) обработкой Сг203 парами кипящей Н2SO4
t
С г203
+
Н2SO4
Сг2(SO4
)3
+3Н2О
г203
+
Н2SO4
Сг2(SO4
)3
+3Н2О
б) сплавлением со щелочами (в отсутствие воздуха)
t
С г203 +2 NaOH 2 NaСгO2 + Н2О
В присутствии кислорода воздуха эта реакция протекает с образованием хроматов
t
С г203 + O2 +8NaOH NaСгO4 +4Н2О
хромат- натрия
Последняя реакция характеризует способность соединений Сг3+ легко переходил, в соединения со степенью окисления хрома +6, т .e. их восстановительные свойства. Такое превращение легко осуществляется в щелочной среде при действии хлора (СI2), бромной воды (Вч2), перекиси водорода (Н202). хлората калия (КСI 03), нитрата калия (КNО3) и др . при этом зеленая окраска иона Сг3+ переходит в желтую, характерную для хромат-иона Сг042-
2Na Сг02 + 3 Н202 + 2NаОН — 2Nа2 Сг04 + 4Н20
В кислой или нейтральной среде окисление идет до дихромат йона Сг2072-(оранжевого цвета):
Сг2(SO4 )3 +2KMnO4 + 5H2O = K2Сг207 + 2MnO(OH)2 +H2SO4
Хроматы и дихроматы соли хромовой (Н2 Сг04) кислоты и дихромовой (Н2 Сг 207) кислоты, существующих только в растворах.
В зависимости от рН раствора, хромат-ион может переходить, в дихромат-нон и наоборот.
2Н
2СrO42- < > Сr2O42- + Н2О
Хромат 20Н дихромат
Из этого равновесия видно, что при добавлении кислоты равновесие смещается в сторону образования дихроматов, при добавлении щелочи - в сторону образования хроматов:
К2С rO4 + Н2SO4 = K2Сг207 + K2SO4 + Н20 желтый оранжевый
К2С rO4 + KOH = K2Сг04 + Н20 оранжевый желтый
Хроматы и дихроматы являются сильными окислителями. Стандартные электродные потенциалы систем
Сг207-2-' + 14 Н++6е > 2 Сг3+ +7 Н2О и
СrO 42 + 8H+ + 3 е > 2 Сг3+ +4 Н20
равны, соответственно, 1,333 и 1,477 В Они могут быть восстановлены галогеноводородными кислотами - НСI, НВг, HJ ( с выделением хлора, брома и йода). Н2S ( с выделением серы), S02 ( с образованием сульфата), солями железа (II), спиртом и другими восстановителями до соединений трехвалентного хрома Например:
K2Cr2O2+3H2S
+ 4 Н2SО4=
К2SO4+
Сr2(SО4)3
+ 3S↓
+ 7H2O
оранжевый
зеленый
К2Cr2О7
+ 3С2H5ОН+
4Н2SO4=
К2SO4+Cr2(SO4)3+CH3CHO+7H2O
В
результате перехода аниона  в катион
в катион  по реакции
по реакции
 + 14
+ 14 + 6ē -----------> 2
+ 7
+ 6ē -----------> 2
+ 7
оранжевый
цвет раствора, свойственный дихроматам,
переходит
в зеленый. Хромоты и
дихроматы большинства металлов
плохо
растворимы в воде. Растворимы
только соли  ,
,
 и
щелочных металлов.
При обработке
сильно концентрированных растворов
хромата
или дихромата калия или
натрия избытком концентрированной
Н
и
щелочных металлов.
При обработке
сильно концентрированных растворов
хромата
или дихромата калия или
натрия избытком концентрированной
Н получается хромовый ангидрид Cr
получается хромовый ангидрид Cr :
:
К2Сr2O4 + Н2SO4 = CrO3 + K2SO4 + Н2О К2Сr2О7 + Н2SO4 = 2 СrO3 + К2 SO4 + Н2О
Хромовый
ангидрид представляет собой красное
(с фиолетовым оттенком) кристаллическое
вещество, расплывающееся на воздухе,
хорошо растворимое в воде. В зависимости
от концентрации раствора Cr
,
в
нем могут содержаться кислоты: с общей
формулой  ∙ n
Cr
:
Cr
+
Н2О
=
(хромовая)
2Cr
+ Н2О
= H2Cr2O7
(дихромовая)
ЗCr
+ Н2О
= H3Cr3O10
∙ n
Cr
:
Cr
+
Н2О
=
(хромовая)
2Cr
+ Н2О
= H2Cr2O7
(дихромовая)
ЗCr
+ Н2О
= H3Cr3O10 (трихромовая)
4Cr
+ Н2О
= H2Cr4O13
(тетрахромовая)
(трихромовая)
4Cr
+ Н2О
= H2Cr4O13
(тетрахромовая)
В связи с этим, из хромового ангидрида можно получить хроматы, дихроматы, трихроматы и тетрахроматы, растворы которых соответственно, окрашены в желтый, оранжевый, красно-коричневый и красный цвета. Как и все соединения хрома (VI), CrO3 проявляет окислительные свойства. Он может окислить серу, иод, фосфор, углерод, окись углерода, аммиак, спирты, кислоты (HJ, HВr, НСООН и др.), водные растворы сульфата железа (II) и хлорида олова (II) Так, при пропускании сухого аммиака над кристаллами CrO3, аммиак загорается: 2NH3 + 2 CrO3 --------> N2 +Сr2O3 + Н2O При действии щелочи на CrO3, получаются хроматы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Опыт 1. Отношение хрома к кислотам В три пробирки налить по 2-3 мл разбавленных соляной (HCl), серной (H2S04), и концентрированной азотной (HNO3,) кислот. В каждую пробирку опустить кусочки металлического хрома. С какими из кислот взаимодействует хром? Написать уравнения реакций. Каков цвет образовавшихся растворов? О присутствии каких ионов хрома в растворе он свидетельствует? Азотную кислоту слить из пробирки в специальную склянку. Объяснить наблюдаемые явления. Опыт 2. Получение и свойства оксида хрома (III) а) растереть в порошок и поместить в пробирку немного дихромата аммония (NH4)2Cr2O7, закрепить ее наклонно в штативе и нагреть (отверстие пробирки направить в сторону от себя и других работающих) до начала реакции. Затем нагревание прекратить. Отмстить происходящие явления, написать уравнение реакции.
б)
на полученный оксид хрома (III)
подействовать водой, разбавленными
соляной и серной кислотами. Растворяется
ли оксид хрома в воде и разбавленных
кислотах?
Опыт
3. Получение и свойства оксида xpo.ua (III).
В пробирку с раствором сульфата хрома
(III)
прилить раствор едкого натра до выпадения
серо-зеленого осадка гидроксила хрома
(III).
Осадок разделить на три пробирки и
испытать его отношение к кислотам НС1
и Н2SO4
и избытку щелочи (КОН или NaOН).
Полученный хромит натрия (калия) сохранить
для опыта 4в. Написать уравнения реакций
и сделать вывод о химическом
(кислотно-основном) характере гидроксида
хрома (III).
Опыт
4.Гидролиз солей хрома (III).
а)
налить в пробирку раствор сульфата
хрома и испытать
его действие на
синюю лакмусовую бумажку. Написать
в
молекулярной и ионной форме уравнение
реакции гидролиза
Сr2(SO4)3;
б)
к раствору сульфата хрома (III)
прибавить раствор
сульфида аммония
(HN4)2
до образования серо-зеленого
осадка
гидроксида хрома (III)
и выделения газообразного продукта.
Объяснить,
почему вместо сульфида хрома в этой
реакции
выделился Сr(ОН)3.
Доказать присутствие в пробирке
этого
вещества действием на одну его
часть кислотой, на другую -
избытком
щелочи. Написать уравнения
соответствующих
реакций в молекулярной
и ионной формах;
в) полученный в опыте
3 раствор хромита нагреть на
горелке.
Наблюдать выпадение осадка гидроксида
хрома(III).
Написать
в молекулярной и ионной формах
уравнение
гидролиза хромита. Указать,
как можно ослабить гидролиз этой соли.
Какое значение в этом опыте имеет
нагревание?
Опыт
5. Восстановительные свойства солей
хрома (III).
Получить
хромит натрия (или калия) действием на
1-2 мл
Cr2(SO4)3
избытка щелочи и прилить к нему бромной
воды.
Смесь осторожно нагреть, так
как щелочные растворы склонны
к
перегреванию и могут быть выброшены из
пробирки.
Наблюдать переход зеленой
окраски в желтую, характерную
для
хромат-ионов Сr . Написать уравнение реакции
окисления
хромита в хромат.
Опыт
6.Переход хромата в дихромат и обратно.
а)
к раствору хромата калия К2CrO4
прилить избыток 2 н
раствора H2SO4.
Как изменилась окраска раствора?
Присутствием
каких ионов в растворе объясняется
новая
окраска раствора? Написать
уравнение реакции;
б) к раствору
дихромата калия К2Сr2O7
прибавить раствор
щелочи до изменения
окраски. Написать уравнение реакции.
какие
ионы присутствуют в водных растворах
хромат и
дихромата?
Опыт
7.Получение малорастворимых хроматов.
а)
прилить, в одну пробирку раствор хромата,
в другую -
дихромата калия и прибавить
в обе пробирки раствор нитрата серебра
AgNO3.
Наблюдать в обоих случаях образование
красно-бурого осадка хромата серебра.
Для раствора дихромата это объясняется
тем что в растворе этой соли одновременно
имеются ионы Cr
. Написать уравнение реакции
окисления
хромита в хромат.
Опыт
6.Переход хромата в дихромат и обратно.
а)
к раствору хромата калия К2CrO4
прилить избыток 2 н
раствора H2SO4.
Как изменилась окраска раствора?
Присутствием
каких ионов в растворе объясняется
новая
окраска раствора? Написать
уравнение реакции;
б) к раствору
дихромата калия К2Сr2O7
прибавить раствор
щелочи до изменения
окраски. Написать уравнение реакции.
какие
ионы присутствуют в водных растворах
хромат и
дихромата?
Опыт
7.Получение малорастворимых хроматов.
а)
прилить, в одну пробирку раствор хромата,
в другую -
дихромата калия и прибавить
в обе пробирки раствор нитрата серебра
AgNO3.
Наблюдать в обоих случаях образование
красно-бурого осадка хромата серебра.
Для раствора дихромата это объясняется
тем что в растворе этой соли одновременно
имеются ионы Cr и Cr
и Cr ,
а произведение растворимости для хромата
серебра меньше, чем для дихромата
серебра.
,
а произведение растворимости для хромата
серебра меньше, чем для дихромата
серебра.
Написать уравнения реакций;
б) к растворам K2Cr2O7 и K2CrO4 прибавить раствор хлорида или нитрата бария. Как и в предыдущем опыте наблюдать выделение осадка. Написать уравнения реакций образования желтого хромата бария.
Опыт 8. Окислительные свойства дихромата калия.
Раствор дихромата калия им подкислить 2Н раствором Н2SО4 и прилить к нему раствор нитрита калия КNO2. Смесь слабо нагреть. Как изменилась окраска раствора? Написать уравнение реакции восстановления дихромат иона в ион хрома (III).
ПРИМЕЧАНИЕ И МЕРЫ ПРЕДОСТОРОЖНОСТИ 1. Работа с растворами соединений хрома, нитрата серебра, нитрата бария, сульфида аммония требует соблюдения всех мер предосторожности, так как все эти вещества токсичны, прижигающе действуют на кожу и могут вызвать их воспаление По окончании работы слить все растворы в специальную склянку и тщательно вымыть руки с мылом 2. Максимальной осторожности требует и работа с кислотами и щелочами. При ожогах этими веществами обожженное место необходимо, прежде всего, промыть водой. После этого нейтрализовать кислоту 3-5 % раствором бикарбоната натрия (NаНСО3), а щелочь 1% раствором борной или уксусной кислоты.
Лабораторная работа М А Р Г А Н Е Ц Цель работы: ознакомиться с применением, методами получения и свойствами марганца и его соединений. Программа коллоквиума Общая характеристика элементов подгруппы марганца. На примере марганца и хлора показать, каково сходство и различие в строении атомов и свойствах элементов главной и побочной
подгрупп
седьмой группы периодической системы.
Получение
марганца и ферромарганца
из руд, использование в технике.
Химические
свойства марганца: отношение к кислороду,
воде,
неметаллам-окислителям, кислотам,
щелочам. Какие степени
окисления
может проявлять марганец в своих
соединениях? Как
изменяются основные
и кислотные свойства в ряду оксидов
и
гидроксидов марганца по мере
увеличения его степени
окисления?
Соединения марганца (II),
их получение, свойства.
Написать
уравнение реакции, характеризующее
восстановительные
свойства марганца (II). Получение и
свойства
оксидов и гидроксидов марганца (IV).
Написать
уравнения реакций, в которых
соединения марганца (IV)
проявляют:
а) окислительные, б) восстановительные
свойства.
Манганаты: получение,
окислительные и восстановительные
свойства.
Оксид марганца (VII), марганцовая
кислота,
перманганаты. Написать
уравнения реакций характеризующие
окислительные
свойства перманганатов в кислой,
нейтральной и
щелочной средах.
Теоретические
основы метода выполнения работы.
Марганец
(Мn)
относится к числу переходных
металлов.
Вместе с технецием (Тс) и
рением (Rе)
он образует побочную
подгруппу VII
группы периодической системы
Д.И.Менделеева.
Атомы этих элементов
имею, два незаконченных внешних
уровня.
На последнем энергетическом уровне два
S-электрона,
предпоследнем,
помимо S
и р электронов, пять d-электронов:
25 1
1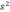 2
2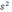 2
2
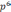 3
3
3
3
 4
4
43 1
2
2
3
3
1
2
2
3
3 4
4
 5
5
75R 1
2
2
3
3
4
4
1
2
2
3
3
4
4
 4
4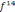


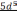 6
Распределение
валентных электронов по электронным
ячейкам
имеет следующий вид:
6
Распределение
валентных электронов по электронным
ячейкам
имеет следующий вид:
M
↑
↑
↑
↑
↑
↑↓
↑
n
↑
↑
↑
↑
↑
↑
↑
↑
3d 4s возбуждение
3d 4s 4p
Как
видно из электронной структуры атома,
у атомов
элементов подгруппы марганца
в возбужденном состоянии
максимальное
число электронов, способное участвовать
в
образовании химической связи ,
равно семи.
В связи с этим, атомы
марганца, технеция, рения, участвуя
в
химических реакциях, могут
образовывать соединения, в
которых
они одно-, двух-, трех-, четырех-, пяти-,
шести- и
семивалентны.
В свободном
виде марганец - компактный,
серебристо-белый
металл, твердый и
очень хрупкий. Удельный вес его 7,4
г/с ,
температура
плавления 124
,
температура
плавления 124 С.
Металлический
марганец известен в четырех
модификациях,
отличающихся типом
кристаллической решетки, физическими
свойствами
и способных переходить друг в друга
в
определенных интервалах температур:
74
С.
Металлический
марганец известен в четырех
модификациях,
отличающихся типом
кристаллической решетки, физическими
свойствами
и способных переходить друг в друга
в
определенных интервалах температур:
74



α-Mn ↔ β-Mn ↔ γ -Mn ↔ δ-Mn → Mn
70

 (расплавленный)
(расплавленный)
Химические свойства марганца определяются степенью его чистоты, так как присутствие даже небольших количеств примесей резко меняет его реакционную способность На воздухе металл покрыт тонкой . но прочной оксидной пленкой, которая предохраняет его от дальнейшего окисления. При высокой температуре марганец горит на воздухе, образуя
оксиды:
Mn
+ O2
= MnO2
2
Mn
+ O2
= 2 MnO
3
Mn
+ 2О2
= Mn3О4
В
мелкораздробленном состоянии процесс
окисления марганца
протекает очень
легко.
В ряду напряжений марганец
стоит между Mg и Zn , его
стандартный
электродный потенциал равен - 1,05 В,
поэтому он
может вытеснять водород
из воды и разбавленных соляной и
серной
кислот.
Вода при обычных условиях
действует на марганец очень
медленно,
при нагревании – быстрее:
Мn
+ 2Н2О=
Н2↑
+ Мn(ОН)2
С
кислотами он образует катионы М :
Мn
+2 HCl = MnCl2
+H2↑
Мп
+ H2SO4
= MnSO4
+ H2↑
разбав.
Концентрированная серная
кислота при нагревании (холодная
H2SO4
c
Мn
не реагирует) растворяет
марганец,
восстанавливаясь при этом
до оксида серы (IV) SO2.
Mn
+2Н2SO4
= MnSO4
+2 Н2О
+SО2
Концентрированная
и разбавленная азотная кислота
восстанавливается
марганцем до оксидов азота (NO и NO2):
3
Мn
+ 8HNO3
=
3Mn(NO3)2+2NO+4H2O
разбав.
Мn
+ 4HNO3
= Mn(NO3)2
+ 2NO2
+2Н2O
концен.
:
Мn
+2 HCl = MnCl2
+H2↑
Мп
+ H2SO4
= MnSO4
+ H2↑
разбав.
Концентрированная серная
кислота при нагревании (холодная
H2SO4
c
Мn
не реагирует) растворяет
марганец,
восстанавливаясь при этом
до оксида серы (IV) SO2.
Mn
+2Н2SO4
= MnSO4
+2 Н2О
+SО2
Концентрированная
и разбавленная азотная кислота
восстанавливается
марганцем до оксидов азота (NO и NO2):
3
Мn
+ 8HNO3
=
3Mn(NO3)2+2NO+4H2O
разбав.
Мn
+ 4HNO3
= Mn(NO3)2
+ 2NO2
+2Н2O
концен.
Концентрированные растворы щелочей КОН и NаОН не взаимодействуют с марганцем. В токе хлора этот металл сгорает с образованием хлорида марганца (II) MnCl2:
Мn
+ С12=
МnС12
При
нагревании такая реакция протекает и
с другими
галогенами (фтором,
бромом).
При температуре 120 С
марганец взаимодействует с азотом
(или
аммиаком NH3)
с образованием нитрида Мn3N2:
3Мn
+ N2
= Мn3N2
Прямым
взаимодействием марганца при нагревании
с серой, кремнием, углеродом, фосфором,
бромом получают соответственно, сульфиды
(MnS,
MnS2),
силициды (Mn3Si,
Mn5Si),
карбиды (Mn3C,
Mn5C2,
Mn7C3),
фосфиды (MnP2,
MnP),
бориды(MnB,
Mn2B,
Mn3B4,
MnB4).
С
водородом марганец не реагирует.
Как
было уже сказано, для марганца пакеты
соединения,
отвечающие степеням
окисления от +1 до +7, но наиболее
характерными
из них являются +2, +4, +6, +7. В этом ряду
сильно
проявляется влияние величины степени
окисления на
свойства соединений
марганца:
МnО
Мn2O3
МnO2
МnО3
Мn2О7
основные
оксиды амфотерный оксид
кислотные оксиды
По мере возрастания
степени окисления увеличивается
положительный
заряд, а следовательно, уменьшаются
размеры
иона, основные свойства его
ослабевают, а кислотные
усиливаются.
Изменяется и характер диссоциации
гидратных
соединений, соответствующих
этим оксидам, переходя от
основного
к кислотному:
С
марганец взаимодействует с азотом
(или
аммиаком NH3)
с образованием нитрида Мn3N2:
3Мn
+ N2
= Мn3N2
Прямым
взаимодействием марганца при нагревании
с серой, кремнием, углеродом, фосфором,
бромом получают соответственно, сульфиды
(MnS,
MnS2),
силициды (Mn3Si,
Mn5Si),
карбиды (Mn3C,
Mn5C2,
Mn7C3),
фосфиды (MnP2,
MnP),
бориды(MnB,
Mn2B,
Mn3B4,
MnB4).
С
водородом марганец не реагирует.
Как
было уже сказано, для марганца пакеты
соединения,
отвечающие степеням
окисления от +1 до +7, но наиболее
характерными
из них являются +2, +4, +6, +7. В этом ряду
сильно
проявляется влияние величины степени
окисления на
свойства соединений
марганца:
МnО
Мn2O3
МnO2
МnО3
Мn2О7
основные
оксиды амфотерный оксид
кислотные оксиды
По мере возрастания
степени окисления увеличивается
положительный
заряд, а следовательно, уменьшаются
размеры
иона, основные свойства его
ослабевают, а кислотные
усиливаются.
Изменяется и характер диссоциации
гидратных
соединений, соответствующих
этим оксидам, переходя от
основного
к кислотному:
усиливаются основные свойства
Мn(ОН)2 Мn(ОН)3 Мn(ОН)4 Н2МnО4 НМnО4
о сновной характер амфотерный характер кислотный характер
усиливаются кислотные свойства
Остановимся на характеристике некоторых, наиболее характерных соединений марганца. Эти соединения имеют разнообразную окраску (розовую, красную, коричневую, черную, зеленую, фиолетовую - в порядке возрастания валентности марганца), поэтому марганец был назван «химическим хамелеоном».
↑
↑
↑
↑
↑
 Соединения
M
Соединения
M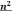 Двухвалентное
состояние марганца можно рассматривать
как
одно из самых устойчивых состояний. Это
объясняется
большой устойчивостью
наполовину заполненного d-подуровня
(3
Двухвалентное
состояние марганца можно рассматривать
как
одно из самых устойчивых состояний. Это
объясняется
большой устойчивостью
наполовину заполненного d-подуровня
(3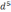 ) катиона М
:
3d
4s
4p
) катиона М
:
3d
4s
4p
Среди наиболее важных соединений марганца следует назвать его оксид, гидроксид, галогениды, сульфаты, нитраты и т.д. МnО - оксид марганца (II) получают прокаливанием оксидов с более высокой степенью окисления в атмосфере водорода:
t
M nO2 +H2 MnO + H2O
или прокаливанием карбоната марганца в вакууме:
t
МnСО3
МnО
+ СО2
Полученный
оксид представляет собой порошок
зеленого цвета, перерастворимый в воде,
но легко растворимый в кислотах с
образованием солей  :
МnО
+ H2SO4
= H2O
При
нагревании оксид марганца (II)
претерпевает следующие
изменения:
200-30
580-62
850-110
:
МnО
+ H2SO4
= H2O
При
нагревании оксид марганца (II)
претерпевает следующие
изменения:
200-30
580-62
850-110
6 MnO + 3O2 6MnO2 3Mn2O3 Mn3O4 Соли, отвечающие этому оксиду, получают при растворении Mn, MnO и MnO2 в кислотах:
Mn + 2HCl = MnCl2 + H2↑
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
Большинство
солей М хорошо растворимы в воде, их растворы
и кристаллогидраты имеют бледно-розовую
окраску, вследствие образования
комплексного иона [Mn(H2O)4
хорошо растворимы в воде, их растворы
и кристаллогидраты имеют бледно-розовую
окраску, вследствие образования
комплексного иона [Mn(H2O)4 .
Например, MnCl
.
Например, MnCl · 4H
O,
MnSO
· 4H
O,
MnSO · 4H
O
представляют собой комплексные соли
[Mn(H2O)4]SO4,
[Mn(H2O)4]Cl2.
Помимо этого, лигандами для марганца
(II)
могут быть молекулы аммиака, анионы
щавелевой, лимонной, синильной кислот.
· 4H
O
представляют собой комплексные соли
[Mn(H2O)4]SO4,
[Mn(H2O)4]Cl2.
Помимо этого, лигандами для марганца
(II)
могут быть молекулы аммиака, анионы
щавелевой, лимонной, синильной кислот.
Соответствующий оксиду марганца гидроксид, Mn(OH)2 получается как и все нерастворимые в воде гидрооксиды, косвенным путем в виде студнеобразного белого осадка, обладающего слабыми основными и поэтому растворимого в кислотах:
MnCl2 + 2NaOH = Mn(OH)2 + 2 NaCl
М
n(ОН)2
+ Н2HO4
= МnSO4
+ 2Н2O
На
воздухе Мn(ОН)2
постепенно буреет, вследствие
окисления
кислородом воздуха:
2Мп(ОН)2
+O2
+ 2H2O
=2Мn(OН)4
Соединения
М наиболее устойчивы в кислой среде
и
окисляются только энергичными
окислителями до иона MnO4
(
наиболее устойчивы в кислой среде
и
окисляются только энергичными
окислителями до иона MnO4
( Mn
Mn 4/
M
=1,51В):
2МnSО4
+ 5РbO2
+ 6НNO3
= 2НМnО2
+ Рb(NО3)2
+ 2PbSO4+H2O
Процесс
окисления сопровождается изменением
окраски
растворов от бледно-розовой
(бесцветной) до фиолетовой.
При
прокаливании соединений марганца (II)
с окислителями
в щелочной среде
получаются окрашенные в зеленый
цвет
манганаты щелочных металлов:
3МnSО4
+ 12 КОН + 2КС1O3
= 3К2МпО4
+ 2КС1 + 3К2SO4+6Н2O
При
обычной температуре в щелочной среде
катион М
неустойчив
и легко окисляется кислородом воздуха
( и другими
окислителями) до иона
МnО3
4/
M
=1,51В):
2МnSО4
+ 5РbO2
+ 6НNO3
= 2НМnО2
+ Рb(NО3)2
+ 2PbSO4+H2O
Процесс
окисления сопровождается изменением
окраски
растворов от бледно-розовой
(бесцветной) до фиолетовой.
При
прокаливании соединений марганца (II)
с окислителями
в щелочной среде
получаются окрашенные в зеленый
цвет
манганаты щелочных металлов:
3МnSО4
+ 12 КОН + 2КС1O3
= 3К2МпО4
+ 2КС1 + 3К2SO4+6Н2O
При
обычной температуре в щелочной среде
катион М
неустойчив
и легко окисляется кислородом воздуха
( и другими
окислителями) до иона
МnО3 ,
в котором марганец имеет
степень
окисления +4;
2МnС12+
4КOН
+ O2
= 2Н2МnО3
+ 4КС1
Соединения
М
,
в котором марганец имеет
степень
окисления +4;
2МnС12+
4КOН
+ O2
= 2Н2МnО3
+ 4КС1
Соединения
М Мn2О3
оксид марганца (III), представляет
собой
порошок коричнево-черного
цвета. Получается он либо
окислением
оксида марганца (II) на воздухе:
Мn2О3
оксид марганца (III), представляет
собой
порошок коричнево-черного
цвета. Получается он либо
окислением
оксида марганца (II) на воздухе:
400° 4МnО + О2 2Мn2О3
либо
прокаливанием оксида марганца (IV):
500°
4МnО2
—>2Мn2О3+O2
При
более высокой температуре (950-1100°С)
Мn2O3,
частично
теряет свои кислород и
превращается в темно-красный оксид
Мn3O4,
содержащий одновременно ионы М
и М  (2МnО
•
МnО2):
(2МnО
•
МnО2):
Mn(OH)3
- гидроксид марганца (III)
- вещество черно-
коричневого цвета,
легко переходящее в метагидроксид:
Мп(OН)3
—> МnО(ОН)
+ H2O
Очень
слабое основание, неустойчивое,
легко
диспропорционирующее:
2МпО(ОН)
+ 2НNО3
=МnО2
+ Мn(NО3)2
+ 2Н2O
Неустойчивыми
являются и соли М ,
получаемые растворением Mn2O3
и Mn3O4
в кислотах (HCl,
H2SO4
конц. и др.) и имеющие красно-фиолетовую
окраску.
При нагревании, а также при
действии воды эти соли разлагаются.
Соединения
М
,
получаемые растворением Mn2O3
и Mn3O4
в кислотах (HCl,
H2SO4
конц. и др.) и имеющие красно-фиолетовую
окраску.
При нагревании, а также при
действии воды эти соли разлагаются.
Соединения
М Среди
соединений
Среди
соединений  наиболее устойчивым является оксид
марганца (VI),
встречающийся в природе в виде минерала
пиролюзита. MnO2
– черный порошок, нерастворимый в воде,
представляет собой амфотерный оксид
со слабо выраженными основными и
кислотными свойствами. При растворении
его в кислотах образуются очень нестойкие
соли,
,
легко переходящие в соли
.
MnО2
+ 4НС1 = МnС14
+ 2 Н2O2
наиболее устойчивым является оксид
марганца (VI),
встречающийся в природе в виде минерала
пиролюзита. MnO2
– черный порошок, нерастворимый в воде,
представляет собой амфотерный оксид
со слабо выраженными основными и
кислотными свойствами. При растворении
его в кислотах образуются очень нестойкие
соли,
,
легко переходящие в соли
.
MnО2
+ 4НС1 = МnС14
+ 2 Н2O2
MnCl4 = MnCl2 + Cl2
Со
щелочами МnО2
образует манганиты - соли
ортомарганцоватистой
H4МnО4
или метамарганцоватистой
H2МnО3
кислот:
МnО2
+ Са(ОН)2
= СаМnО3↓
+ Н2О
метаманганит
Соли
обеих кислот неустойчивы и легко
гидролизуются в
водных растворах.
От кислоты Н4МnO4
и основания Мn(ОН)2
образуется,
встречающийся в природе, темно-красный
минерал
гаусманит:
Н4МnO4
+
2 Мn(ОН)2
= Мn2МnО
+ 4Н2О
ортоманганит Мn
или Мn3О4
Мn(ОН)4
- гидроксид М ,
как уже указывалось, проявляет
амфотерные
свойства, нерастворим в воде, существует
в орто-
(Мn(OН)4)
и мета - (МnО(ОН)2)
- форме. Кислотные и
основные свойства
его выражены слабо. Получается
окислением
гидроксида марганца
(II).
2 Мn(ОН)2
+ 2H2O
+ О2
= Мn(ОН)4
ортогидроксид или
Н4МnO4
- ортомарганцоватистая кислота.
2
Мп(OН)2
+ О2
= 2МnО(ОН)2
метагидроксид
или
,
как уже указывалось, проявляет
амфотерные
свойства, нерастворим в воде, существует
в орто-
(Мn(OН)4)
и мета - (МnО(ОН)2)
- форме. Кислотные и
основные свойства
его выражены слабо. Получается
окислением
гидроксида марганца
(II).
2 Мn(ОН)2
+ 2H2O
+ О2
= Мn(ОН)4
ортогидроксид или
Н4МnO4
- ортомарганцоватистая кислота.
2
Мп(OН)2
+ О2
= 2МnО(ОН)2
метагидроксид
или
H2MnO3 - метамарганцоватистая кислота Соединения М проявляют окислительно-восстановительную двойственность, т.е. и окислительные и восстановительные свойства. Так МnО2 является сильным окислителем, легко окисляет водород, углерод, SО2, НF , Н2S, хлориды и другие галогениды в присутствии сильных кислот, восстанавливаясь при этом до солей М : МnО2 + 3Н2SO4 + 2NаС1 = МnSО4 + 2NаНSO4 + С12 + 2H2O
2
МnО2
+ 2H2SO4
= 2МnSО4
+ О2
+ 2Н2O
Оксид
марганца (IV) обладает и свойствами
восстановителя:
при сплавлении его со щелочами в
присутствии
окислителя получаются
соответствующие соли марганцовистой
кислоты
– манганаты:
3 МnО2
+ КСlO3
+6 КОН = 3 К2МnО4
+ КСІ +3H2O
Манганаты
- соединения марганца (VI), растворы их
имеют
зеленую окраску. Соответствующая
им слабая марганцовистая
кислота
Н2МnО4,
существует только в водном растворе и
может
быть получена растворением
марганцовистого ангидрида МnО3,
в
воде:
МnО3
+ Н2О
= Н2МnO4
МnО - темно-красная масса с характерным
запахом. Уже при
5
С
она разлагается на МnО
и кислород:
2 МnО
= 2МnО
+ О
Растворяясь
в щелочах, МnО
,
образует манганаты.
Все соединения
марганца (VI) неустойчивы и
легко
диспропорциоиируют до ионов
М
и МnО4
- темно-красная масса с характерным
запахом. Уже при
5
С
она разлагается на МnО
и кислород:
2 МnО
= 2МnО
+ О
Растворяясь
в щелочах, МnО
,
образует манганаты.
Все соединения
марганца (VI) неустойчивы и
легко
диспропорциоиируют до ионов
М
и МnО4 .
Так, манганаты
самопроизвольно
разлагаются до солей марганцовой кислоты
-
перманганатов:
3К2МnО4
+ 2Н2O
↔ 2 КМnO4
+ МnО4
+ 4 КОН
зеленый фиолетовый
Реакция
обратима. Избыток щелочи способствует
устойчивости
манганатов, то есть
сдвигает равновесие системы влево.
Манганаты
являются сильными окислителями и
легко
восстанавливаются в щелочной
среде до МnО2 и в кислой среде
до
М
:
К2МnО4
+ Na2SO3+
Н2O
= МnО2↓
+ 2 КОН + Na2SO4
зеленый
бурый осадок
.
Так, манганаты
самопроизвольно
разлагаются до солей марганцовой кислоты
-
перманганатов:
3К2МnО4
+ 2Н2O
↔ 2 КМnO4
+ МnО4
+ 4 КОН
зеленый фиолетовый
Реакция
обратима. Избыток щелочи способствует
устойчивости
манганатов, то есть
сдвигает равновесие системы влево.
Манганаты
являются сильными окислителями и
легко
восстанавливаются в щелочной
среде до МnО2 и в кислой среде
до
М
:
К2МnО4
+ Na2SO3+
Н2O
= МnО2↓
+ 2 КОН + Na2SO4
зеленый
бурый осадок
К2МnO4 + 2Na2SO3 +2Н2SO4 = МnSО4+К2SO4 +2Na2SO4 +2Н2O зеленый бесцветный С другой стороны, они могут быть окислены до производных марганца в его высшей степени окисления +7: 2 К2МnО4 + С12 = 2КМnO4 +2КС1 зеленый фиолетовый Большинство манганатов (кроме солей щелочных металлов) нерастворимы в воде и относительно устойчивы на холоду в щелочной среде.
Соединения
M Соединений
марганца с такой степенью окисления
немного.
К ним относятся марганцовый
ангидрид. Марганцовая кислота и
ее
соли – перманганаты.
Мn2O7
-
марганцовый ангидрид - темно-бурая
маслянистая
жидкость с плотностью
2,4 г/с
,
относительно устойчивая
лишь в сухом
воздухе при низких температурах.
Получают
Мn2O7
при действии концентрированной
серной
кислоты на перманганат
калия:
2КMnO4
+ Н2SO4
= Мn2О7
+ К2SO4
+ Н2O
холодная
При нагревании
Мn2О7
взрывается с образованием МnО2
и
кислорода:
2 Мn2О7=4МnO2
+ 3О2
Благодаря
исключительно сильным окислительным
свойствам
Мn2О7
органические вещества (эфир, спирт и
др.)
при соприкосновении с ним
воспламеняются:
2Мn2O7
+ C2H5OH
= 4МnО2+
2СO2↑+3Н2O
Соединений
марганца с такой степенью окисления
немного.
К ним относятся марганцовый
ангидрид. Марганцовая кислота и
ее
соли – перманганаты.
Мn2O7
-
марганцовый ангидрид - темно-бурая
маслянистая
жидкость с плотностью
2,4 г/с
,
относительно устойчивая
лишь в сухом
воздухе при низких температурах.
Получают
Мn2O7
при действии концентрированной
серной
кислоты на перманганат
калия:
2КMnO4
+ Н2SO4
= Мn2О7
+ К2SO4
+ Н2O
холодная
При нагревании
Мn2О7
взрывается с образованием МnО2
и
кислорода:
2 Мn2О7=4МnO2
+ 3О2
Благодаря
исключительно сильным окислительным
свойствам
Мn2О7
органические вещества (эфир, спирт и
др.)
при соприкосновении с ним
воспламеняются:
2Мn2O7
+ C2H5OH
= 4МnО2+
2СO2↑+3Н2O
При
растворении марганцового ангидрида в
небольшом количестве воды смесь
разогревается и Mn
O разлагается.
разлагается.
При растворении в большом количестве воды образуется марганцевая кислота:
Mn O + H O = 2HMnO
фиолетовый
HMnO – кислота сильная, ее кажущаяся степень
Диссоциации в 0,1н растворе равна 98%. В свободном состоянии не получена, растворы ее можно довести до 20%. При дальнейшим концентрировании раствора HMnO разлагается с образованием оксида марганца (IV) и кислорода:
4HMnO = 4MnO +3O +2H O
Образуется эта кислота и при действии на соли M оксида свинца (IV) в присутствии HNO или H SO :
2MnSO +10HNO +5PbO = 2H O+2H SO +2HMnO +5Pb(NO )
бледно-розов. фиолетовая
Эта реакция используется в аналитической химии для открытия иона M .
Соли марганцовой кислоты – перманганаты, ионы их MnO4 - окрашивают растворы в фиолетовый цвет. KMnO4 – перманганат калия – практически самая важная соль марганца.
Это блестящие темные кристаллы, умеренно растворимые в воде. При нагревании выше 20 С KMnO4 разлагается с выделением кислорода:
2KMnO4=K2MnO4+MnO2+O2
Этой реакцией пользуются в лабораториях для получения кислорода. Перманганат калия (как и марганцовый ангидрид, марганцовая) – энергичный окислитель, способный восстанавливаться в зависимости от реакции (рН) среды до ионов M , Mn и оксида (или гидрооксида) M .
В кислой среде степень восстановления KMnO4 наиболее высокая – до M .
2КМnО4
+ 5Na2SO3
+3 H2SO4=2MnSO4
+ К2SO4
+5Na2SO4
+3Н2O
зеленый
слабо-розовый
или
в ионном виде: 2Мn + 6
+5S
+ 6
+5S =2М
+5S
+3 Н2O
В
нейтральной и слабощелочной среде
восстановление идет до
иона
М
:
2КМnO4
+ 3Na2SО3
+ Н2О
= 2МnО2
+ 2КОН + 3Na2SO4
фиолетовый
бурый
или 2Мn
+
3 S
+ Н2O
= 2МnО2
+ 2 О
=2М
+5S
+3 Н2O
В
нейтральной и слабощелочной среде
восстановление идет до
иона
М
:
2КМnO4
+ 3Na2SО3
+ Н2О
= 2МnО2
+ 2КОН + 3Na2SO4
фиолетовый
бурый
или 2Мn
+
3 S
+ Н2O
= 2МnО2
+ 2 О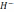 + 3S
В
щелочной среде перманганат-ион Мn
восстанавливается
до манганат-иона
Мn
:
2КМnO4
+Na2SO3
+ 2 КОН = 2К2МnO4+Na2SO4
+ Н2O
фиолетовый
зеленый
или 2Mn
+ S
+2ОН = 2 Мn
+S
+ Н2О
Ион
Мn
за способность изменять свою окраску
в
зависимости от кислотности среды
называют «химическим
хамелеоном».
В щелочной среде он превращается в
зеленый
манганат-ион Мn
:
4
КМnО4
+ 4 КОН = 4 К2МпО4+
О2
+2Н2O
фиолетовый зеленый
или
4 Мn
+ 4 О
4
= Мn
+ О2
+ 2H2O
в
кислой же среде ион Мn
: снова переходит в ион Мn
:
3К2МnO4
+ 2H2SO4
= МnО2
+ 2K2SO4+2KMnO4+2H2O
или
3 Мn
+
4
+ = МnO2
+ 2Мn
+2Н2O
зеленый
фиолетовый
+ 3S
В
щелочной среде перманганат-ион Мn
восстанавливается
до манганат-иона
Мn
:
2КМnO4
+Na2SO3
+ 2 КОН = 2К2МnO4+Na2SO4
+ Н2O
фиолетовый
зеленый
или 2Mn
+ S
+2ОН = 2 Мn
+S
+ Н2О
Ион
Мn
за способность изменять свою окраску
в
зависимости от кислотности среды
называют «химическим
хамелеоном».
В щелочной среде он превращается в
зеленый
манганат-ион Мn
:
4
КМnО4
+ 4 КОН = 4 К2МпО4+
О2
+2Н2O
фиолетовый зеленый
или
4 Мn
+ 4 О
4
= Мn
+ О2
+ 2H2O
в
кислой же среде ион Мn
: снова переходит в ион Мn
:
3К2МnO4
+ 2H2SO4
= МnО2
+ 2K2SO4+2KMnO4+2H2O
или
3 Мn
+
4
+ = МnO2
+ 2Мn
+2Н2O
зеленый
фиолетовый
Экспериментальная часть
1.Получение и свойства гидроксида марганца (II) а)пробирку с раствором сульфате марганца (II) прилить раствор гидроксида натрия. Отметить цвет образовавшегося осадка гидроксида марганца и написать уравнение протекающей реакции; б)часть жидкости с осадком перенесли в другую пробирку и взболтать. Как изменился цвет осадка? Написать уравнение реакции окисления гидроксида марганца (II) кислородом воздуха в присутствии воды до МnО (ОН)2. Полученное вещество сохранить для опыта 4а. в) оставшуюся часть, полученного в опыте а) осадка разделить в две пробирки и добавить в одну из них 2н раствор серной кислоты, в другую - избыток щелочи. В обоих ли случаях происходит растворение осадка? Написать сравнение реакции и сделать вывод о свойствах гидроксида марганца (II).
2. Получение сильфида марганца (II) К раствору сульфата марганца (II)) прилить раствор сульфида аммония. Наблюдать выпадение осадка сульфида марганца (II) и отметить его цвет. Написать уравнение реакции. Добавить к осадку 2 н раствор серной кислоты и сделать вывод о растворимости сульфида марганца (II) в кислой среде.
Написать уравнение реакции.
3. Восстановительные свойства соединений марганца (II)
Прилить раствор гидроксида натрия и перекись водорода.
Нагреть. Отменить изменение цвета осадка вследствие
образования соединения марганца (IV) Написать уравнение реакции в молекулярной и ионной формах; б) Окисление соли марганца (II) диоксидом свинца. Поместить в пробирку немного диоксида свинца и прилить к нему 2-3 мл концентрированной азотной кислоты и 2-3 капли раствора сульфата марганца (II). Нагреть до кипения. Дать раствору отстояться. Отметить его окраску и указать как изменилась степень окисления марганца. Написать уравнение реакции. 4.Окислительно-восстановительные свойства соединений марганца (IV) а) в пробирку с гидроксидом марганца (IV), полученном в опыте 1б, прилить раствор серной кислоты до кислой реакции (проба лакмусовой бумагой), а затем раствор сульфита натрия. Дать объяснение наблюдаемому явлению. Какие свойства проявляет гидроксид марганца (IV) в этой реакции? Написать уравнение реакции. б) повторить опыт 3б, взяв вместо раствора сульфата марганца (II) несколько крупинок диоксида марганца (IV) - МnО2. Отметить цвет полученного раствора. Какие свойства в этой реакции проявляет МnО2? Написать уравнение реакции. 5. Окислительные свойства соединений марганца (VII) В три пробирки налить 1-2 мл раствора пермангата калия КМnО4. В одну из них добавить такое же количество 2 н серной кислоты, в другую – воды, в третью – концентрированный раствор гидроксида калия – КОН. Во все пробирки прилить при перемешивании раствор сульфита натрия. Какие изменения наблюдаются в каждой пробирки? Объяснить происходящие явления. Написать уравнение реакций. Как влияет рН среды на характер восстановления солей марганцовой кислоты?
ПРИМЕЧАНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ 1. При выполнении дайной работы необходимо учесть, что ряд исходных и полученных в результате проведенных опытов веществ растворы едких щелочей, серной и азотной кислот соединении свинца, сульфида аммония, бромной воды, сероводорода - являются токсичными. Пары последних трех веществ ядовиты, поэтому опыты с ними нужно проводить только в вытяжном шкафу. 2. Работа с кислотами и щелочами требует большой осторожности, если случайно кислота или щелочь попали на кожу быстро смойте их сильной струей воды, а затем обработайте обожженное место раствором бикарбоната натрия NаНСО3, ( в случае ожога от кислот и брома) или 3-5% раствором уксусной кислоты ( в случае ожога от попадания щелочи).
