
Регенерацию иода (химическая очистка)
проводят купоросным методом: свободный иод переводят в иодид раствором сульфита натрия (окисление), затем прибавляют раствор медного купороса и осаждают иодид меди, затем восстанавливают оксидом железа:
I2 + Na2SO3 + H2O  2 NaI + H2SO4
2 NaI + H2SO4
2 NaI + CuSO4  Na2SO4 + CuI2
Na2SO4 + CuI2 
CuI2 + Fe2O3 + 3 H2SO 4 CuSO4 + 2 FeSO 4 + 3 H2O + I2
CuSO4 + 2 FeSO 4 + 3 H2O + I2
Кристаллы иода, осевшие на дно, отфильтровывают и отправляют на очистку. Выход иода по этому методу составляет 9095% от его общего содержания в исходном растворе.

2.3.4Примеры галогенирования в производстве лекарственных веществ и витаминов
1.Галогенирование ароматических соединений
1)Хлорирование и бромирование толуола (препарат
оксазил (амбенония хлорид) при парезах мышечной ткани, и антиаритмического средства
орнида (при гипертониях) (бромируют при 20оС):
CH3 |
|
CH3 |
|
Br2(Cl2), Fe |
Cl(Br) |
||
+ пара-изомер |
|||
20 C |
|
||
-HHal |
|
||
3Br2 + 2Fe  2FeBr3
2FeBr3

2)Бромирование о-ксилола в присутствии железа,
активированного иодом (производство витамина В2)
CH3 |
|
|
CH3 |
Br2, Fe, 0 5oC, 20 ч CH3 |
|
|
CH3 |
|||||
|
|
|
||||||||||
|
||||||||||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
или |
40oC, 2 ч |
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
90% |
|
|||
3)Бромирование мезитилена можно вести без катализатора, однако надо учитывать, что даже в присутствии железа частично бромируются метильные группы и выход ~ 40%:
|
|
|
Br |
H3C |
CH3 |
H3C |
CH3 |
|
|
Br2 |
|
|
|
CCl4 |
|
|
CH3 |
|
CH3 |
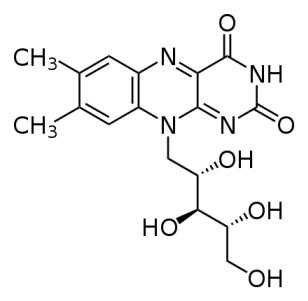
Витамин B2 –рибофлавин

4) Иодирование аминобензойных кислот
хлоридом иода или его комплексом с хлоридом калия (синтезы рентгеноконтрастных препаратов билигност (Бис-(2,4,6-трийод-3- карбоксианилид адипиновой кислоты),
триомбраст и др.). Реакцию обычно проводят в водной кислой среде при нагревании:
COOH |
|
COOH |
|
|
|
ICl/KCl, HCl, 60oC |
I |
I |
NH2 |
|
NH2 |
|
|
I |

2. |
Галогенирование |
гетероароматических |
соединений. |
|
|
Пиридин бромируется лишь в 66%-ном олеуме при 130°С или в паровой фазе при 300°С бромом на пемзе. Выход при этом составляет около 40%.
Br
|
Br2, 65% олеум |
|
N |
130°C |
N |
N |
 SO3
SO3

Хинолин бромируется в более мягких условиях. Выбор среды определяет направление замещения:
|
|
|
|
|
|
|
Br |
5 |
4 |
|
Br |
|
|
|
|
6 |
|
3 |
Br |
|
Br2 |
|
|
|
|
|
|
|
|
||
|
|
|
|
2 |
|
H2SO4 конц., |
|
7 |
|
2 |
|
CCl4, |
|
|
|
|
|
|
|
|
|
|
|
8 |
N |
|
|
пиридин |
N |
|
N |
1 |
|
|
|
AgClO4 + 8-бром-изомер |
|||
|
|
|
|
|
|||

3. Галогенирование ацидофобных пятичленных гетероциклов. Они чрезвычайно реакционноспособные и галогенируются в очень мягких условиях
|
|
I2, Mg2O |
Br2 |
, AcOH |
|
|
|
|
|
|
|
|
|
S |
I |
C6H6,0°C |
|
78% |
S |
Br |
|
X |
|||||
70% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br2 |
1 моль SO |
Cl |
2 |
|
|
|
|
2 |
|
Cl |
|
|
Br |
диоксан, |
Et O, 0°C |
|
||
O |
|
N |
||||
|
0°С |
2 |
|
|
||
80% |
|
|
|
|
H |
|
|
|
|
|
|
||
Монозамещенные могут быть получены лишь при низких температурах, в специально подобранных условиях и специфическими реагентами (хлористый сульфурил, комплекс брома с диоксаном и т.д.)
2.3.5 Синтез алифатических и жирноароматических галогенопроизводных
1. Галогенирование алканов и в боковую цепь аренов является радикальным цепным процессом (SR),
инициатором |
которого |
может |
быть |
высокая |
температура |
и |
облучение |
светом. |
|
Скорость превращения исходных веществ в |
||||
конечные и |
направление |
реакции |
гомолитического |
|
галогенирования определяет строение субстрата, т. е. стабильность радикалов, образующихся в процессе
реакции, |
и |
природа |
галогена. |
Недостатком |
|
радикально-цепного |
|
галогенирования являются низкая селективность
процесса и полигалогенирование. Для получения моногалогеналканов процесс приходится вести в
избытке углеводорода при малой степени превращения.

Устранить |
эти недостатки |
позволяют |
||
специфические |
переносчики |
галогена |
|
|
сульфурилхлорид |
(SO2Cl2), |
N-бромсукцинимид |
||
(NБС). |
|
|
|
|
1)Химизм хлорирования сульфурилхлоридом.
Вкачестве инициатора таких реакций используют химические реагенты, например, перекись бензоила :
O |
O |
|
O |
|
|
C |
C |
|
C |
O |
|
|
O O |
2 |
|
2 |
|
|
|
|
|||
|
|
|
|
|
2CO2 |
SO2Cl2 
 Cl
Cl
+ SO2Cl
.
SO2Cl + RH  R. + HCl + SO2
R. + HCl + SO2
R∙ + SO2Cl2 R−Cl + ∙SO2Cl и т. д.
