
NaHCO3
RNH2 + R'X  R'NH2R X
R'NH2R X  R'NH2R
R'NH2R
NaX
CO2
H2O
Скорость реакции алкилирования определяет нуклеофильность амина. В одинаковых условиях с увеличением рКа нуклеофильность аминов и скорость реакции увеличиваются:
−SO2NH2 < −CONH2 < ArNH2 < C5H5N < NH3 < RNH2 < R2NH
Алкилирование аммиака или алифатических аминов идет с обра-
зованием смеси соединений, т. к. введенная алкильная группа делает продукт более реакционноспособным, чем исходный амин:
|
NH |
|
NH |
RX |
|
NH3 |
RX |
|
3 |
|
3 |
|
|
||
RX |
|
RNH3X |
NH4X |
RNH2 |
R2NH2X |
NH X R2NH |
|
|
|
|
|
|
|
4 |
|
|
|
|
NH3 |
R3N RX |
R4NX |
|
|
|
|
R NHX |
|
|
|
||
|
|
3 |
NH4X |
|
|
|
|
|
|
|
|
|
|
|
Реакцию широко используют, т.к. многие лекарственные препа-
раты выпускаются в виде четвертичных аммонийных солей:
|
Et |
|
CH3I, |
|
Et |
|
|
|
|
CaCO3 |
|
|
|||
H N |
CH-CH |
NH |
I (CH3)3N |
CH-CH |
N(CH3)3 I |
||
|
|||||||
2 |
|
2 |
CH3OH |
|
|
|
|
|
Et |
|
|
Et |
|
||
|
|
|
|
парамион |
|
||
|
|
|
|
|
|
Алкилирование ароматических аминов, нуклеофильность кото-
рых в большей степени зависит от заместителей в кольце, чем у атома азота, идет селективнее, чем алкиламинов. Используя низкие температуры, избыток субстрата и другие приемы, можно получать смешан-
ные аминосоединения:
|
NH CH3 < |
CH3 |
|
NH2 |
|
|
RCl |
|
R'Cl |
|
R |
ArNH2 |
ArNH |
R |
|
ArN |
R' |
|
|
|
|
|
Алкилирование по атому азота гетероциклических соединений
широко применяется в синтезе лекарственных веществ. Алкилгалогениды легко реагируют с пиридинами, образуя N- алкилированные четвертичные соли:
91
C16H33Cl
N |
tкип, 7,5 ч, 75,7% |
N |
Cl |
|
C16H33
гексадецилпиридиний хлорид
Алкилирование амидов карбоновых и сульфоновых кислот, нуклеофильность которых очень низкая, идет намного труднее, чем аминов, но зато селективно, что позволяет синтезировать чистые первичные и вторичные амины.
Алкилирующий агент также влияет на скорость реакции. Быстрее всего реагируют аллильные, бензильные, метильные и первичные галогениды. При использовании полигалогенида можно избирательно заместить более хорошо уходящий или более активированный галоген.
Например, замещение более хорошо уходящей группы (брома) при алкилировании метилпиперазина 3-хлор-1-бромпропаном (производство нейролептика метеразина) (в среде толуола в присутствии мелкоизмельченного NaOH с азеотропной отгонкой воды и возвратом толуола).
CH3 N NH |
BrCH2CH2CH2Cl |
CH3 N N (CH2)3Cl (91%) |
толуол, t кип |
В синтезе антиаритмического препарата орнид легче замещается галоген в бензильном положении, чем арильный галоген:
CH2Br |
CH NMe |
CH NMe |
||
|
2 |
2 |
2 |
2 |
Br HNMe2,EtOH |
Br |
EtBr, EtOH Br |
Et |
Br |
tкип, 2 ч, 90% |
|
t , 6 ч, 80% |
|
|
|
|
кип |
|
|
|
|
|
орнид |
|
Условия реакции зависят от строения и свойств как субстрата, так и галогенида. Так, температура в случае алкилгалогенидов обычно около 100°С, активированные арилгалогениды реагируют примерно при 150°С. Поэтому в большинстве случаев процесс можно вести при атмосферном давлении в аппарате с обратным холодильником. Од-
нако при работе с низкокипящими веществами (CH3Cl, C2H5Cl) алкилирование ведут в автоклавах. Реагенты обычно берут в стехиометрическом соотношении.
92
N-Алкилирование галогеноспиртами и эпоксисоединениями широко применяется в синтезе противораковых препаратов. Для вве-
дения этанольного остатка в аминогруппу используют водный раствор
этиленхлоргидрина:
RNH2 + ClCH2CH2OH  RNHCH2CH2OH + HCl
RNHCH2CH2OH + HCl
O |
|
|
ClCH2CH2OH, NaOH |
O |
||||||
|
|
|
|
|
|
|
|
|
|
|
Ph C |
|
N NH |
|
Ph C |
|
N N CH2CH2OH |
||||
|
|
|
||||||||
|
|
|||||||||
Однако наряду с N-алкилированием идет и О-алкилирование. Поэтому вместо этиленхлоргидрина часто используют окись этилена, пропилена. Для получения монозамещенного производного реакцию ведут в большом избытке амина в присутствии воды. Для введения двух гидроксиэтильных остатков берут небольшой избыток окиси этилена и реакцию проводят при небольшом давлении. Температура реакции обычно ниже 100°С.
|
CH2CH2CH2COOCH3 |
O |
|
|
CH CH CH COOCH |
|||||||||||
|
|
|
|
CH2 |
|
CH2 |
|
2 |
2 |
2 |
3 |
|||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
CH3COOH, 0 5oC |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
N(CH CH OH) |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
2 |
Алкилирование диметилсульфатом используется в производстве целого ряда препаратов. Например, азафена и анальгина.
|
|
CH3 |
|
NH |
(CH3)2SO4, NaOH |
N |
|
CO |
CH3OSO3Na |
CO |
|
O |
O |
||
|
93
|
|
|
|
|
|
|
|
CH3 |
|
|
H3C |
|
|
NHSO3Na |
|
H3C |
|
|
NSO3Na |
|
|
|
|
|
|
(CH3)2SO4, NaOH |
|
|
|
|
||
|
|
|
|
|
|
|
H O, H SO |
4 |
||
H3C N |
|
|
|
|
|
|
|
2 |
2 |
|
N |
O |
107 110°C |
H3C |
N |
N |
O |
85°C |
|
||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
C6H5 |
|
|
|
C H |
|
|
|||
|
|
|
|
|
|
|
6 |
5 |
|
|
|
|
|
H3C |
NHCH |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
H3C N N 
 O C6H5
O C6H5
Механизм реакции SN2. В мягких условиях (водный раствор, низкая температура) используется лишь одна метильная группа диме-
тилсульфата. Для полного использования диметилсульфата необхо-
димо проводить алкилирование при температуре около 100°С в ще-
лочной среде.
Достоинства диметилсульфата: высокая реакционная способность, относительно дешевый и позволяет работать при повышенных температурах при атмосферном давлении. (Температура кипения метилиодида ниже 40оС). Серьезным недостатком является его высокая токсичность.
Алкилирование метиловыми эфирами аренсульфокислот (менее токсичны по сравнению с диметилсульфатом) применяют: в синтезе амидопирина − к расплавленному фенилметилпиразолону при 127−130°С приливают метиловый эфир бензолсульфокислоты. Температура не должна подниматься выше 135−140°С:
|
CH3 |
|
|
CH3 |
|
|
NH |
PhSO2OCH3 |
|
NHCH3 PhSO3 |
|
O |
130oC |
O |
|||
N |
N |
||||
|
Ph |
|
|
Ph |
метилфенилпиразолон
При получении бензамона процесс ведут при более низкой температуре, начиная алкилирование при 25−26°С и заканчивая при
70°С:
94
|
PhSO2OCH3, K2CO3 |
|
O CH2NH2 |
25 70oC |
O CH2NMe3 PhSO3 |
Алкилирование непредельными соединениями аминов и азотистых гетероциклов широко используется в синтезе лекарственных соединений.
Так, в синтезе анатруксония используют малоактивированный алкен − аллиловый спирт:
CH2 |
|
CHCH2OH |
|
|
|
||||
|
||||
NH |
|
|
|
NCH2 CH2 CH2OH |
Использование активного метилакрилата в синтезе диазолина позволяет ввести в молекулу сразу два радикала:
CH2=CHCOOCH3 CH2CH2COOCH3
CH3NH2  CH3N
CH3N
CH2CH2COOCH3
Даже слабые нуклеофилы – амиды карбоновых кислот алкилируются непредельными соединениями. Так, в синтезе
пантотената кальция фталимид алкилируют акрилонитрилом в
присутствии этилата натрия или 1%-ного спиртового раствора едкого натра:
O |
|
O |
|
NH |
CH2=CHCN |
N-CH2CH2CN |
|
EtOH, NaOH |
|||
|
|
||
O |
|
O |
В синтезе поливинилпирролидона используют ацетилен:
|
CH |
CH |
|
N |
O |
N |
O |
|
|||
|
|
|
|
H |
|
CH CH2 |
|
Метилирование первичных и вторичных аминов формальдегидом
в среде муравьиной кислоты (по Эшвайлеру − Кларку) идет с высоким выходом при температурах около 100оС. С помощью этого метода можно алкилировать многие амины, в том числе аминокислоты и гетероциклические амины.
95
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
O |
SN |
|
|
|
|
H |
|
C |
OH |
R |
|
NH |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
R |
|
N |
|
CH2 |
|
|
|
|
||||||
R |
|
NH2 |
+ H |
|
C |
H |
H2O |
|
|
CO2 |
|
|
||||||||
|
|
|
|
|
|
|||||||||||||||
|
|
|
||||||||||||||||||
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
имин |
|
|
|
|
|
||||||||
ОВР
Ароматические амины метилируются лишь при наличии орто- и пара-заместителей, препятствующих конденсации формальдегида по углеродному атому ароматического ядра.
В синтезе амидопирина метилирование аминоантипирина проводят при температуре кипения реакционной массы 100−105°С:
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
H3C |
|
|
|
|
|
HCOO |
||||
H C |
|
|
NH2 |
CH2O, |
NH |
CH3 |
|||||||||
|
|
|
|
|
|||||||||||
3 |
|
|
HCOOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C N N |
|
|
|
|
|
|
|
|
|
|||
|
N |
O |
o |
|
|
|
|
O |
|
|
|
|
|||
H3C |
N |
100 105 C |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
C6H5 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
||||||||
|
C6H5 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Амин выделяют из соли содой при 50°С. Аналогично метилируют 3-аминопропанол и 6-метилпиперидин-2-карбоновую кислоту:
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
H |
|
C |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
HOCH2CH2CH2NH2 |
|
|
|
HOCH CH CH N(CH ) |
||||||||
|
|
|
|
|
O |
2 |
2 |
2 |
|
3 2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
C |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
90 95oC |
|
|
|
|
|
|
|
|||
|
|
|
CH2O, HCOOH |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
90 95oC |
|
CH3 |
|
N |
|
COOH |
|
|
|
|
|
|
|
|
|
|||||
CH3 N COOH |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
CH3 |
|
|
|
||
H |
|||
|
|||
Алкилирование спиртами обычно применяют для алкилирования ароматических аминов. В жидкой фазе реакцию проводят в присут-
ствии минеральных кислот в автоклавах под давлением выше 3 МПа,
температуре 180−220°С и в течение до 10 ч.
Так получают диметиланилин из анилина, метилового спирта и серной кислоты. (При использовании метилиодида – 125оС, 10 атм, 10 ч).
96
|
H2SO4, |
|
|
|
|
210oC, 30 атм, 6 ч |
NaOH |
|
|
PhNH2 + MeOH |
PhNMe2 + PhNHMe2HSO4 |
PhNMe2 |
||
Na2SO4 |
||||
|
|
|
В качестве побочного продукта образуется некоторое количество соли четвертичного аммониевого основания, для разложения которого реакционную массу нагревают в автоклаве с раствором едкого натра.
Каталитическая роль кислоты заключается в том, что она протонирует спирт, образуя хорошо уходящую группу 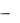 молекулу воды. Далее реакция идет по SN2-, либо по SN1-механизму. Чаще всего используют серную (до 0,3 моль) или соляную (до 1 моль) кислоты.
молекулу воды. Далее реакция идет по SN2-, либо по SN1-механизму. Чаще всего используют серную (до 0,3 моль) или соляную (до 1 моль) кислоты.
Например, алкилирование 1-фенил-2-пропанамина гидроксиаце-
тонитрилом применяют в производстве сиднофена:
|
|
|
HO |
|
CH2 |
|
CN |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
C6H5CH2 |
CH |
|
NH2 |
|
C6H5CH2 |
CH |
|
NHCH2CN |
|||
|
|
|
|||||||||
|
|
|
|
||||||||
CH3 |
|
CH3 |
|||||||||
Алкилирование простыми эфирами осуществляют пропусканием смеси паров амина и эфира при температуре 250−350°С через катализатор (Al2O3, ThO2, TiO2, ZrO2).
В качестве метилирующего средства применяют метиловый эфир:
NH2 |
|
|
|
N(CH3)2 |
||||
|
|
Al2O3 |
|
|||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
+ 2(CH3)2O |
o |
|
|
|
|
+ 2CH3OH |
|
|
|
|
|
|
|||
|
|
|||||||
|
|
230 |
95 C |
|
|
|
|
|
|
|
|
|
|
|
|
||
В промышленной установке избыток паров метилового эфира смешивают в испарителе с парами анилина. Смесь паров поступает в контактный аппарат трубчатого типа, где на 94−96% превращается в диметиланилин. После отделения метанола смесь аминов с метиловым эфиром поступает во второй контактный аппарат, после которого степень превращения анилина в диметиланилин достигает 99,5−99,6% от теоретического. Общий выход диметиланилина с учетом потерь на других стадиях производства составляет 97,6%. В качестве катализатора используется активированная окись алюминия. Катализатор работает без замены 5 лет. Этого удалось достичь благодаря применению испарителя с циркуляцией анилина при неполном его испарении. Установка производительностью 5000 т диметиланилина в год авто-
97
матизирована и обслуживается всего двумя рабочими в смену. Коррозия в производстве диметиланилина парофазным методом практически отсутствует, а потому вся аппаратура выполнена из обычной углеродистой стали.
2.6.4. О-алкилирование (получение простых эфиров)
О-алкилирование алкилгалогенидами широко применяется для по-
лучения простых эфиров. Из алкилгалогенидов часто применяют метил- и этилхлориды. Алкилирование ими ведут в автоклавах под давлением, поскольку эти вещества имеют низкую температуру кипения.
Так, метилирование гидрохинона проходит при нагревании водного раствора его натриевой соли с хлористым метилом при температуре 100°С и давлении 2 МПа:
NaO |
ONa |
2CH3Cl, 100oC, 2 МПа |
CH3O |
OCH3 |
|
NaCl |
|||||
|
|
|
|
Алкилирование фенола при получении нафтамона проводят дибромэтаном в водно-щелочной среде при кипении реакционной массы:
NaOH (водн.р-р)
C6H5OH + BrCH2CH2Br  C6H5OCH2CH2Br
C6H5OCH2CH2Br
При получении димедрола бензиловый спирт алкилируют
-диметиламиноэтилхлоридом при 80°С в щелочной среде:
Ph2CHOH |
ClCH2CH2NMe2, NaOH |
Ph2CHOCH2CH2NMe2 |
o |
||
|
80 C, 4 ч |
|
п-Хлорфеноксиуксусную кислоту получают, алкилируя п-
хлорфенол хлоруксусной кислотой в щелочной среде:
OH |
OCH2COONa |
OCH2COOH |
ClCH2COONa, NaOH |
HCl |
|
Cl |
Cl |
Cl |
В синтезе совкаина используют гетероциклический галогенид:
98
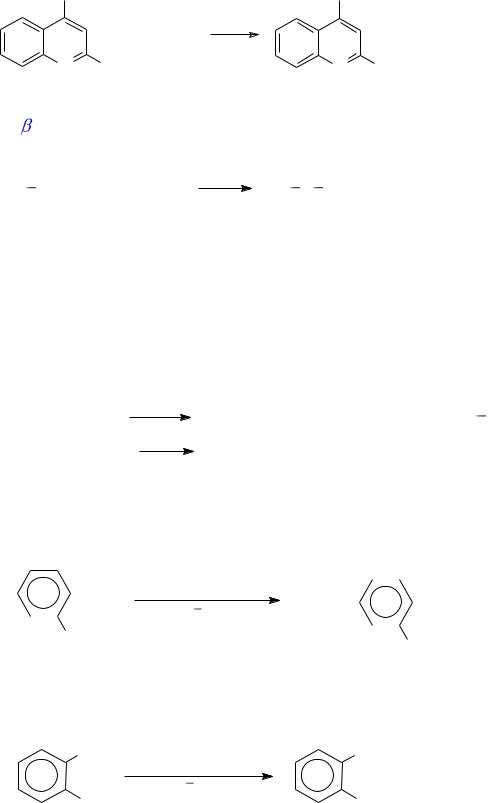
COOH |
COONa |
+ C4H9ONa |
|
N Cl |
N OC4H9 |
О-алкилирование непредельными соединениями используют при получении -этоксипропионитрила (для витамина В1). Реакцию ак-
рилонитрила с этанолом проводят в щелочной среде:
NaOH
Et OH + CH2=CHCN 50oC, 95% Et O CH2CH2CN
О-алкилирование спиртом в присутствии минеральной кислоты используется довольно редко и применяется главным образом для получения диалкиловых эфиров и алкоксипроизводных нафталинового и антраценового ряда.
О-алкилирование диметилсульфатом имеет большее практическое применение. Реакция протекает в щелочной среде в две стадии. Щелочь повышает нуклеофильность субстрата и нейтрализует выделяющуюся кислоту:
RONa + CH3OSO2OCH3 |
ROCH3 + CH3OSO2ONa |
(20 30oC) |
RONa + CH3OSO2ONa |
ROCH3 + Na2SO4 |
(~100oC) |
При метилировании неустойчивых природных соединений обычно используют лишь одну метильную группу диметилсульфата.
Метилирование о-нитро-п-крезола:
CH3 |
|
|
|
|
|
OH |
(CH3)2SO4, NaOH |
CH3 |
|
|
|
|
|
OCH3 |
|
|
|
|
|
20 90oC |
|
|
|
|
|
||||
|
|
|
|
NO2 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
NO2 |
|||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
Метилирование пирокатехина диметилсульфатом (в производстве папаверина) проводят в водном растворе NaOH при 18−20°С с последующей выдержкой при 90−92°С:
OH |
OCH3 |
|
(CH3)2SO4, NaOH |
|
20 90oC |
OH |
OCH3 |
|
вератрол |
99
2.6.5. Особенности техники безопасности при проведении процессов алкилирования
Процессы алкилирования во многих случаях проводятся при повышенном давлении в автоклавах.
Следует также иметь в виду, что проведение процессов алкилирования связано с применением и получением веществ, обладающих вы-
сокой токсичностью.
Амины являются сильными кровяными ядами, а также действуют на центральную нервную систему.
Окись этилена является наркотиком с сильной специфической ядовитостью. В организме реагирует с аминогруппами белков. При попадании окиси этилена на кожу возникают нарывы, затем наступает некроз.
Метиловый спирт является сильным нервным и сосудистым ядом с резко выраженным кумулятивным действием. Ядовитость метилового спирта связывают с образованием из него высокотоксичных формальдегида и муравьиной кислоты. При попадании в организм метиловый спирт в первую очередь поражает зрительный нерв и сетчатку глаза.
Диметилсульфат также является сильным ядом. Отравление может произойти как через легкие, так и через кожу. Оно сопровождается появлением судорог и может привести к параличу.
Формальдегид, муравьиная кислота, этиленхлоргидрин и другие вещества, использующиеся в процессах алкилирования, также обладают токсичными свойствами.
В связи с вредностью и опасностью ведения процессов алкилирования комплексная механизация и автоматизация таких процессов имеет большое значение. Правильная организация вентиляции производственных помещений и контроля за состоянием воздушной среды значительно увеличивает безопасность проведения алкилирования.
2.7. Процессы ацилирования в химической технологии биологически активных веществ
2.7.1. Общие сведения
Ацилированием называют процесс введения ацильной группы в молекулу органического соединения вместо атома водорода или иона металла. Различают С-, N- и О-ацилирование. Ацилирующими агента-
ми являются галогенангидриды кислот, ангидриды, кислоты, сложные эфиры, амиды. Ацильная группа вводится в молекулу органического вещества как с целью временной защиты лабильной группы (чаще
100
