
|
NHCOCH |
NH2 |
|
|
|
|
3 |
|
|
|
|
|
HCl |
|
|
SO NH |
SO2NH2 |
|
|
|
2 |
2 |
n-аминобензолсульфамид |
|
|
|
|
||
|
|
|
стрептоцид |
|
NHCOCH |
|
NHCOCH3 |
NH2 |
|
|
3 |
|
|
|
|
CH3COOH |
NaOH, |
|
|
|
|
|
|
|
|
|
|
H2O |
|
SO NH |
|
SO2NHCOCH3 |
SO2NHCOCH3 |
|
2 |
2 |
|
|
|
п-аминобензолсульфацетамид альбуцид
Гидролиз ацильных производных проводят при нагревании с 5−
10%-ным раствором щелочи или с разбавленными минеральными кислотами.
N-ацилирование сложными эфирами карбоновых кислот.
Эфиры карбоновых кислот − слабые ацилирующие средста, но не образуют солей с аминами, поэтому реагируют при более низких температурах, чем сами кислоты. Они используются в случае сильных нуклеофилов (гидразина, гидроксиламина) или в случае сильных карбоновых кислот, имеющих электроноакцепторные заместители в -положении (хлор-, дихлор- и другие уксусные кислоты). Например:
− в синтезе левомицетина:
|
|
|
|
|
|
|
NH2 |
Cl2CHCOOEt |
|
|
|
|
|
|
|
NHCOCHCl2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
O2N |
|
|
|
|
|
CHCHCH2OH + EtOH |
||
O2N |
|
|
|
|
|
CHCHCH2OH |
|
|
|
|
|
||||||
|
|
|
|
|
CH3OH или ДХЭ |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
OH |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
− для связывания с карбоксиметилполисахаридом антибиоти-
ков, ферментов, белков. Реакция идет при комнатной температуре:
PsOCH2COOEt2 + RNH2  PsOCH2CONHR + EtOH
PsOCH2CONHR + EtOH
где Ps полисахарид
111
N-ацилирование амидами карбоновых кислот применяют очень редко из-за малой активности ацилирующего агента. Например, амид муравьиной кислоты, который получают из окиси углерода и аммиака, применяется для формилирования аминов:
|
|
|
|
|
|
|
|
O |
|
||
C |
|
O + NH3 |
|
H |
|
C |
|
||||
|
|
|
|||||||||
|
|
|
|
||||||||
|
|
|
|
|
O |
|
|
NH2 |
O + NH3 |
||
RNH + H |
|
C |
|
|
|
RNH |
|
C |
|||
|
|
|
|
|
|||||||
|
|
|
|
||||||||
2 |
|
|
NH2 |
|
|
|
|
|
H |
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
− Мочевина − для получения N-алкилмочевины:
O |
O |
||
|
|
|
|
NH2 C NH2 + RNH2 |
NH2 C NHR + NH3 |
||
−Амиды карбоновых кислот − для ацилирования гидроксиламина
всинтезе гидроксамовых кислот и ацилирования гидразина в синтезе гидразидов карбоновых кислот:
|
|
O |
|
|
|
O |
|
|
O |
||||||||||||
|
|
|
|
|
|
|
NH2OH |
|
|
|
|
|
|
|
NH2NH2 |
|
|
||||
R |
|
C |
|
NHOH |
R |
|
C |
|
NH2 |
R |
|
C |
|
NHNH2 |
|||||||
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
NH3 |
||||||
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.7.4. Ацилирование по атому кислорода (О-ацилирование)
О-ацилирование проводят реже, чем ацилирование аминогруппы. Активность ацильных соединений изменяется так же, как и при ацилировании аминов. Условия реакции зависят от активности субстрата и ацилирующего агента.
О-ацилирование хлорангидридами кислот. Реакция галогенангид-
ридов кислот со спиртами идет необратимо, поэтому можно использо-
вать стехиометрические соотношения реагентов. Для связывания выделяющегося хлористого водорода применяют основания или ведут реакцию в таких условиях (среда, температура), когда выделяющийся хлористый водород легко удаляется из реакционной массы:
− При получении основания бенкаина применяют щелочь:
|
PhCOCl, NaOH |
O |
||
|
|
|
|
|
|
|
|
|
|
Et2NCH2CH2OH |
Et2NCH2CH2 |
C Ph |
||
− При получении бензонафтола – гидрокарбонат натрия:
112
OH PhCOCl, NaHCO3 |
O |
|
|
O C |
Ph |
||
45 110oC |
− При получении метамизила – триэтиламин:
CH3 |
Cl |
Et3N, толуол, |
|
|
CH3 O Cl |
||
|
|||||||
Et NCHCH OH + Ph2C COCl |
Et2NCHCH2OC CPh2 |
||||||
|
|
||||||
2 |
2 |
( |
2) (+2)°С |
|
|
|
|
|
|
|
|
|
|||
В ряде случаев гидроксисоединения ацилируют смесью кислоты и треххлористого фосфора (PCl3) или хлорокиси фосфора (POCl3). Ве-
роятно, реакция протекает через стадию образования хлорангидрида
кислоты (салола):
OH |
COOH |
H3PO3,HCl |
COOPh |
|
|
||
|
|
|
|
+ |
+ PCl3 |
|
|
OH |
OH |
|
|
|
салол |
О-ацилирование ангидридами кислот. Ангидриды карбоновых ки-
слот − активные ацилирующие вещества, реакция со спиртами необ-
ратима, можно использовать стехиометрические количества. Одна-
ко они дорогие и в реакции используется только половина молекулы, поэтому широко применяется, в основном, уксусный и фталевый ан-
гидриды.
Ацилирование уксусным ангидридом в водных щелочных растворах проводят при температуре до 60°С, так как на холоду уксусный ангидрид реагирует с гидроксисоединениями значительно быстрее, чем с водой. В среде же уксусной кислоты или в неводных растворителях ацилирование обычно ведут при температуре кипения реакционной массы.
Так, ацилированием салициловой кислоты уксусным ангидридом получают ацетилсалициловую кислоту:
OH |
|
O Ac |
|
Ac2O |
|
COOH |
AcOH |
COOH |
аспирин |
113

Для ускорения ацилирования уксусным ангидридом в ряде случа-
ев реакцию ведут в смеси уксусной и серной кислот или в среде пиридина (ацетопропилацетат):
O |
Ac2O, C6H5N |
|
O |
|||||
|
|
|
|
|
|
|
||
CH3 C CH2CH2CH2OH |
CH3 |
C CH2CH2CH2OAc |
||||||
AcOH |
||||||||
|
|
|
|
|
|
|
||
О-ацилирование карбоновыми кислотами (реакция этерифика-
ции). Карбоновые кислоты значительно менее активные реагенты, чем ангидриды, к тому же их реакция со спиртами обратимая, однако это наиболее дешевый и доступный реагент. Реакцию этерификации обычно ведут в присутствии минеральных кислот. Чаще других для активации ацилирующего агента используют серную кислоту (напри-
мер, в синтезе биотина).
COOH |
O |
CH3OH, H2SO4 |
COOCH3 O |
|||||||
|
|
|
|
|
|
|
|
CH |
NH C Ph |
|
CH NH C Ph |
|
|||||||||
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
S CH2COOCH3 |
|
|
|
|
CH COOH |
|
CH |
||||
CH S |
|
|||||||||
|
2 |
|||||||||
2 |
|
|
2 |
|
|
|
|
|||
Значительно реже используют другие кислоты (соляную, фосфорную).
О-ацилирование сложными эфирами (реакция переэтерификации)
проводят в жестких условиях (повышенная температура, катализатор),
т. к. сложные эфиры мало активные ацилирующие средства. Напри-
мер, в синтезе мепротана для О-ацилирования используют переэтерификацию метилуретана (сложный эфир):
O |
O |
O |
||||||
|
|
|
|
|
|
|
|
|
CH3OH + Cl C Cl |
Cl C OCH3 + NH3 |
CH3O C NH2 |
||||||
CH3 CH2OH |
O |
|
CH3 CH2OCONH2 |
||
|
AlCl |
||||
C |
+ 2CH O C NH |
C |
|||
135 155oC |
|||||
Pr |
3 |
2 |
Pr CH2OCONH2 |
||
CH2OH |
|
|
|||
Реакцию проводят под вакуумом, выделяющийся метанол отгоняют.
114
2.7.5. Особенности техники безопасности при проведении процессов ацилирования
Многие вещества, использующиеся при проведении процессов ацилирования, являются токсичными, а также взрыво- и пожароопасными.
Хлорокись фосфора, хлориды фосфора и алюминия разлагаются водой с выделением хлористого водорода. Попадание воды в аппарат, где проводятся процессы с применением этих веществ, может вызвать выброс реакционной массы. Эти соединения хранят и транспортируют в герметичной таре.
При проведении фосгенирования необходимо иметь в виду, что фосген в 3,5 раза тяжелее воздуха. Поэтому в случае утечки он может заполнять низкие места в помещении и довольно долго держаться там, создавая опасность отравления людей, находящихся в помещении. Необходима полная герметичность оборудования в технологическом процессе.
Во всех производственных помещениях необходимо иметь аварийную аммиачную систему для нейтрализации газообразного фосгена. Острые отравления обычно наблюдаются в случае нарушения работающими требований техники безопасности. Отравление может наступить в результате загрязнений тела токсичными веществами при чистке аппаратуры и коммуникаций без достаточных мер предосторожности, при выгрузке и упаковке в тару, а также при нарушении герметичности аппаратуры.
В связи с вредностью и опасностью ведения процессов алкилирования и ацилирования комплексная механизация и автоматизация этих производств имеет первостепенное значение.
2.8. Методы восстановления в химической технологии биологически активных веществ
2.8.1. Общие сведения
Восстановлением называют процесс, в результате которого атом или группа атомов приобретают электроны. Процесс, обратный восстановлению, – окисление.
В окислительно-восстановительных реакциях наряду с перераспределением электронного облака молекулы, обычно изменяется и ее состав. Например, при восстановлении двойной связи молекула при-
обретает два атома водорода:
115
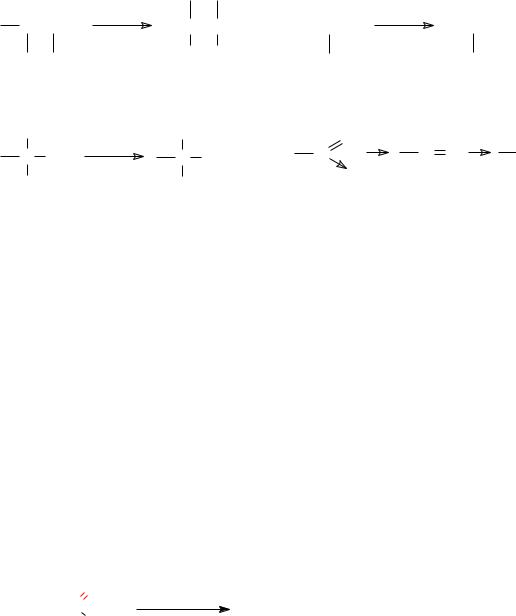
H
|
|
|
|
|
|
|
|
|
|
или |
|
|
|
|
|
|
|
|
|
C |
|
C |
|
|
|
C |
|
C |
|
|
C |
|
O |
|
C |
|
OH |
||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
H H
А при восстановлении спиртов или нитросоединений молекула
теряет атомы кислорода:
H |
H |
O |
|
|
|
|
|
C OH |
C H или N |
N O |
NH2 |
H |
H |
O |
|
|
|
Методы восстановления и окисления можно разделить на четыре группы: химические, каталитические, электролитические и биохими-
ческие (микробиологические). Все эти методы находят широкое применение в фармацевтической промышленности.
2.8.2. Химические методы восстановления
Химические методы восстановления можно разделить на несколько групп по типу восстановителя.
1) Восстановление металлами и солями металлов
а) Восстановление натрием −Восстановление натрием в спирте (по Буво − Блану) применя-
ется для восстановления сложных эфиров карбоновых кислот до со-
ответствующих спиртов. Наибольшее значение метод имеет в синтезе высших алифатических спиртов, получить которые другим путем трудно. У многоосновных кислот восстанавливаются только этери-
фицированные карбоксильные группы.
Суммарное уравнение реакции имеет вид
|
|
|
O |
Na, C2H5OH |
|
|
|
|
R |
|
C |
|
R |
|
CH2OH |
+ C2H5ONa |
|
|
OC2H5 |
|
|
|||||
|
|
|
|
|
|
|
|
Механизм восстановления можно представить следующим образом:
116

R |
|
C |
O |
|
2 Na |
|
|
|
|
|
ONa |
|
|
|
C2H5OH |
|
ONa |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
OCH2CH3 |
|
|
R |
|
|
C Na |
|
|
|
R |
|
CH |
C2H5ONa |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2H5ONa |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
OCH CH |
OCH2CH3 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
3 |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
O |
2 Na |
|
|
ONa |
|
C2H5OH |
|
|
C2H5OH |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
R |
|
C |
H |
|
R |
|
C |
|
|
Na |
|
|
|
|
|
|
R CH2 |
|
ONa |
R CH2 OH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2H5ONa |
|
|
C2H5ONa |
|||
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Выход целевых продуктов, как правило, не превышает 80%. Потери обусловлены непосредственной реакцией между натрием и спиртом. Выделяющийся водород не восстанавливает сложноэфирную группу.
Методика восстановления по Буво и Блану простая, но опасная. К кипящей смеси сложного эфира и пятикратного количества абсолютного спирта порциями добавляют кусочки металлического натрия, взятого в небольшом избытке. После загрузки всего натрия и необходимой выдержки, реакционную массу выливают в воду для разложения образовавшихся алкоголятов. Спирт отгоняют, а продукты реакции извлекают экстракцией.
Тепловой эффект реакции 520 кДж/моль. Необходимо обязательно использовать эффективный обратный холодильник. Чтобы облегчить задачу охлаждения реакционной массы и снизить опасность процесса, можно поднять температуру процесса заменой этилового спир-
та высококипящими спиртами. Так, восстановление диэтилового эфира себациновой кислоты проводят в 1-бутаноле.
O |
O |
Na, C4H9OH |
|
|
|
|
|
||
C(CH2)8 |
|
C |
|
HOCH |
|
(CH ) |
|
CH OH |
|
|
|
o |
|
|
|||||
|
|
|
|
||||||
|
|
|
|
2 |
2 8 |
2 |
|||
C2H5O |
OC2H5 100 125 C |
|
|
|
|
|
|||
Диэтиловый эфир себациновой кислоты растворяют в безводном бутиловом спирте, затем при 70°С и энергичном перемешивании в несколько приемов добавляют натрий. Температуру поднимают до 100−125°С. Выход продукта 72%.
Для снижения опасности восстановления этилового эфира дифенилпропионовой кислоты в производстве дифрила порядок загрузки реагентов обратный, а именно спиртовой раствор эфира прибавляют к натрию:
117
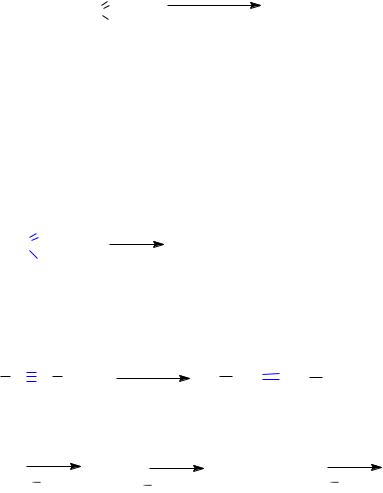
|
O |
Na, C2H5OH |
|
(C6H5)2CHCH2C |
(C6H5)2CHCH2CH2OH |
||
|
|||
OC2H5 |
|
||
|
|
Это позволяет полностью использовать металлический натрий, который при стандартном способе может частично не прореагировать и остаться в реакционной массе, что создает опасность при разбавлении реакционной массы водой.
− Восстановление натрием в жидком аммиаке применяется для восстановления:
сложных эфиров до спиртов:
R |
|
C |
O |
Na, NH3 |
|
|
OC2H5 |
RCH2OH + NaNH2 |
+ C2H5ONa |
||
|
|||||
|
|
|
|
|
алкинов до алкенов (при этом тройная связь на конце цепи не восстанавливается):
R C C R' |
Na, NH3 |
R CH CH R' |
+ NaNH2 |
|
органических галогенидов, которое идет в двух направлениях:
|
2Na |
|
NH3 |
|
RX |
|
RX |
RNa |
RH + NaNH2 |
RNH2 |
|||
|
|
|||||
|
NaX |
|
NaNH2 |
|
NaX |
Механизм аналогичен механизму восстановления по Буво−Блану. Щелочные металлы (калий, натрий и литий) хорошо растворяются в аммиаке и позволяют работать в широком интервале концентраций.
Низкая степень диссоциации аммиака делает возможным восстановление соединений, которые гидролизуются в воде. Для ведения про-
цесса необходима специальная аппаратура, т. к. температура кипе-
ния аммиака очень низка (−33,5°С). При более высокой температуре реакцию проводят в автоклаве. Для достижения гомогенности смеси необходимо энергичное перемешивание.
− Восстановление амальгамой натрия (раствором натрия в ртути).
Амальгама натрия − раствор натрия в ртути. Амальгама, содержащая меньше 1,25% натрия, при комнатной температуре жидкая. При более высокой концентрации натрия амальгама при комнатной температуре становится твердой и ее можно измельчать механически.
118
Амальгамой натрия восстанавливают:
сопряженные двойные связи (но не изолированные)
CH=CH CH=CH |
NaHgX |
CH=CH CH2 |
CH2 |
|
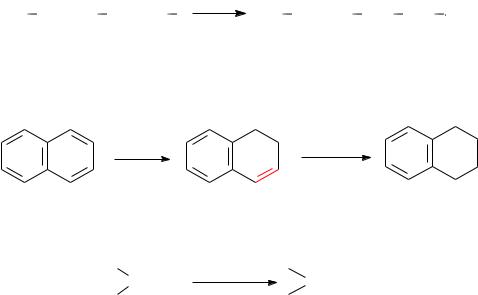
некоторые представители аренов, например фталевые кислоты, аро-
матические полициклические углеводороды (до диили тетрагидропроизводных):
NaHg |
NaHgX |
X |
|
карбонильную группу в альдегидах и кетонах до соответствующих спиртов (очень легко):
C = O |
NaHgX |
CHOH |
|
нитро- и другие азотсодержащие группы (очень легко), но практического значения этот метод не получил вследствие наличия более доступных восстановителей.
Методика восстановления: субстрат растворяют или суспендируют в спирте или воде, т. к. амальгама натрия реагирует с водой медленно. Для ускорения реакции в некоторых случаях применяют органические растворители, смешивающиеся с водой и спиртом, для лучшего растворения субстрата, или эмульгирующие средства. К смеси постепенно добавляют избыток амальгамы (25−40% от теоретического). После полного разложения амальгамы выделившую ртуть отделяют декантацией и промывают водой или спиртом.
Скорость, а иногда и состав продуктов восстановления зависят от величины рН, которая по ходу реакции повышается, при этом скорость реакции замедляется. Точный и непрерывный контроль значения рН осуществляют потенциометрически. Величину рН регулируют пропусканием СО2.
б) Восстановление оловом и хлоридом олова (II)
Восстановление оловом применяют для превращения ароматиче-
ских нитросоединений (нитрозосоединений и алкилгидроксиламинов) в амины, которые находят широкое применение в качестве промежуточных соединений при синтезе фармацевтических препаратов. Вос-
119
становление протекает ступенчато через ряд промежуточных соединений:
R NO2 |
R NO |
R NHOH |
R NH2 |
Уравнение реакции:
RNO2 + 3Sn + 6HCl  RNH2 + 3SnCl2 + 2H2O
RNH2 + 3SnCl2 + 2H2O
Образующийся первоначально хлорид олова (II) может взаимодействовать с нитросоединениями также в качестве восстановителя:
RNO2 + 3SnCl2 + 6HCl |
RNH2 + 3SnCl4 + 2H2O |
Восстановление хлоридом олова (II) позволяет оказать более силь-
ное и специфическое восстанавливающее действие и часто дает лучшие результаты, чем восстановление металлическим оловом.
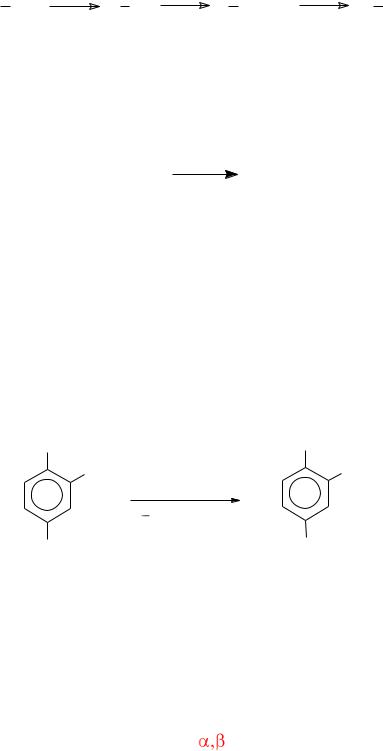
Хлорид олова (II) восстанавливает нитро- и азосоединения до аминов, соли диазония до арилгидразина, избирательно восстанавливает нитрогруппы в полинитро-, гетероциклических и галогеннитросоединениях.
Так, в 2,4-динитротолуоле хлорид олова восстанавливает нитрогруппу в положении 2, практически не затрагивая нитрогруппу в положении 4.
CH |
CH3 |
3 |
|
NO2 |
NH2 |
|
3SnCl2,6HCl |
|
3SnCl4,2H2O |
NO |
NO2 |
2 |
|
Метод позволяет вести восстановление в гомогенной среде, т. к. хлорид олова растворяется в воде и в этиловом спирте. Благодаря этому восстановление идет быстро, с хорошими выходами и при низких температурах, хотя реакцию можно вести и при температуре кипения.
в) Восстановление цинком
Цинк в кислой среде восстанавливает: карбонильные соединения
до спиртов, |
двойную |
связь в |
-ненасыщенных |
карбонильных |
соединениях, |
однако |
практическое значение |
имеет лишь |
|
120
