
- •Часть III. Термохимия и ионные равновесия
- •1.2. Кислотность водных растворов кислот и оснований.
- •1.3. Сила кислот и оснований в водных растворах.
- •1.4. Буферные растворы.
- •1.5. Фотоколориметрический метод анализа.
- •2. Определение термодинамической константы кислотной диссоциации одноцветного индикатора
- •1. Теоретическая часть
- •1.2. Первое начало термодинамики.
- •1.3. Теплоемкость, зависимость ее от температуры, изобарная, изохорная теплоемкости, соотношение между ними.
- •1.4. Теплота растворения, разведения, нейтрализации.
- •2. Определение теплот процессов
- •3. Определение теплоты нейтрализации сильной кислоты
2. Определение теплот процессов
Теплоты самых различных процессов могут быть определены на опыте при помощи установки, называемой калориметром. Установка представляет собой сосуд, помещенный в теплоизолирующую оболочку. В простейшем случае сосуд это стакан, снабженный мешалкой и термометром. В результате протекания процесса и, следовательно, выделения или поглощения тепла, температура в сосуде изменяется. Если пренебречь изменением теплоемкости в результате этого, как правило, небольшого изменения температуры, можно записать:
![]() ,
,
где
![]()
теплоемкость калориметра. В зависимости
от того в открытом или закрытом сосуде
проводится процесс, это должна быть
либо
,
либо
,
соответственно (для процесса, проводимого
в жидкой фазе разницей между
и
можно пренебречь);
теплоемкость калориметра. В зависимости
от того в открытом или закрытом сосуде
проводится процесс, это должна быть
либо
,
либо
,
соответственно (для процесса, проводимого
в жидкой фазе разницей между
и
можно пренебречь); ![]()
тепловой эффект процесса (
тепловой эффект процесса (![]() или
или
![]() соответственно);
соответственно);
![]()
изменение температуры в ходе протекания
процесса. Если процесс проводится в
открытом сосуде при постоянном давлении,
тогда тепловой эффект процесса расходуется
на изменение энтальпии и равен произведению
теплоемкости калориметра на изменение
его температуры:
изменение температуры в ходе протекания
процесса. Если процесс проводится в
открытом сосуде при постоянном давлении,
тогда тепловой эффект процесса расходуется
на изменение энтальпии и равен произведению
теплоемкости калориметра на изменение
его температуры:
![]()
Таким образом, определение теплового эффекта сводится к определению теплоемкости калориметрической установки и величины изменения ее температуры в ходе протекания изучаемого процесса ( ).
Теплоемкость калориметра, то есть количество теплоты, требуемое для нагревания его на 1 градус, может быть вычислена с использованием табличных величин удельной теплоемкости материалов, входящих в калориметрическую установку:
![]()
где
![]() и
и
![]()
массы и объемы отдельных частей
калориметрической установки (стакана,
мешалки, термометра, реакционной массы
и т.д.). Величины удельных теплоемкостей
массы и объемы отдельных частей
калориметрической установки (стакана,
мешалки, термометра, реакционной массы
и т.д.). Величины удельных теплоемкостей
![]() должны быть взяты в соответствующих
единицах измерения, например в [Дж/г
град] или [Дж/см3
град].
должны быть взяты в соответствующих
единицах измерения, например в [Дж/г
град] или [Дж/см3
град].
Более
точно значение теплоемкости может быть
получено путем его определения. Для
этого в калориметрическую установку
помещают точно известное количество
воды и опускают в нее электронагреватель
из нихромовой проволочки. Через
нагреватель в течение определенного
времени
![]() пропускают ток с известным напряжением
пропускают ток с известным напряжением
![]() и силой тока
и силой тока
![]() .
При этом нагреватель выделяет строго
определенное количество тепла:
.
При этом нагреватель выделяет строго
определенное количество тепла: ![]() . Поскольку
. Поскольку
![]() ,
то определив величину
(см. далее) можно вычислить теплоемкость
калориметрической системы, включающей
воду и нихромовый нагреватель.
Теплоемкостью нагревателя обычно
пренебрегают, поэтому теплоемкость
калориметра получают вычитанием из
полученной величины теплоемкости воды.
,
то определив величину
(см. далее) можно вычислить теплоемкость
калориметрической системы, включающей
воду и нихромовый нагреватель.
Теплоемкостью нагревателя обычно
пренебрегают, поэтому теплоемкость
калориметра получают вычитанием из
полученной величины теплоемкости воды.
Изменение температуры калориметра в результате протекания изучаемого процесса ( ) определяют графическим путем, строя график зависимости относительной температуры калориметра от времени. Относительную температуру определяют с помощью термометра Бекмана, шкала которого разбита только на пять градусов, а цена одного деления составляет 0.02 градуса. Отличительной особенностью термометра Бекмана является наличие дополнительного резервуара со ртутью, из которого ртуть можно добавлять в основной баллон если уровень ртути до начала опыта находится ниже 0.00 градуса и в который можно переместить ртуть из основного баллона если уровень ртути находится выше ~3.5-4.0 градусов. Поскольку точность определения относительной температуры составляет половину деления шкалы, величина может быть определена с точностью до 0.01 градуса. Весь график зависимости относительной температуры от времени можно разбить на три отдельных периода (см. рис.1). Первый, предварительный период характеризуется слабым увеличением температуры за счет работы мешалки и перехода механической энергии в тепловую. Второй период основной. В течение этого периода происходит выделение или поглощение тепла за счет протекания процесса. В заключительном периоде происходит слабое увеличение или уменьшение температуры из-за теплообмена с окружающей средой. Оба эти случая приведены на рисунке.
Определение величины графическим способом проводится путем нахождения середины основного периода, восстановления через нее перпендикуляра и экстраполирования зависимостей температуры от времени в предварительном и заключительном периодах до пересечения с перпендикуляром.
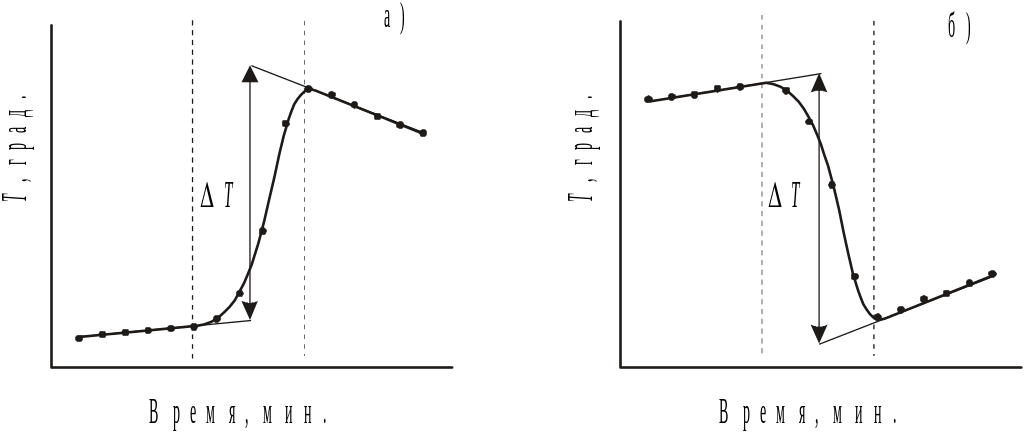
Рис.1. Изменение относительной температуры калориметра со временем при протекании процесса с выделением (а) и с поглощением (б) тепла.
Таким образом, полагается, что в первой половине основного периода происходит дополнительное нагревание калориметра за счет работы мешалки, а во второй половине изменение температуры за счет теплообмена калориметра со средой. Указанным на рисунке способом эти дополнительные эффекты учитываются, и полученная величина соответствует только тепловому эффекту процесса. Описанным способом можно определять теплоты нейтрализации, растворения, разведения, различных реакций, протекающих в жидкой фазе.
Измерения при постоянном объеме проводят при определении теплот процессов, протекающих с участием газообразной фазы или с образованием газообразных продуктов, например теплот сгорания. В этом случае реакционный сосуд представляет собой герметически закрывающийся автоклав, называемый калориметрической бомбой, помещенный в стакан с водой. В сосуд помещают навеску исследуемого вещества и накачивают кислород до давления около 3000 кПа. С помощью нихромовой спира-ли, через которую пропускают ток, навеску поджигают и в результате ее сгорания температура воды, окружающей калориметрическую бомбу возрастает на величину . Эту величину определяют как описано ранее и вычисляют теплоту сгорания при постоянном объеме:
![]()
Теплоту
сгорания исследуемой навески при
постоянном давлении вычисляют, используя
соотношение между ![]() и
и ![]() :
:
![]()
где
![]()
изменение количества молей газообразных
продуктов в результате сгорания вещества.
Так, например, в случае сгорания жидкого
нитробензола
изменение количества молей газообразных
продуктов в результате сгорания вещества.
Так, например, в случае сгорания жидкого
нитробензола
![]()
Разделив
полученную величину на число молей
вещества в исследуемой навеске вычисляют
мольную теплоту сгорания нитробензола
![]() .
.
