
- •Часть III. Термохимия и ионные равновесия
- •1.2. Кислотность водных растворов кислот и оснований.
- •1.3. Сила кислот и оснований в водных растворах.
- •1.4. Буферные растворы.
- •1.5. Фотоколориметрический метод анализа.
- •2. Определение термодинамической константы кислотной диссоциации одноцветного индикатора
- •1. Теоретическая часть
- •1.2. Первое начало термодинамики.
- •1.3. Теплоемкость, зависимость ее от температуры, изобарная, изохорная теплоемкости, соотношение между ними.
- •1.4. Теплота растворения, разведения, нейтрализации.
- •2. Определение теплот процессов
- •3. Определение теплоты нейтрализации сильной кислоты
1.3. Теплоемкость, зависимость ее от температуры, изобарная, изохорная теплоемкости, соотношение между ними.
Теплоемкостью системы называется количество теплоты, необходимое для нагревания ее на 1 градус. Теплоемкость обозначается буквой С и измеряется в [Дж/град].
Удельной теплоемкостью вещества называется количество теплоты, необходимое для нагревания единицы количества вещества на 1 градус.
В зависимости от единицы измерения количества вещества удельная теплоемкость измеряется в [Дж/кгград], [Дж/см3град], [Дж/мольград] и т.д. и обозначает количество тепла, необходимое для нагревания на 1 градус одного кг, одного см3 или одного моля вещества. В последнем случае теплоемкость называется мольной.
Удельная теплоемкость зависит от физико-химических свойств вещества (разные вещества имеют разную теплоемкость), от температуры (теплоемкость с температурой растет), от агрегатного состояния вещества (жидкая и газообразная формы вещества имеют разную теплоемкость даже при одной и той же температуре), а для газов и от способа нагревания (при постоянном давлении или при постоянном объеме).
Различают истинную и среднюю теплоемкость. Истинная теплоемкость определяется выражением
![]()
и представляет собой теплоемкость при данной температуре. Средней мольной теплоемкостью в интервале температур от T1 до T2 называют отношение количества тепла, необходимого для нагревания 1 моля вещества от температуры T1 до T2 , к разности температур:
![]() .
.
Если нагревание проводится при постоянном давлении, теплоемкость называется изобарной:
![]() .
.
Соответственно, изохорная теплоемкость:
![]() .
.
Из
сопоставления выражений для ![]() и
и ![]() следует:
следует:
![]() .
.
Для
жидкостей и твердых веществ изменение
объема ![]() при нагревании 1 моля вещества на 1 градус
очень мало, поэтому с точностью до
нескольких процентов величины CP
и CV
можно считать равными друг другу:
при нагревании 1 моля вещества на 1 градус
очень мало, поэтому с точностью до
нескольких процентов величины CP
и CV
можно считать равными друг другу: ![]() .
Для газов изменением объема при нагревании
пренебречь нельзя и разница между
изобарной и изохорной теплоемкостью
оказывается достаточно большой. Если
считать газ идеальным, то для одного
моля выполняется соотношение PV
= RT
. Отсюда
.
Для газов изменением объема при нагревании
пренебречь нельзя и разница между
изобарной и изохорной теплоемкостью
оказывается достаточно большой. Если
считать газ идеальным, то для одного
моля выполняется соотношение PV
= RT
. Отсюда
![]() .
.
Следовательно,
для газов ![]() 8.31 Дж/мольград.
Изобарная теплоемкость больше изохорной
на величину R
, то есть на величину работы расширения
1 моля идеального газа при нагревании
его на 1 градус.
8.31 Дж/мольград.
Изобарная теплоемкость больше изохорной
на величину R
, то есть на величину работы расширения
1 моля идеального газа при нагревании
его на 1 градус.
Зависимость теплоемкости от температуры выражается эмпирическими уравнениями:
![]() и
и
![]() .
.
соответственно для органических и неорганических веществ. Здесь a, b, c и с' константы, приведенные в справочнике.
1.4. Теплота растворения, разведения, нейтрализации.
Мольная теплота растворения вещества это теплота, которая выделяется или поглощается при растворении 1 моля вещества в каком-либо растворителе (чаще всего в воде). Растворение электролитов (солей, кислот, оснований) в воде сопровождается тепловым эффектом вследствие того, что при этом происходит разрушение кристаллической решетки (для твердых веществ) или диссоциация молекул (для жидкостей), на что затрачивается энергия. Теплота при этом поглощается и H(дисс.) > 0. Гидратация образующихся ионов приводит к выделению тепла (H(гидр.) < 0). Например:

Суммарный тепловой эффект является суммой этих теплот и зависит от соотношения их величин и может быть как положительной, так и отрицательной:
![]()
Величина
теплового эффекта растворения одного
моля вещества зависит от его
физико-химических свойств (серная
кислота, например, растворяется с
выделением тепла, а тиосульфат натрия
с поглощением) и от концентрации
образующегося раствора. Чем разбавленнее
образующийся раствор, тем больше тепловой
эффект растворения и наоборот. В
справочниках приводятся стандартные
(для 298 К) значения мольных интегральных
теплот растворения ![]() [Дж/моль] для различных веществ и различных
моляльных концентраций (m)
образующихся растворов. Для вычисления
тепловых эффектов растворения определяют
число молей вещества (n,
молей) в заданном его количестве и
моляльную концентрацию образующегося
раствора (m,
молей/кг воды). По величине m
в справочнике находят интегральную
мольную теплоту растворения
.
Теплоту растворения данного количества
вещества в заданном количестве воды
находят умножением мольной теплоты
растворения на количество молей вещества:
[Дж/моль] для различных веществ и различных
моляльных концентраций (m)
образующихся растворов. Для вычисления
тепловых эффектов растворения определяют
число молей вещества (n,
молей) в заданном его количестве и
моляльную концентрацию образующегося
раствора (m,
молей/кг воды). По величине m
в справочнике находят интегральную
мольную теплоту растворения
.
Теплоту растворения данного количества
вещества в заданном количестве воды
находят умножением мольной теплоты
растворения на количество молей вещества:
![]() .
.
Мольная теплота разведения раствора вещества водой от концентрации m1 до концентрации m2 может быть найдена из теплот растворения. Представим, что один моль вещества растворяют в воде с образованием разбавленного раствора с концентрацией m2 двумя путями непосредственно добавлением воды (путь 1), а также с предварительным получением более концентрированного раствора с концентрацией m1 и последующим его разбавлением до концентрации m2 (путь 2):

Из закона Гесса следует
![]()
откуда
![]()
При разбавлении раствора, содержащего n молей вещества, выделяется или поглощается в n раз больше тепла:
![]() .
.
Теплота нейтрализации кислоты это теплота реакции взаимодействия одного ее грамм-эквивалента с основанием. Сильные кислоты и сильные основания нацело диссоциируют в воде с образованием соответствующих гидратированных ионов, поэтому теплота нейтрализации сильной кислоты это теплота образования одного моля воды из гидратированных гидроксид- и гидроксоний-ионов:
![]()
По
этой причине вне зависимости от природы
сильной кислоты и сильного основания
теплота нейтрализации одного ее
грамм-эквивалента составляет ![]() кДж/г-экв.
кДж/г-экв.
В случае слабой кислоты нейтрализация включает 2 стадии диссоциацию кислоты с образованием гидратированных ионов и последующее взаимодействие катиона гидроксония с гидроксид-анионом. Например, нейтрализация синильной кислоты:
![]()
протекает следующим образом:
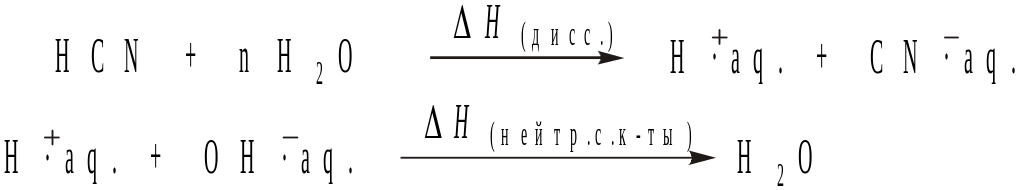
В соответствии с этим теплота нейтрализации слабой кислоты включает в себя теплоту диссоциации:
![]()
и
поэтому может быть больше или меньше
чем ![]() кДж/г-экв.
кДж/г-экв.
