- •Часть III. Термохимия и ионные равновесия
- •1.2. Кислотность водных растворов кислот и оснований.
- •1.3. Сила кислот и оснований в водных растворах.
- •1.4. Буферные растворы.
- •1.5. Фотоколориметрический метод анализа.
- •2. Определение термодинамической константы кислотной диссоциации одноцветного индикатора
- •1. Теоретическая часть
- •1.2. Первое начало термодинамики.
- •1.3. Теплоемкость, зависимость ее от температуры, изобарная, изохорная теплоемкости, соотношение между ними.
- •1.4. Теплота растворения, разведения, нейтрализации.
- •2. Определение теплот процессов
- •3. Определение теплоты нейтрализации сильной кислоты
1.5. Фотоколориметрический метод анализа.
Фотоколориметрическим называется метод анализа, основанный на измерении поглощения света веществом. В самом общем виде энергия одной молекулы за вычетом кинетической энергии ее поступательного движения складывается из вращательной энергии молекулы, колебательной энергии составляющих ее атомов, энергии электронов, входящих в электронные оболочки атомов и энергии, заключенной в ядрах атомов:
ε = εвращат. + εколеб. + εэлектр. + εядер .
Взаимодействие квантов электромагнитного излучения с молекулами вещества приводит к изменению их энергетического состояния (энергия ядер при этом остается постоянной и поэтому Δεядер = 0):
Δε = Δεвращат. + Δεколеб. + Δεэлектр..
Изменение энергии одного моля таких молекул в NA = 6.021023 раз больше и также является суммой:
ΔE = Δε ·NA = ΔEвращат. + ΔEколеб. + ΔEэлектр. .
Вращательные уровни энергии молекул расположены достаточно близко друг к другу, поэтому величина ΔEвращат. мала и составляет менее ~0.5 кДж/моль. Величины ΔEколеб. и ΔEэлектр. значительно больше и составляют ~6 8 кДж/моль и ~120 800 кДж/моль, соответственно.
Поглощение энергии квантов микроволнового излучения с длиной волны более ~300000 нм и энергией не более ~0.5 кДж/моль увеличивает лишь энергию вращательного движения молекул. В соответствии с условием резонанса поглощаются только те кванты, энергия которых удовлетворяет условию
hν = ΔE .
При этом возникают вращательные спектры поглощения молекул.
Энергии квантов инфракрасного излучения достаточно для изменения как вращательной, так и колебательной энергии молекул, поэтому при облучении вещества таким излучением возникают вращательно-колебательные, или ИК-спектры.
К ванты
видимого света (длина волны от ~400 до
~760 нм) и ультрафиолетового излучения
(длина волны менее ~400 нм) имеют энергию
достаточную для увеличения энергии
электронных оболочек молекул. В самом
общем виде энергетические уровни
электронов в молекуле можно представить
следующим образом.
ванты
видимого света (длина волны от ~400 до
~760 нм) и ультрафиолетового излучения
(длина волны менее ~400 нм) имеют энергию
достаточную для увеличения энергии
электронных оболочек молекул. В самом
общем виде энергетические уровни
электронов в молекуле можно представить
следующим образом.
Если
внешние электроны в молекуле находятся
только на связывающих молекулярных
орбиталях, как в молекулах насыщенных
углеводородов, при поглощении энергии
происходит переход одного из них на
разрыхляющую *молекулярную
орбиталь. Величина ΔE
для
− *
перехода довольно велика, поэтому в
данном случае поглощаются кванты только
с очень большой энергией. Такой энергии
соответствует жесткое ультрафиолетовое
излучение с высокой частотой и малой
длиной волны (λмакс.
< 15010-9
м, или 150 нм), практически недоступной
для серийных спектрометров. Если в
молекуле вещества имеются группировки
с заполненными связывающими
![]() молекулярными
орбиталями, такие как C=C, N=N, N=C, C=O, C=S и
т.д., при поглощении квантов электромагнитного
излучения происходит переход одного
из
электронов
на разрыхляющую
молекулярными
орбиталями, такие как C=C, N=N, N=C, C=O, C=S и
т.д., при поглощении квантов электромагнитного
излучения происходит переход одного
из
электронов
на разрыхляющую
![]() молекулярную
орбиталь. Величина ΔE
в этом случае значительно меньше чем
для
− *
перехода, поэтому такие молекулы
поглощают излучение с большей длиной
волны, доступной для измерений, "видимой"
для спектрометров. Такие группировки
называются хромофорами
(дословно
придающими окраску).
молекулярную
орбиталь. Величина ΔE
в этом случае значительно меньше чем
для
− *
перехода, поэтому такие молекулы
поглощают излучение с большей длиной
волны, доступной для измерений, "видимой"
для спектрометров. Такие группировки
называются хромофорами
(дословно
придающими окраску).
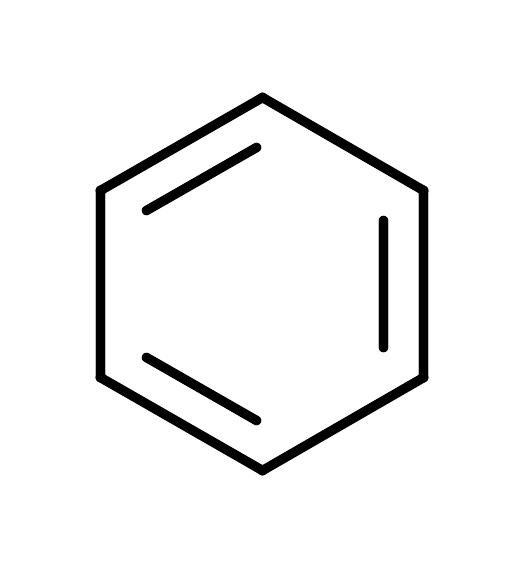
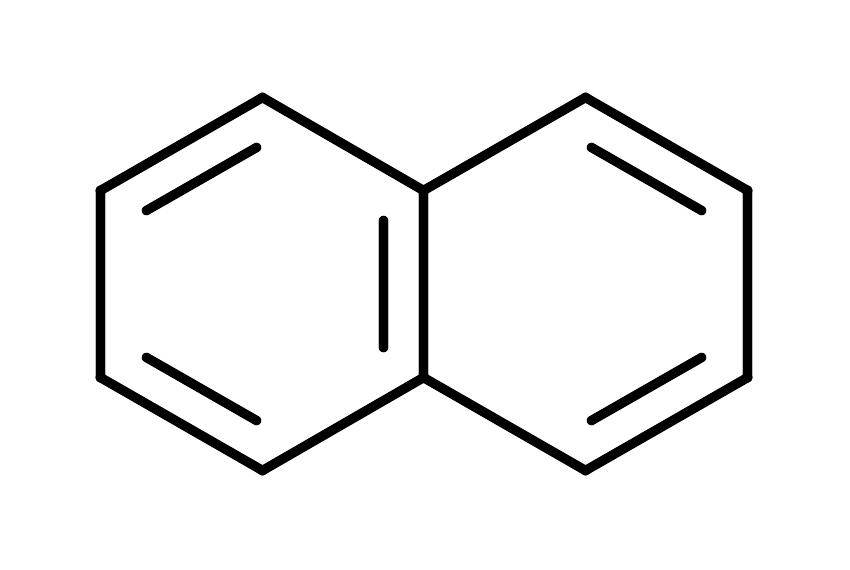
Формула |
λмакс. , нм |
Формула |
λмакс. , нм |
CH2=CH2 |
165 |
|
200 |
CH2=CHCH=CH2 |
217 |
|
286 |
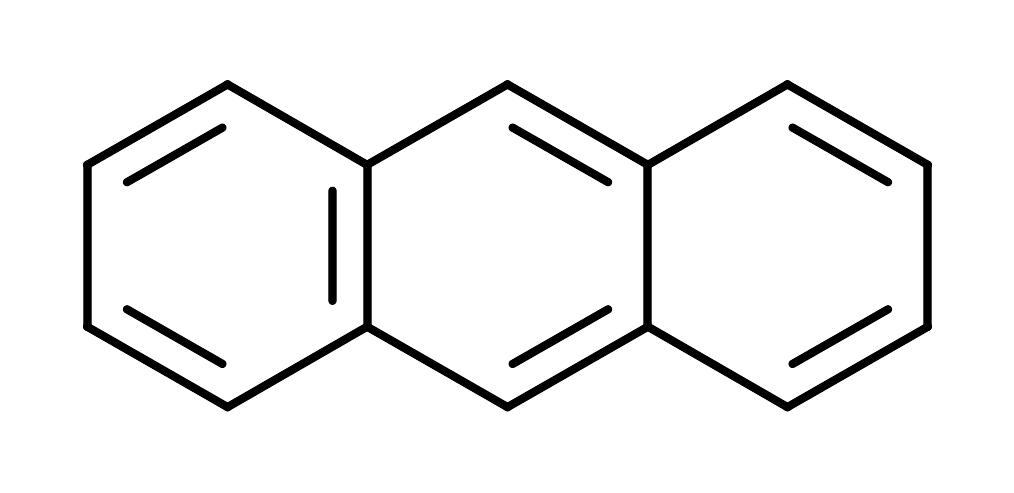
CH2=CHCH=CHCH=CH2 |
250 |
|
375 |
Чем больше в молекуле сопряженных друг с другом хромофоров, тем меньше величина ΔE, тем больше длина волны поглощаемого излучения.
Если кроме хромофорных групп в молекуле имеются сопряженные с ними группировки, содержащие заполненные электронами несвязывающие n молекулярные орбитали (свободные электронные пары), появляется возможность для n перехода. Поскольку ΔE для него довольно мала, то длина волны поглощаемого излучения в таких молекулах значительно увеличивается. Группировки, сдвигающие поглощение в длинноволновую область, называются ауксохромами. Типичными ауксохромами являются атомы азота, входящие в аминогруппы, спиртовые и эфирные атомы кислорода, атомы галогенов и т.д.:
![]()
то есть группировки NH2, OH, OR, Cl и другие. Типичным примером влияния ауксохрома на спектр поглощения молекулы является введение гидроксильной группы в молекулу нитробензола. Под влиянием ауксохрома OH полоса поглощения нитробензола смещается в длинноволновую область от 250 нм для нитробензола до 320 нм для п-нитрофенола:
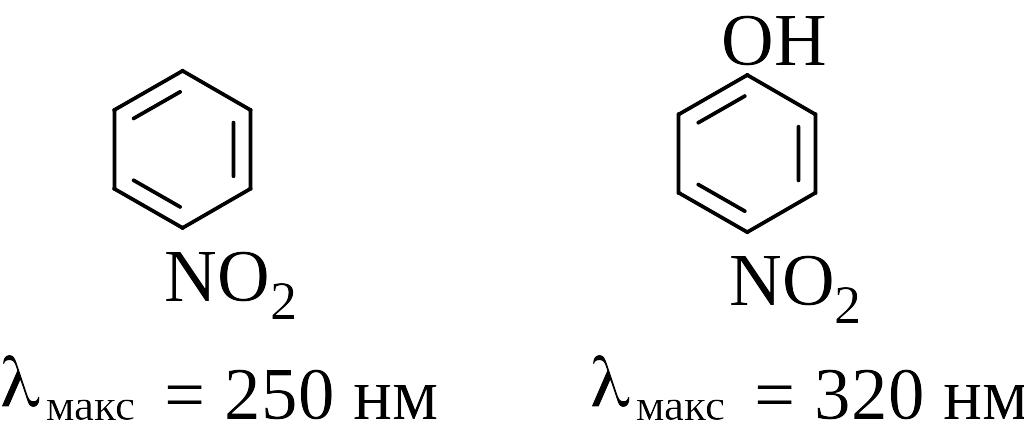 .
.
Согласно закону светопоглощения Бугера-Ламберта-Бера степень уменьшения интенсивности света пропорциональна числу поглощающих свет частиц. Если выделить элементарный объем с площадью S=1 см2 и толщиной dl см, то входящий в него поток света с интенсивностью I Дж/см2 уменьшится на величину dI:
![]()
где dN-число частиц в элементарном объеме dV = Sdl. Так как S=1 см2, то dV = dl см3. Если концентрация поглощающих свет частиц равна C моль/л, то величина dN = CNAdV 10-3 частиц (NA = 6.021023 моль-1 число Авогадро) и значит
![]() .
.
При прохождении света через слой среды толщиной l его интенсивность уменьшится от Io до I . После интегрирования от Io до I и от 0 до l можно получить

![]() ;
или
;
или
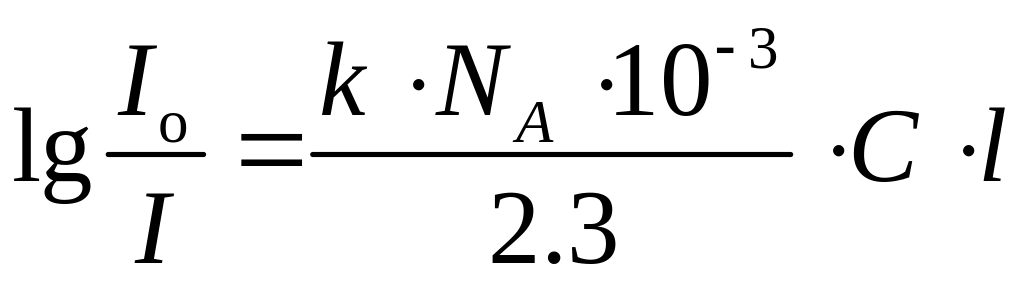 .
.
Если
обозначить
![]()
оптическая
плотность среды,
в логарифмическом масштабе показывающая
во сколько раз уменьшилась интенсивность
света после прохождения через среду, а
оптическая
плотность среды,
в логарифмическом масштабе показывающая
во сколько раз уменьшилась интенсивность
света после прохождения через среду, а

молярный коэффициент экстинкции,
численно равный оптической плотности
среды с толщиной слоя 1 см и концентрацией
частиц 1 моль/л, то закон светопоглощения
можно записать как
молярный коэффициент экстинкции,
численно равный оптической плотности
среды с толщиной слоя 1 см и концентрацией
частиц 1 моль/л, то закон светопоглощения
можно записать как
![]()
Оптическая
плотность среды пропорциональна мольной
концентрации частиц поглощающих свет
и толщине поглощающего слоя.
Величина молярного коэффициента
экстинкции ![]() зависит от свойств частиц и длины волны
света. Зависимость коэффициента
экстинкции от длины волны является
характеристикой данного вещества и
называется его электронным спектром
поглощения.
зависит от свойств частиц и длины волны
света. Зависимость коэффициента
экстинкции от длины волны является
характеристикой данного вещества и
называется его электронным спектром
поглощения.
П ри
постоянной толщине поглощающего слоя
(l)
оптическая
плотность D
раствора вещества при данной длине
волны пропорциональна его концентрации.
График зависимости D
от
C называется
калибровочным. Его строят, измеряя
оптические плотности растворов с
известной концентрацией вещества. Чаще
всего график является линейным лишь в
достаточно разбавленных растворах, в
которых закон Бугера-Ламберта-Бера
выполняется точно (ε
= const). При относительно больших
концентрациях вещества молярный
коэффициент экстинкции не остается
постоянным и линейность графика
нарушается. Калибровочные графики
используют для определения концентрации
вещества (Cx)
в растворе путем измерения его оптической
плотности (Dx).
В области выполнения закона
Бугера-Ламберта-Бера более удобным
оказывается не графическое определение
концентрации, а ее вычисление с
использованием молярного коэффициента
экстинкции, определяемого как тангенс
угла наклона линейной части калибровочного
графика:
ри
постоянной толщине поглощающего слоя
(l)
оптическая
плотность D
раствора вещества при данной длине
волны пропорциональна его концентрации.
График зависимости D
от
C называется
калибровочным. Его строят, измеряя
оптические плотности растворов с
известной концентрацией вещества. Чаще
всего график является линейным лишь в
достаточно разбавленных растворах, в
которых закон Бугера-Ламберта-Бера
выполняется точно (ε
= const). При относительно больших
концентрациях вещества молярный
коэффициент экстинкции не остается
постоянным и линейность графика
нарушается. Калибровочные графики
используют для определения концентрации
вещества (Cx)
в растворе путем измерения его оптической
плотности (Dx).
В области выполнения закона
Бугера-Ламберта-Бера более удобным
оказывается не графическое определение
концентрации, а ее вычисление с
использованием молярного коэффициента
экстинкции, определяемого как тангенс
угла наклона линейной части калибровочного
графика:
![]() .
.
Для повышения чувствительности фотоколориметрического метода и увеличения его точности измерения проводят при длине волны, соответствующей максимальному значению коэффициента экстинкции.