
- •Часть III. Термохимия и ионные равновесия
- •1.2. Кислотность водных растворов кислот и оснований.
- •1.3. Сила кислот и оснований в водных растворах.
- •1.4. Буферные растворы.
- •1.5. Фотоколориметрический метод анализа.
- •2. Определение термодинамической константы кислотной диссоциации одноцветного индикатора
- •1. Теоретическая часть
- •1.2. Первое начало термодинамики.
- •1.3. Теплоемкость, зависимость ее от температуры, изобарная, изохорная теплоемкости, соотношение между ними.
- •1.4. Теплота растворения, разведения, нейтрализации.
- •2. Определение теплот процессов
- •3. Определение теплоты нейтрализации сильной кислоты
1.2. Кислотность водных растворов кислот и оснований.
Вода является амфипротонным растворителем, в котором даже в отсутствие посторонних веществ устанавливается равновесие:
![]()
Термодинамическая константа этого равновесия имеет вид:

![]()
где
![]() ;
;
![]()
активности ионов, равные произведению
концентрации на коэффициент активности.
Поскольку концентрации образующихся
ионов очень малы, коэффициенты активности
близки к единице (
активности ионов, равные произведению
концентрации на коэффициент активности.
Поскольку концентрации образующихся
ионов очень малы, коэффициенты активности
близки к единице (![]() )
и поэтому активности ионов практически
равны их концентрациям:
)
и поэтому активности ионов практически
равны их концентрациям:
![]() ;
;
![]() .
Концентрацию, а значит и активность
недиссоциированных молекул воды можно
считать при данных условиях величинами
постоянными и не зависящими от степени
диссоциации (при комнатной температуре
.
Концентрацию, а значит и активность
недиссоциированных молекул воды можно
считать при данных условиях величинами
постоянными и не зависящими от степени
диссоциации (при комнатной температуре
![]() ).
Произведение константы равновесия на
активность воды
).
Произведение константы равновесия на
активность воды
![]() называется термодинамической константой
диссоциации воды:
называется термодинамической константой
диссоциации воды:
 .
.
В свою очередь, произведение константы диссоциации на активность воды называется ионным произведением воды:
![]() .
.
При
20С
величина![]() составляет 0.8610-14
моль2/л2.
Поскольку
составляет 0.8610-14
моль2/л2.
Поскольку ![]() , концентрация,
следовательно и активность ионов
гидроксония в воде составляют:
, концентрация,
следовательно и активность ионов
гидроксония в воде составляют: ![]() моль/л. Любой водный раствор с таким
содержанием ионов
моль/л. Любой водный раствор с таким
содержанием ионов ![]() называется нейтральным. Если их
концентрация в растворе больше, раствор
называют кислым, если меньше
щелочным. При добавлении к воде кислоты
увеличивают концентрацию ионов
гидроксония за счет реакции с водой, а
основания
уменьшают, поскольку реагируют с водой
и ионами гидроксония:
называется нейтральным. Если их
концентрация в растворе больше, раствор
называют кислым, если меньше
щелочным. При добавлении к воде кислоты
увеличивают концентрацию ионов
гидроксония за счет реакции с водой, а
основания
уменьшают, поскольку реагируют с водой
и ионами гидроксония:
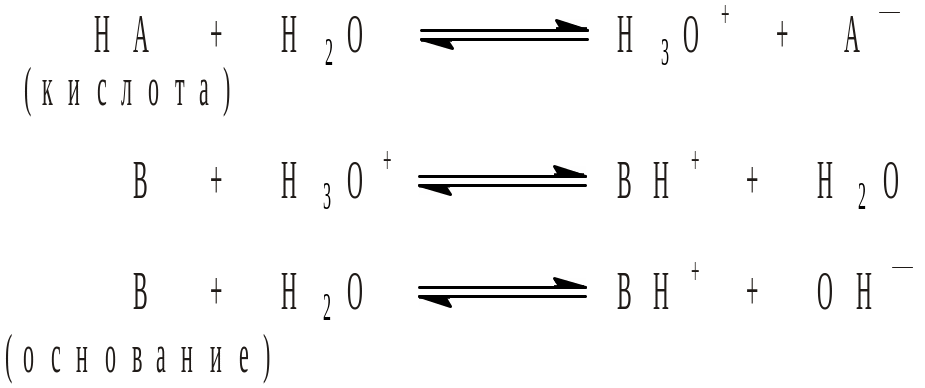
Кислотность раствора, определяемая концентрацией или активностью ионов , численно характеризуется величиной рН, или водородным показателем, равным отрицательному логарифму активности катионов гидроксония:
![]() .
.
Для
нейтрального раствора:![]() .
Кислые растворы имеют рН меньше семи,
щелочные
больше семи. При известном значении рН
активность ионов гидроксония легко
находится как
.
Кислые растворы имеют рН меньше семи,
щелочные
больше семи. При известном значении рН
активность ионов гидроксония легко
находится как ![]() .
.
1.3. Сила кислот и оснований в водных растворах.
Сила кислоты в водном растворе тем больше, чем дальше равновесие
![]()
смещено вправо. Количественно сила кислоты характеризуется величиной термодинамической константы этого равновесия:
![]() .
.
Для
достаточно разбавленных растворов
кислот активность воды не зависит от
степени диссоциации кислоты и является
величиной постоянной и равной ![]() моль/л. Произведение термодинамической
константы этого равновесия на активность
воды называется термодинамической
константой диссоциации кислоты:
моль/л. Произведение термодинамической
константы этого равновесия на активность
воды называется термодинамической
константой диссоциации кислоты:
![]() .
.
Чем больше эта величина, тем в большей степени кислота диссоциирует на ионы, тем больше сила кислоты.
Для характеристики силы основания применяют величину термодинамической константы диссоциации его сопряженной кислоты:
![]()
![]() .
.
Чем меньше эта величина, то есть чем дальше это равновесие смещено влево, тем в большей степени основание B протонируется с образованием его сопряженной кислоты, тем выше сила основания (тем слабее его сопряженная кислота).
На практике пользуются не самими константами, а их отрицательными логарифмами. Логарифмирование приведенных выше уравнений дает:
![]() (1)
(1)
![]() , (2)
, (2)
г де
pKa
= −lgKa
, a pKBH+
= −lgKBH+
.
Анализ
выражений (1) и (2) показывает, что pKa
и pKBH+
равны величинам рН, при которых кислота
или основание ионизированы наполовину
(при aA-
= aHA
и aB
= aBH+
соответственно).
Так, для синильной кислоты (HCN) величина
pKa
= 9.31, а для муравьиной (HCOOH) pKa
= 3.75. Следовательно, для диссоциации
синильной кислоты на 50% необходима
щелочная среда (рН 9.31), в то время как
намного более сильная муравьиная кислота
диссоциирует наполовину даже в кислой
среде (рН 3.75). Аналогично для анилина
C6H5NH2
pKBH+
= 4.63, а для аммиака NH3
pKBH+
= 9.25. Это означает, что слабое основание
анилин превращается на 50% в соль лишь в
кислой среде (рН 4.63), а значительно более
сильное основание аммиак наполовину
превращается в ион аммония даже в весьма
щелочной среде (рН 9.25). Следовательно,
чем меньше величина pKa
, тем сила кислоты больше, а чем меньше
pKBH+
, тем сила основания меньше.
де
pKa
= −lgKa
, a pKBH+
= −lgKBH+
.
Анализ
выражений (1) и (2) показывает, что pKa
и pKBH+
равны величинам рН, при которых кислота
или основание ионизированы наполовину
(при aA-
= aHA
и aB
= aBH+
соответственно).
Так, для синильной кислоты (HCN) величина
pKa
= 9.31, а для муравьиной (HCOOH) pKa
= 3.75. Следовательно, для диссоциации
синильной кислоты на 50% необходима
щелочная среда (рН 9.31), в то время как
намного более сильная муравьиная кислота
диссоциирует наполовину даже в кислой
среде (рН 3.75). Аналогично для анилина
C6H5NH2
pKBH+
= 4.63, а для аммиака NH3
pKBH+
= 9.25. Это означает, что слабое основание
анилин превращается на 50% в соль лишь в
кислой среде (рН 4.63), а значительно более
сильное основание аммиак наполовину
превращается в ион аммония даже в весьма
щелочной среде (рН 9.25). Следовательно,
чем меньше величина pKa
, тем сила кислоты больше, а чем меньше
pKBH+
, тем сила основания меньше.
Рис. 1.Зависимость степени диссоциации слабой кислоты от рН среды.
Графически
зависимость степени диссоциации кислоты
НА от величины рН среды представлена
на рис.1. Зависимость степени протонирования
основания от рН среды имеет вид прямо
противоположный представленному на
рис.1. При pH
= pKBH+
− 2 основание полностью протонировано
и находится в растворе в виде
![]() ,
при pH
= pKBH+
основание протонировано наполовину
(50% его находится в виде свободного
основания В и 50% в виде соли
,
при pH
= pKBH+
основание протонировано наполовину
(50% его находится в виде свободного
основания В и 50% в виде соли
![]() )
и при pH
= pKBH+
+ 2 основание практически не протонировано.
Степень диссоциации кислоты или
протонирования основания в среде с
данным значением рН легко вычислить по
уравнению (1) или (2) соответственно.
)
и при pH
= pKBH+
+ 2 основание практически не протонировано.
Степень диссоциации кислоты или
протонирования основания в среде с
данным значением рН легко вычислить по
уравнению (1) или (2) соответственно.
