
- •Химическая кинетика
- •ПЛАН
- •Основные понятия
- •Скорость химической реакции
- •Скорость химической реакции
- •Классификация химических реакций
- •Классификация химических реакций
- •Простые химические реакции
- •Мономолекулярная реакция
- •Бимолекулярная реакция
- •Трехмолекулярная реакция
- •Сложные реакции
- •Последовательные реакции
- •Параллельные реакции
- •Цепные реакции
- •Закон действующих масс (Гульдберг и Вааге)
- •ПРИМЕР:
- •Порядок реакции
- •ПРИМЕР:
- •ПРИМЕР:
- •Графическое определение порядка реакции
- •Графическое определение порядка реакции в координатах (C; t)
- •Влияние температуры на скорость химической реакции.
- •Температурный коэффициент
- •Пример:
- •Решение:
- •Пример:
- •Энергия активации
- •Важно!
- •Реакция начинается только между теми частицами, которые обладают повышенной энергией, такие частицы при
- •Уравнение Аррениуса
- •Графический метод определения энергии активации
- •Аналитический метод определения энергии активации
- •Энергия активации
- •Скорость химической реакции в значительной мере зависит от энергии активации. Для подавляющего большинства
- •Влияние давления на скорость химической реакции
- •↑ давления → ↑ конц-ции газа → ↑ v х.р.
- •Пример:
- •КАТАЛИЗ
- •Катализ
- •Катализаторы
- •Иначе говоря, в присутствии катализатора возникают другие активированные комплексы, причем для их образования
- •Таким образом в присутствии
- •Пример
- •КАТАЛИЗ
- •Пример гомогенного катализа
- •Пример гетерогенного катализа
- •Эффективность гетерогенных катализаторов обычно намного больше чем гомогенных.
- •Последнее связано с тем, что каталитическая реакция идет на поверхности катализатора и включает
- •Сорбция - поглощение газа или жидкого вещества твердым
- •Различают:
- •Пример
- •Выводы:

ПРИМЕР:
V k C0,4 C0,3
H 2 O2
порядок по водороду - 0,4
порядок по кислороду – 0,3
сумма равна 0,7
порядок реакции не совпадает со стехиометрическими коэффициентами.
Молекулярность равна трем.
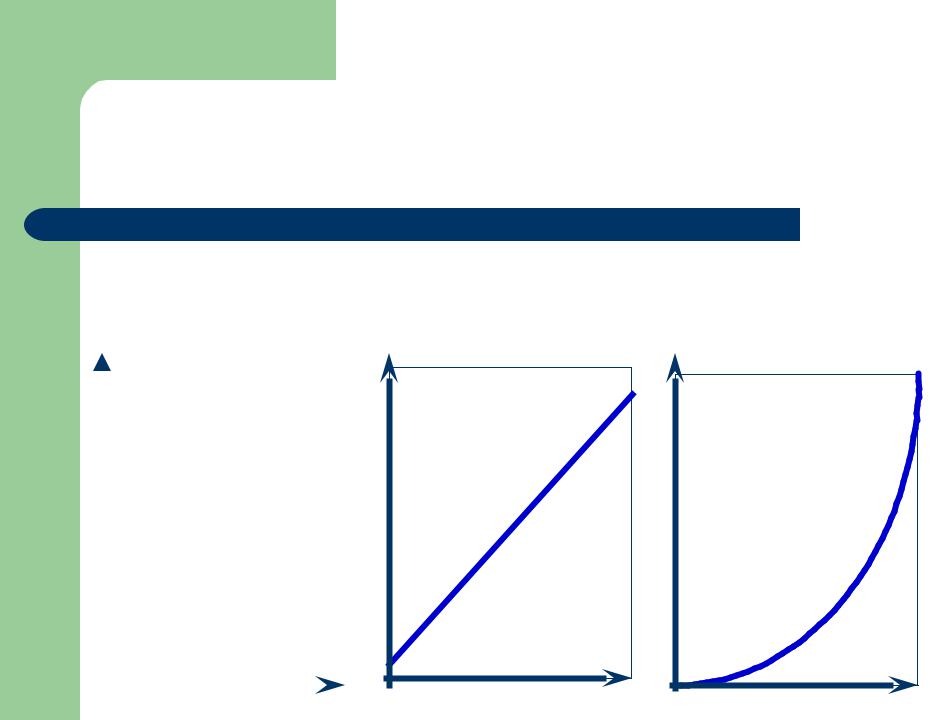
Графическое определение порядка реакции
|
|
а) n=0 |
б) n=1 |
в) n>1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Графическое определение порядка реакции в координатах (C; t)
Если построить зависимость в координатах концентрация от времени, то можно определить как порядок реакции, так и константу.

Влияние температуры на скорость химической реакции.
Правило Вант-Гоффа:
Чем выше температура, тем больше скорость химической реакции.
При увеличении температуры на каждые 100 скорость химической реакции увеличивается в 2-4 раза .

Температурный коэффициент
|
V2 |
T2 T1 |
|
|
10 |
||
|
|||
V |
|||
|
|
||
1 |
|
||
Где Т2 > Т1
γ –
температурный
коэффициент Вант-Гоффа, показывает во сколько раз возросла скорость химической реакции.

Пример:
Во сколько раз увеличится скорость химической реакции при повышении температуры от 200-500 ºС, если температурный коэффициент γ= 2?

Решение:
V2 V1
V2 V1
T2 T1
10
T2 T1 |
500 200 |
230 |
10 |
2 10 |

Пример:
При 100 ºС реакция идет за 16 минут , сколько времени надо при 140 ºС, температурный коэффициент равен 2?

Энергия активации
Первое условие протекания реакции является столкновение реагирующих молекул, но не каждое столкновение приводит к реакции, реагируют только те молекулы, у которых кинетическая ЕК достаточна для преодоления отталкивания электронных оболочек, эта повышенная энергия достаточная для взаимодействия молекул, называется
энергией активации Еа кДж/моль.

Важно!
Энергия активации характеристика реакции в целом, а не для вещества.
Энергия активации - это наименьшая энергия необходимая для того, чтобы молекула прореагировала.
