
контрольная_раббота1
.doc|
№ варианта |
1 |
2 |
5 |
6 |
9 |
|
30 |
14 |
28 |
61 |
85 |
101 |
Контрольная работа №1
№ 14
Из 1,35 г оксида металла получается 3,15г его нитрата. Вычислить эквивалентную массу его металла.
Решение
Формула: m(оксида)/m(соли) = (Mэ(Ме) + Mэ(О))/ (Mэ(Ме) + Mэ(NO3)2)
Значит: 1,35/3,15= (х+8*2)/(x+62*2)
1,35х + 167,4 = 3,15х + 50,4
1,8х = 117
х = 65г/моль Это химический элемент Cu(медь).
Ответ: 65г/моль, медь.
№ 28
На основании квантово-механических законов объясните, могут ли np-электроны содержаться во внешнем слое оболочки атома, если она включает конфигурации ns2, ns1,(n-1)d10, (n-1)f3. Приведите соответствующие примеры.
Решение
Согласно квантово-механическому закону минимальной энергии: электроны в основном состоянии заполняют орбитали в порядке повышения уровня энергии, а также согласно принципу запрета Паули: в атоме не может быть двух электронов с одинаковым набором 4 квантовых чисел, можно сделать следующие выводы:
ns2 примеры: С, N,O,F,Al,Si,P,S,Cl
ns1 нет таких элементов в таблице с данной конфигурацией
(n-1)d10 примеры: Tl,Pb,Bi,Po,At
(n-1)f3 нет (переходные элементы)
№ 61
Определите скорость химической реакции: N2(г) + 3H2(г) = 2NH3(г) при исходных концентрациях [N2]=2моль/л и [H2]=8моль/л и в момент времени, когда концентрация азота уменьшилась на 10%.
Решение
Формула: V1= k*[ N2]*[ H2]^3
V1 = k*2*8^3
V2 = k*1,8*8^3
V2/V1 = 0,9
Ответ: 0,9.
№ 85
В сосуде емкостью 10 л установилось равновесие в газовой системе: CO+ Cl2 = COCl2 + Q. Состав равновесной системы: 11г СО, 36г Cl2, 42г COCl2. Вычислите константу равновесие (Kc) и исходные концентрации CO и Cl2. Как изменится численное значение Кс при увеличении температуры и почему?
Решение
m(CO)= 11г n(CO)=11/28=0,392 C(CO)=0,392/10=0,0392
m(Cl2)= 36г n(Cl2)=36/71=0,507 C(Cl2)=0,507/10=0,0507
m(COCl2)= 42г n(COCl2)=42/101=0,416 C(COCl2)=0,416/10=0,0416
CO+ Cl2 = COCl2
1 1 1
0,0424 0,0424 0,0424
Нужно ещё 0,0392 и 0,0507. Тогда:
C(CO)исх=0,0816 С(Cl2)исх=0,0923
K(c)= C(COCl2)/C(CO)*C(Cl2)
K(c)= 0,0416/0,0392*0,0507=20,93
Если повысить температуру, то константа равновесия уменьшится, т.к. реакция экзотермическая (с выделением теплоты).
Ответ: 20,93; н0,0808 и 0,0923.
№ 101
В 1л раствора содержится 0,28г KOH. Вычислить pH раствора, считая диссоциацию KOH полной.
Решение
KOH -> K+ + OH-
Cм = m/M*V
Cм = 0,28/56*1=0,005моль/л
Сон- = См*α*n=5-3 моль/л
pOH= - lgCoн- = -lg 0,005 = 2,3
pH = 14-2,3 = 11,7
Ответ: 11,7.
Контрольная работа №2
|
№ варианта |
12 |
13 |
14 |
15 |
|
30 |
117 |
131 |
142 |
179 |
№ 117
Для реакции CO(г) + Н2О(г) = СО2(г) + Н2(г) идущей в газовой фазе при температуре 298 К, ∆Н0298 = -41,2 кДж. Можно ли при повышении температуры увеличить выход водорода?
Решение
Формула: ∆Н0т = ∆Н0298 + ∆С0Р298 *(Т - 298)
Пусть Т увеличили до 500 К. Тогда:
∆Н0500 = ∆Н0298 + ∆С0Р298 (500 - 298)
∆С0Р298 = ∆С0Р(СО2) + ∆С0Р(Н2) - ∆С0Р(СО) - ∆С0Р(Н2О)
∆С0Р298 = 37,11 +28,83 – 29,14 – 33,61 = 3,19 Дж*моль/К
∆Н0500 = -41,12 + 0,0319(202) = -34,6762 кДж/моль.
Т.к. ∆Н отрицательная, то реакция эндотермическая, следовательно, увеличение температуры ведет к смещению равновесия в сторону продуктов реакции. Значит, при увеличении температуры увеличится выход водорода, т.к. ∆Н увеличилась при новой температуре 500К.
Ответ: -34,6762 кДж/моль, выход водорода можно увеличить.
№ 131
Укажите, при каких условиях можно создать гальванически элемент из 2 электродов 1-ого рода одинаково химической породы. Приведите пример такого элемента, уравнения анодно-катодных процессов и рассчитайте ЭДС, ∆G, A’М.
Решение
Элементы Даниэля-Якоби состоят из 2 электродов 1-ого рода одинаково химической породы: каждый электрод обратим относительно собственных ионов в растворе электролита.
Zn + Cu2+ = Zn2+ + Cu
Ɛ = ɸ0Cu(2+)/Cu - ɸpZn(2+)/Zn
ɸZn = ɸ0Zn + 0,059/2*lg10-2 ɸZn = -0,763 – 0,059 = -0,822
ɸCu = 0,377 ɸZn = -0,763 Cp(Zn)= 25,4 Дж/моль*К
Ɛ = 0,337 – 0,822 = -0,485 B
A’М = n*F* Ɛ = 96500*(-0,485)*2= -93605кДж
∆G = - A’М = +93605кДж
Ответ: -0,485 B; -93605кДж; +93605кДж.
№ 142
Через серебряный кулонометр пропускали ток в течении 3 часов. Амперметр показывал силу тока 0,9А. Определите процент погрешности амперметра, если масса катода увеличилась на 12,32г. Составьте схему электролиза на электродах из Pt, учитывая, что на аноде выделится О2, и определите его объем.
Решение
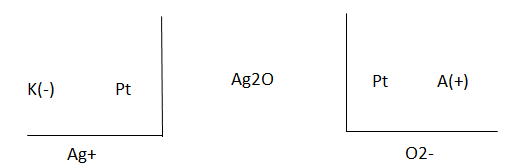
2Ag2O = 4Ag + O2
K: 4Ag+ + 4e = 4Ag(т)
А: 2О2- - 4е = О2(г)
12,32г Хл
2Ag2O = 4Ag + O2
230,2г/моль 107,1г/моль 22,4г/моль
460,4 428,4
х = 12,32*22,4/428,4 = 0,644л
V(O2) = 0,644л
m1=10800*0,9 = 9720г
m2= 9720+12,32 = 9732,32г
% погрешности = 9732,32/10800 = 0,9011/0,9*100 = 1%
Ответ: 1%; 0,644л.
№ 179
Объясните термодинамическую стабильность серебра и нестабильность меди в условиях нейтральной среды(Н2О, О2). Ответ подтвердите уравнениями соответствующих процессов.
Решение
2Cu + O2 + 2H2O + 4e = 2Cu(OH)2
4Ag + O2 + 2H2O + 4e = 4AgOH
ɸ0298(Ag) = +0,799B
ɸ0298(Cu) = +0,377B ɸ0298(Ag) - ɸ0298(Cu) = 0,336B
Т.к. электродный потенциал серебра больше электродного потенциала меди на 0,336В,
следовательно Ag более устойчив.
